Bài 9 trang 90 SGK Hóa học 10
Cân bằng các phương trình phản ứng oxi hoá - khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hoá ở mỗi phản ứng :
Đề bài
Cân bằng các phương trình phản ứng oxi hoá - khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hoá ở mỗi phản ứng :
a) Al + Fe3O4 \(\buildrel {{t^0}} \over\longrightarrow\) Al2O3 + Fe
b) FeSO4 + KМnО4 + H2SO4 ⟶ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 \(\buildrel {{t^0}} \over\longrightarrow\) Fe2O3 + SO2
d) KClO3 \(\buildrel {{t^0}} \over\longrightarrow\) KCl + O2
e) Cl2+ KOH \(\buildrel {{t^0}} \over\longrightarrow\) KCl + KClO3 + H2O.
Video hướng dẫn giải
Phương pháp giải - Xem chi tiết
Các bước để cân bằng phản ứng oxi hóa khử
Bước 1: xác định số oxi hóa của các chất trước và sau phản ứng, để tìm chất khử và chất oxi hóa
Bước 2: Viết quá trình oxi hóa khử, cân bằng mỗi quá trình
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử, sao cho tổng số electron chất nhận = chất nhường
Bước 4: Đặt các hệ số của chất khử và chất oxi hóa vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
Lời giải chi tiết
a) 8Al + 3Fe3O4 ⟶ 4Al2O3 + 9Fe
\(\left. \matrix{2{\rm{A}}{l^0} - 2.3{\rm{e}} \to {\rm{2A}}{l^{ + 3}} \hfill \cr 3F{{\rm{e}}^{ + {8 \over 3}}} + 3.{8 \over 3}e \to 3F{{\rm{e}}^0} \hfill \cr} \right|\matrix{{ \times 4} \cr { \times 3} \cr} \)
Chất khử: Al
Chất oxi hóa \(Fe_3O_4\)
b) 10FeSO4 + 2KМnО4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
\(\left. \matrix{2F{{\rm{e}}^{ + 2}} - 2{\rm{e}} \to 2F{{\rm{e}}^{ + 3}} \hfill \cr M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}} \hfill \cr} \right|\matrix{{ \times 5} \cr { \times 2} \cr} \)
Chất khử: \(FeSO_4\)
Chất oxi hóa: \(KMnO_4\)
c) 4FeS2 + 11O2 ⟶ 2Fe2O3 + 8SO2↑
\(\matrix{
F{{\rm{e}}^{ + 2}} - 1{\rm{e}} \to F{{\rm{e}}^{ + 3}} \hfill \cr
2{{\rm{S}}^{ - 1}} - 2.5{\rm{e}} \to 2{{\rm{S}}^{ + 4}} \hfill \cr} \)
\(\left. \matrix{Fe{S_2} - 11e \to F{e^{ + 3}} + 2{S^{ + 4}} \hfill \cr O_2^0 - 2.2e \to 2{O_2} \hfill \cr} \right|\matrix{{ \times 4} \cr { \times 11} \cr} \)
Chất khử: \(FeS_2\)
Chất oxi hóa: \(O_2\)
d) 2KClO3 ⟶ 2KCl + 3O2↑
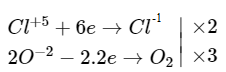
e) 3Cl2 + 6KOH \(\buildrel {{t^0}} \over\longrightarrow\) 5KCl + KClO3 + 3H2O.
\(\left. \matrix{Cl_2^0 - 10e \to 2C{l^{ + 5}} \hfill \cr Cl_2^0 + 2e \to 2C{l^{ - 1}} \hfill \cr} \right|\matrix{{ \times 1} \cr { \times 5} \cr} \)
\(Cl_2\) vừa là chất khử, vừa là chất oxi hóa
Loigiaihay.com
Các bài khác cùng chuyên mục













Danh sách bình luận