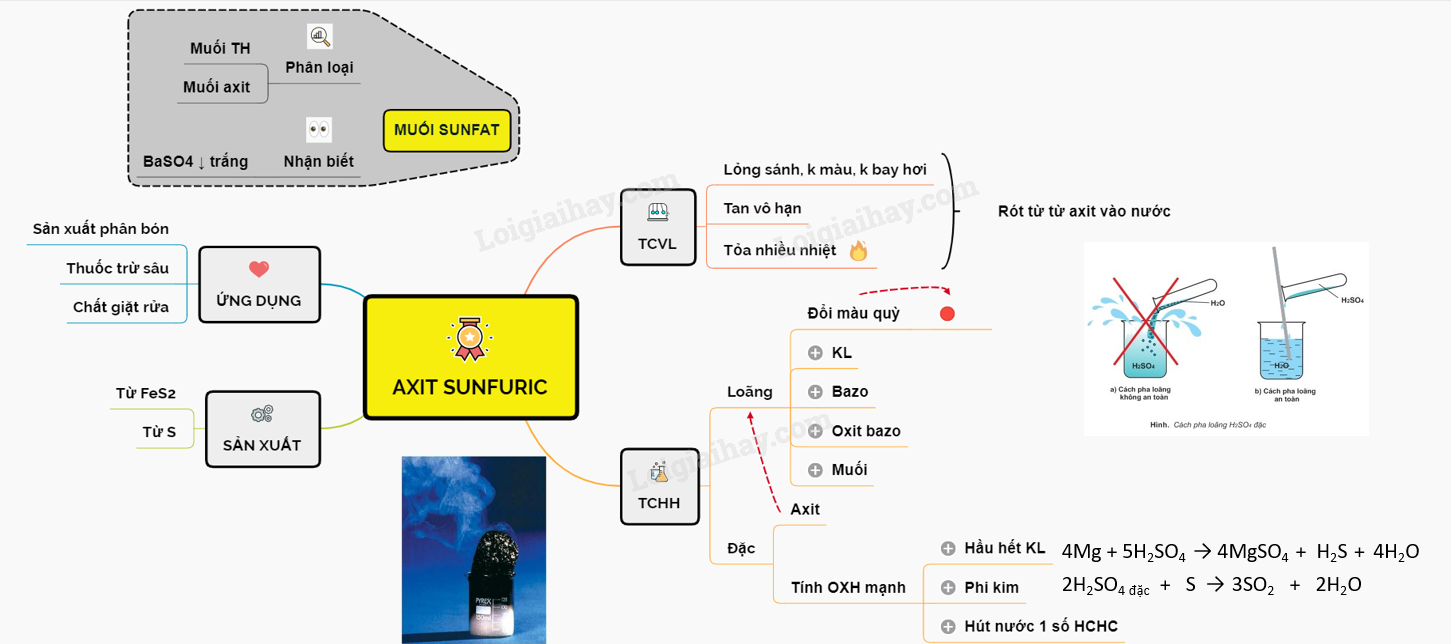
Bài 33: Axit sunfuric - Muối sunfat
Axit sunfuric là ....
I. AXIT SUNFURIC
1. TÍNH CHẤT VẬT LÍ
- Axit sunfuric là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gấp 2 lần nước.
- Tan vô hạn trong nước và tỏa rất nhiều nhiệt.
* Lưu ý: để pha loãng dung dịch H2SO4 đặc, ta cần rót từ từ axit vào nước, khuấy nhẹ và không làm ngược lại.
2. TÍNH CHẤT HÓA HỌC
a. Tính chất của dung dịch H2SO4 loãng
- H2SO4 loãng mang những tính chất chung của một axit
- Làm đỏ quì tím, tác dụng kim loại (trước H) giải phóng H2, tácdụng bazơ, oxit bazơ và nhiều muối.
H2SO4 + Fe → FeSO4 + H2
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + CuO → CuSO4 + H2O
H2SO4 + BaCl2 → BaSO4¯ + 2HCl
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2
b. Tính chất của dung dịch H2SO4 đặc
H2SO4 đặc ngoài mang tính chất của một axit, chúng còn có tính oxi hóa mạnh
● Tác dụng với kim loại : Axit H2SO4 đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại có tính khử mạnh).
2Fe + 6H2SO4 \(\xrightarrow{{{t}^{o}}}\) Fe2(SO4)3 + 3SO2 + 6H2O
3Zn + 4H2SO4 \(\xrightarrow{{{t}^{o}}}\) 3ZnSO4 + S + 4H2O
4Mg + 5H2SO4 \(\xrightarrow{{{t}^{o}}}\) 4MgSO4 + H2S + 4H2O
Lưu ý: Al, Fe, Cr không tác dụng với dung dịch H2SO4 đặc nguội.
● Tác dụng với phi kim : Tác dụng với các phi kim dạng rắn (to) tạo hợp chất của phi kim ứng với số oxi hóa cao nhất.
2H2SO4 đặc + S \(\xrightarrow{{{t}^{o}}}\) 3SO2 + 2H2O
5H2SO4 đặc + 2P \(\xrightarrow{{{t}^{o}}}\) 2H3PO4 + 5SO2 + 2H2O
● Hút nước một số hợp chất hữu cơ
C12H22O11 + H2SO4 đặc → 12C + 11 H2O
Sau đó: 2H2SO4 đặc + C → CO2 + 2SO2 + 2H2O
III. ỨNG DỤNG
- Axit sunfuric là chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4.
- Sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, ....
IV. SẢN XUẤT AXIT SUNFURIC
● Từ FeS2
4FeS2 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3 + 8SO2
2SO2 + O2 \(\underrightarrow {{V_2}{O_5},{t^o}}\) 2SO3
nSO3 + H2SO4 → H2SO4.nSO3
H2SO4.nSO3 + H2O → (n +1)H2SO4
● Từ S
S + O2 \(\xrightarrow{{{t}^{o}}}\) SO2
2SO2 + O2 \(\underrightarrow {{V_2}{O_5},{t^o}}\) 2SO3
SO3 + nH2SO4 → H2SO4.nSO3
H2SO4.nSO3 + H2O → (n +1)H2SO4
Video mô phỏng - Sản xuất H2SO4
II. MUỐI SUNFAT, NHẬN BIẾT ION SUNFAT
1. MUỐI SUNFAT
Có 2 loại muối sunfat:
- Muối trung hòa: Chứa ion SO42-. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan
- Muối axit: Chứa ion HSO4-
2. NHẬN BIẾT ION SUNFAT
Ta dùng dung dịch muối bari hoặc Ba(OH)2. Sản phẩm tạo thành BaSO4 có kết tủa trắng, không tan trong axit.
H2SO4 + BaCl2 → BaSO4 + 2HCl
Sơ đồ tư duy: Axit sunfuric - Muối sunfat
Loigiaihay.com
Các bài khác cùng chuyên mục













Danh sách bình luận