 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh tri..
Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh tri..
Bài 32: Hidro sunfua - Lưu huỳnh dioxit - Lưu huỳnh trioxit
Hidro sunfua là ....
A. HIĐRO SUNFUA
I. TÍNH CHẤT VẬT LÍ
- Hidro sunfua là chất khí, không màu, mùi trứng thối và rất độc.
- Hơi nặng hơn không khí, tan ít trong nước.
II. TÍNH CHẤT HÓA HỌC
- Hidro sunfua tan trong nước tạo thành dung dịch axit rất yếu tên là axit sunfuhidric
1. Tính axit yếu
- Khi tác dụng dung dịch kiềm có thể tạo muối axit hoặc muối trung hoà
H2S + NaOH \(\xrightarrow{1\,\,:\,\,1}\)NaHS +H2O nếu \(\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,\le \,\,1\)
H2S + 2NaOH \(\xrightarrow{1\,\,:\,\,2}\) Na2S+2H2O nếu \(\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,\ge \,\,2\)
- Nếu \(1\,\,<\,\,\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{2}}S}}}\,\,<\,\,2\) thì phản ứng tạo ra đồng thời cả hai muối NaHS và Na2S
2. Tính khử mạnh
- H2S là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (–2).
2H2S + 3O2(dư) \(\xrightarrow{t{}^{o}}\) 2H2O + 2SO2
2H2S + O2 (thiếu)\(\xrightarrow{t{}^{o}}\)2H2O + 2S
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
III. TRẠNG THÁI TỰ NHIÊN VÀ ĐIỀU CHẾ
- Trong tự nhiên, hidro sunfua có trong một số nước suối, khí núi lửa, xác chết người, động vật
- Trong công nghiệp, người ta không sản xuất khí hidro sunfua. Trong phòng thí nghiệm, cho muối sunfua tác dụng với dung dịch HCl
FeS + 2HCl → FeCl2 + H2S
B. LƯU HUỲNH ĐIOXIT
I. TÍNH CHẤT VẬT LÍ
- Lưu huỳnh dioxit là chất khí không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
- Khí SO2 là khí độc, có thể gây viêm đường hô hấp.
II. TÍNH CHẤT HÓA HỌC
Trong phân tử SO2 lưu huỳnh có số oxi hóa trung gian +4, do đó khí SO2 vừa là chất khử, vừa là chất oxi hoá.
1. Tính khử
Khi gặp chất oxi hoá mạnh (O2, Cl2, Br2...), khí SO2 thể hiện tính khử :
2SO2 + O2 \(\overset{{{\text{V}}_{2}}{{\text{O}}_{5}}\text{,}\,\,\text{45}{{\text{0}}^{o}}C-{{500}^{o}}C}{leftrightarrows}\) 2SO3
SO2 + Cl2 + 2H2O \(\to \) 2HCl + H2SO4
2. Tính oxi hóa
Khi gặp các chất khử mạnh (H2S, Mg, Al...), khí SO2 thể hiện tính oxi hóa :
SO2 + 2H2S \(\to \) 2H2O + 3S
SO2 + 2Mg \(\xrightarrow{{{t}^{o}}}\) 2MgO + S
3. SO2 là một oxit axit
SO2 + NaOH \(\xrightarrow{1\,\,:\,\,1}\) NaHSO3 \((\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\le \,\,1)\)
SO2 + 2 NaOH \(\xrightarrow{1\,\,:\,\,2}\) Na2SO3+H2O \((\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\ge \,\,2)\)
- Nếu \((1\,\,\le \,\,\frac{{{n}_{NaOH}}}{{{n}_{S{{O}_{2}}}}}\,\,\le \,\,2)\) thì tạo ra cả hai muối trung hòa và muối axit
III. ỨNG DỤNG VÀ ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT
1. Ứng dụng
- Sản xuất H2SO4 trong công nghiệp, làm chất tẩy trắng giấy, bột giấy, chất chống nấm mốc lương thực, thực phẩm.
2. Điều chế lưu huỳnh đioxit
- Trong phòng thí nghiệm: Đun nóng H2SO4 với Na2SO3
H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
- Trong công nghiệp: Đốt S hoặc quặng pirit sắt:
FeS2 + O2 \(\xrightarrow{{{t}^{o}}}\) Fe2O3 + SO2
C. LƯU HUỲNH TRIOXIT
I. TÍNH CHẤT
- Lưu huỳnh trioxit là chất lỏng không màu, tan vô hạn trong nước và axit sunfuric.
- SO3 là một oxit axit
+ Tác dụng với nước:
SO3 + H2O → H2SO4
+ Tác dụng với dung dịch kiềm:
SO3 + 2NaOH → Na2SO4 + H2O
+ Tác dụng với oxit bazo:
SO3 + CaO → CaSO4
- SO3 tan vô hạn trong H2SO4 tạo thành oleum: H2SO4.nSO3.
II. ỨNG DỤNG VÀ SẢN XUẤT
- Ít có ứng dụng thực tế, nhưng lại là sản phẩm trung gian để sản xuất axit sunfuric
- Người ta sản xuất lưu huỳnh tri oxit bằng cách oxi hóa lưu huỳnh dioxit.
Sơ đồ tư duy: Hidro sunfua - Lưu huỳnh dioxit - Lưu huỳnh trioxit
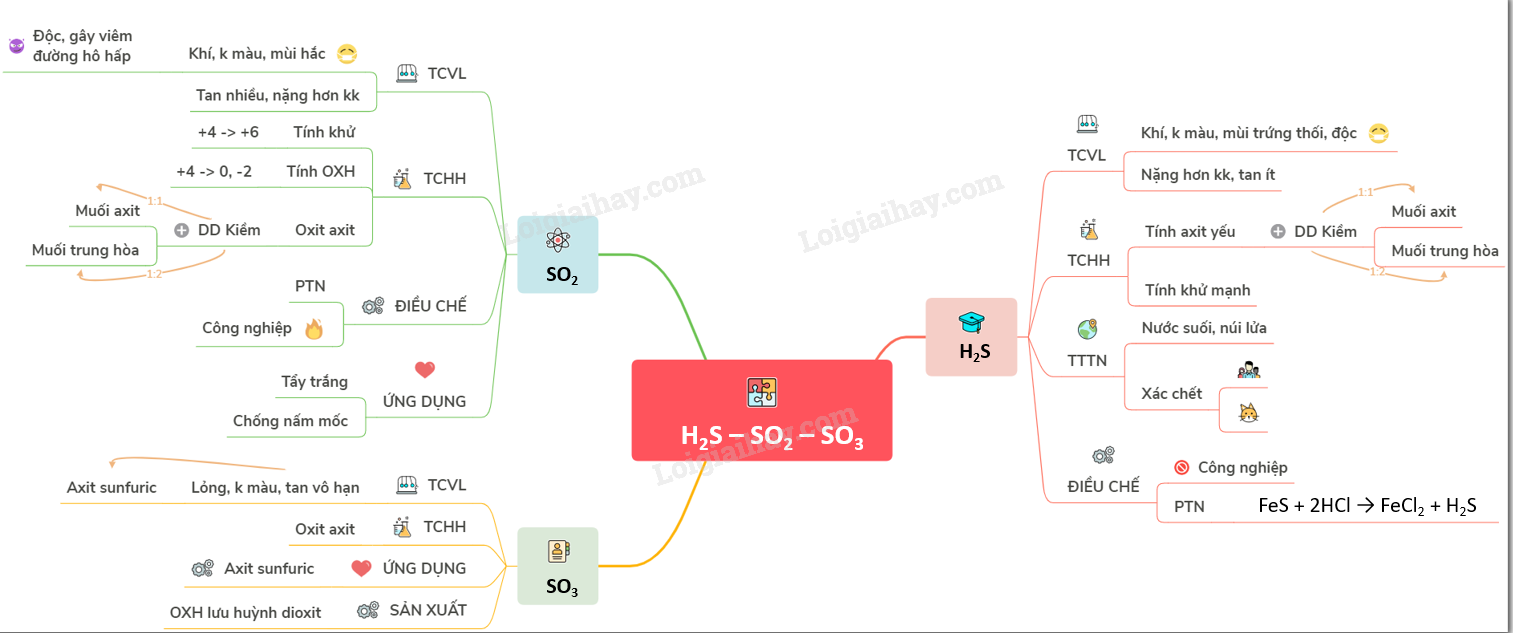
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận