 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
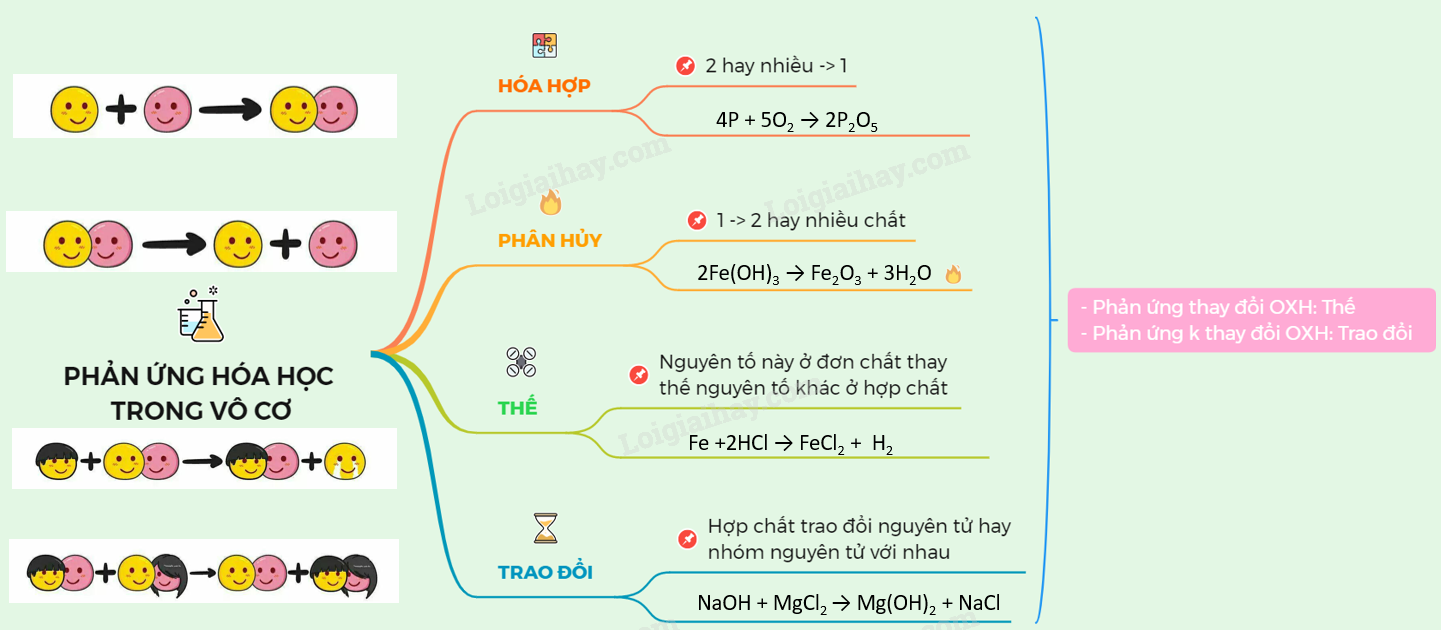
 Bài 18. Phân loại phản ứng trong hoá học vô cơ
Bài 18. Phân loại phản ứng trong hoá học vô cơ
Lý thuyết phân loại phản ứng trong hoá học vô cơ
I – PHẢN ỨNG CÓ SỰ THAY ĐỔI SỐ OXI HOÁ VÀ PHẢN ỨNG KHÔNG CÓ SỰ THAY ĐỔI SỐ OXI HOÁ
I . PHẢN ỨNG CÓ SỰ THAY ĐỔI SỐ OXI HOÁ VÀ PHẢN ỨNG KHÔNG CÓ SỰ THAY ĐỔI SỐ OXI HOÁ
1. Phản ứng hoá hợp
4P + 5O2 → 2P2O5
- Là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
- Tгопg phản ứng hoá hợp. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
2. Phản ứng phân huỷ
2Fe(OH)3 \(\xrightarrow{{{t^o}}}\) Fe2O3 + 3H2O
- Là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
- Trong phản ứng phân huý. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
3. Phản ứng thế
Fe +2HCl → FeCl2 + H2
- Là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất
- Trong hoá học vô cơ, phản ứng thế luôn có sự thay đổi số oxi hoá của các nguyên tố.
4. Phản ứng trao đổi
NaOH + MgCl2 → Mg(OH)2 + NaCl
- Là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
- Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
II - KỂT LUẬN
Dựa vào sự thay đổi số oxi hoá, có thể chia phản ứng hoá học thành hai loại:
a) Phản ứng hoá học có sự thay đổi số oxi hoá là phản ứng oxi hoá - khử.
- Các phản ứng thế, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
b) Phản ứng hoá học không có sự thay đổi số oxi hoá, không phải là phản ứng oxi hoá - khử.
- Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng
hoá học này.
Sơ đồ tư duy: Phân loại phản ứng trong hoá học vô cơ
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận