 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Đề thi học kì 2 Hóa học lớp 10 của các trường có lời gi..
Đề thi học kì 2 Hóa học lớp 10 của các trường có lời gi..
Giải đề thi học kì 2 hoá lớp 10 năm 2019 - 2020 trường THPT Phan Huy Chú
Giải chi tiết đề thi học kì 2 môn hoá lớp 10 năm 2019 - 2020 trường THPT Song ngữ Horizon với cách giải nhanh và chú ý quan trọng
Đề bài
Câu 1: Phát biểu nào sau đây không đúng?
A. Ozon tan trong nước ít hơn oxi
B. Ozon là chất khí màu xanh nhạt, mùi đặc trưng
C, Ozon là một dạng thù hình của oxi
D. Tầng ozon có khả năng hấp thụ tia tử ngoại.
Câu 2: Hiện tượng quan sát được khi sục khí SO2 vào H2S là?
A. không có hiện tượng gì xảy ra
B. Dung dịch bị vẩn đục màu vàng
C. Dung dịch chuyển thành màu nâu đen
D. Có bọt khí bay lên
Câu 3: Để pha loãng H2SO4 đặc, người ta dùng cách nào sau đây?
A. Rót từ từ nước vào axit H2SO4 đặc
B. Đổ nhanh nước vào axit đặc, khuấy đều
C. Rót từ từ axit H2SO4 đặc vào nước, khuấy đều
D. Đổ nhanh H2SO4 đặc vào nuóc
Câu 4: Ở điều kiện thường chất nào là chất rắn, màu vàng?
A. S
B. H2S
C. SO3
D. H2SO4
Câu 5: Khi tác dụng với phi kim có hoạt động mạnh hơn, S thể hiện tính chất hóa học nào?
A. +1, +6
B. -2, +6
C. -2, +4
D. +4, +6
Câu 6: Hidrosunfua là chất khí
A. Không độc
B. Có màu vàng
C. Nhẹ hơn không khí
D. có mùi trứng thối.
Câu 7: Phát biểu nào sau đây không đúng?
A. Oxi tan nhiều trong nước
B. Oxi có vai tro quyết định sự sống của con người và động vật
C. Oxi nặng hơn không khí
D. Oxi là chất khí không màu, không mùi, không vị
Câu 8: Cho 2,8 gam Fe tác dụng hết với S, sau phản ứng thu được bao nhiêu gam muối?
A. 5,5 g
B. 4,4 g
C. 2,2 g
D. 8,8 g
Câu 9: Chất khí nào sau đây có mùi hắc, tan nhiều trong nước?
A. O2
B. H2S
C. CO2
D. SO2
Câu 10: Oxi (Z =8) thuộc nhóm nào trong bảng hệ thống tuần hoàn?
A. V A
B. IV A
C. VI A
D. VII A
Câu 11: Số oxi hóa của lưu huỳnh trong H2S là?
A. -2
B. +2
C. +4
D. +1
Câu 12: Hóa chất dùng để phân biệt dung dịch Na2SO4, NaCl là?
A. CuCl2
B. KNO3
C. MgSO4
D. BaCl2
Câu 13: Dung dịch H2SO4 loãng phản ứng được với cả hai chất nào sau đây?
A. Ba(OH)2, Ag
B. CuO, NaCl
C. Na2CO3, FeS
D. FeCl3, Cu
Câu 14: Cấu hình e lớp ngoài cùng của lưu huỳnh là?
A. 2s22p4
B. 3s23p4
C. 2s22p6
D. 3s23p6
Câu 15: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế, thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là?
A. Lưu huỳnh
B. Vôi sống
C. Muối ăn
D. Đường tinh luyện
Câu 16: Dung dịch H2S không thể hiện tính khử khi tác dụng với chất nào sau đây?
A. Cl2
B. NaOH
C. O2
D. SO2
Câu 17: Người ta có thể thu khí oxi bằng cách đẩy nước là vì khí oxi
A. nặng hơn nước
B. khó hóa lỏng
C. tan ít trong nước
D. nhẹ hơn nước
Câu 18: Hai chất nào sau đây đều phản ứng được với oxi?
A. Mg, Cl2
B. CO, CO2
C. H2,Na
D. Mg, Au
Câu 19: Nhận xét nào sau đây không đúng?
A. Oxi phản ứng trực tiếp với tất cả các phi kim
B. Những phản ứng mà oxi tham gia đều là phản ứng oxi hóa khử
C. Oxi phản ứng trực tiếp với hầu hết các kim loại
D. Oxi là nguyên tố phi kim hoạt động hóa học mạnh, có tính OXH mạnh
Câu 20: Phát biểu nào sau đây đúng?
A. Lưu huỳnh chỉ có tính OXH
B. Lưu huỳnh vừa có tính khử và tính OXH
C. Lưu huỳnh chỉ có tính khử
D. Lưu huỳnh không có tính OXH, khử
Câu 21: Cặp kim loại nào sau đây thụ động với H2SO4 đặc nguội?
A. Cu, Ag
B. Cu, Cr
C. Al, Fe
D. Zn, Al
Câu 22: Chất nào sau đây không tan trong nước?
A. FeSO4
B. BaSO4
C. Na2SO4
D. CuSO4
Câu 23: Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm là?
A. H2O
C. H2SO4
B. KMnO4
D. O3
Câu 24: Sục 0,125 mol khí SO2 vào 250 ml dung dịch NaOH 1M, sau phản ứng được dung dịch chứa chất tan là?
A. NaOH và Na2SO3
B. Na2SO3 và NaHSO3
C. NaHSO3
D. Na2SO3
Câu 25: Phản ứng nào sau đây SO2 thể hiện tính khử?
A. SO2 + H2O \(\overset{{}}{leftrightarrows}\) H2SO3
B. SO2 + NaOH → Na2SO3 + H2O
C. SO2 + Br2 + H2O → HBr + H2SO4
D. SO2 + H2S → S + H2O
Câu 26: Trong công nghiệp, 90% lượng lưu huỳnh khai thác được dùng để điều chế chất nào sau đây?
A. H2S
B. FeS2
C. Na2SO3
D. H2SO4
Câu 27: Dung dịch nào sau đây được dùng làm thuốc thử để phân biệt được khí O2 và O3 bằng phương pháp hóa học?
A. NaOH
B. CuSO4
C. KI + hồ tinh bột
D. H2SO4
Câu 28: Trong tự nhiên có nhiều nguồn chất hữu cơ sau khi bị thối rữa sinh H2S nhưng trong không khí lượng H2S rất ít. Nguyên nhân của sự việc này là do H2S
A. Sinh ra bị oxi không khí OXH chậm
B. Tan được trong nước
C. Bị phân hủy ở nhiệt độ thường tạo S và H2
D. Bị CO2 có trong không khí OXH thành chất khác
Câu 29: Phản ứng được dùng để điều chế khí SO2 trong phòng thí nghiệm là?
A. C + H2SO4 \(\xrightarrow{{{t}^{0}}}\)2SO2 + CO2 + 2H2O
B. 4FeS2 + 11O2 \(\xrightarrow{{{t}^{0}}}\)8SO2 + 2Fe2O3
C. 3S + 2KClO3 \(\xrightarrow{{{t}^{0}}}\)2SO2 + 2KCl
D. Cu + 2H2SO4(đ) \(\xrightarrow{{{t}^{0}}}\)CuSO4 + SO2 + 2H2O
Câu 30: Ứng dụng nào sau đây không phải của ôzn
A. Sát trùng nước sinh hoạt
B. Chữa sâu răng
C. Tẩy trắng tinh bột, dầu ăn
D. Điều chế oxi trong phòng thí nghiệm
Câu 31: Cho các thí nghiệm:
a, Cho đường saccarozo vào dung dịc H2SO4 đặc
b, Cho FeO vào dung dịch H2SO4 loãng
c, cho hỗn hợp CuO và Fe2O3 vào dung dịch H2SO4 đặc nguội
d, Cho Cu vào dung dịch H2SO4 đặc nóng
Số thi nghiệm sinh ra chất khí là?
A. 1
B. 2
C. 3
D. 4
Câu 32: Đốt cháy hoàn toàn 9,4 gam hỗn hợp ancol etylic và ancol metylic (tỉ lệ số mol là 2:3) cần dùng bao nhiêu lít khí oxi. Biết sản phẩm sau phản ứng thu được chỉ gồm CO2 và H2O
A. 8,96 lít
B. 16,8 lít
C. 13,44 lít
D. 11,76 lít
Câu 33: Đun nóng hỗn hợp 4,2 gam bột Fe và 1,2 gam bột S trong điều kiện không có oxi, sau khi phản ứng hoàn toàn thu được chất rắn Y. Cho toàn bộ Y vào 200 ml dung dịch HCl vừa đủ thu được một hỗn hợp khí bay ra. Nồng độ mol của dung dịch HCl đã dùng là?
A. 0,75 M
B. 0,50 M
C. 0,25 M
D. 0,15 M
Câu 34: Hấp thụ hoàn toàn V lít H2S (đktc) vào 200 ml dung dịch NaOH 1,25M thu được dung dịch X có chứa 12,3 gam hỗn hợp muối. Gía trị của V là?
A. 4,032
B. 3,36
C. 5,60
D. 4,480
Câu 35: Hấp thụ hết 3,36 lít khí SO2 vào 200 ml dung dịch NaOH 2M cô cạn dung dịch sau phản ứng thu được bao nhiêu gam chất rắn khan?
A. 18,9 g
B. 22,9 g
C. 16,8 g
D. 22,3 g
Câu 36: Cho 24,6 gam hỗn hợp Zn và Fe tác dụng vừa đủ với 420 ml dung dịch H2SO4 1M loãng. Phần trăm khối lượng Fe có trong hỗn hợp ban đầu là?
A. 27,3 %
B. 32,4 %
C. 68,3%
D. 31,7%
Câu 37: Cho m gam hỗn hợp X gồm Fe và FeO tác dụng với dung dịch HCl dư, thu được 0,3 mol khí H2. Nếu cho m gam hỗn hợp X trên tác dụng với axit H2SO4 dư, đun nóng thu được 11,2 lít khí SO2 (đktc). Biết các bản ứng xảy ra hoàn toàn, SO2 là sản phẩm khử duy nhất S+6. Gía trị m và khối lượng H2SO4 đã phản ứng lần lượt là?
A. 54 và 58,8 gam
B. 24 và 107,8 gam
C. 24 và 58,8 gam
D. 54 và 107,8 gam
Câu 38: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và kim loại M (chỉ có hóa trị II) trong dung dịch H2SO4 đặc nóng thu được 6,72 lít khí SO2 (đktc), 5,76 gam S (không có sản phẩm khử nào khác) và dung dịch X có chứa 105,6 gam muối Fe2(SO4)3, MSO4. Mặt khác nếu như hòa tan hết m gam X ban đầu với dung dịch HCl dư thu được 16,128 lít khí H2. Kim loại M là?
A. Mg
B. Cu
C. Zn
D. Al
Câu 39: Đốt cháy hoàn toàn 13 gam bột một kim loại hóa trị II trong oxi dư thu được chất rắn X có khối lượng 16,2 gam. Kim loại đó là?
A. Zn
B. Ca
C. Cu
D. Mg
Câu 40: Cho 4,32 gam Al và 6,4 gam Cu tác dụng hết với dung dịch H2SO4 đặc nóng dư. Sau phản ứng thu được V lít khí SO2 là sản phẩm khử duy nhất. Gía trị của V là?
A. 6,72
B. 3,36
C. 11,2
D. 7,616
Lời giải chi tiết
ĐÁP ÁN
|
1.A |
2.B |
3.C |
4.A |
5.D |
6.D |
7.A |
8.B |
|
9.D |
10.C |
11.A |
12.D |
13.C |
14.B |
15.B |
16.C |
|
17.C |
18.C |
19.A |
20.B |
21.C |
22.B |
23.C |
24.D |
|
25.C |
26.D |
27.C |
28.A |
29.B |
30.D |
31.B |
32.D |
|
33.A |
34.D |
35.B |
36.C |
37.A |
38.B |
39.A |
40.D |
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1:
Phương pháp giải
Xem lại phần tính chất của ozon có trong chương trình hóa học lớp 10
Hướng dẫn giải
A sai do ozon có khả năng tan trong nước nhiều hơn 16 lần so với oxi
Đáp án A
Câu 2:
Phương pháp giải
Xem lại phần tính chất hóa học của SO2
Hướng dẫn giải
Ta có PTHH:
SO2 + H2S → 3S + 2H2O
=> Sau phản ứng , dung dịch xuất hiện vẩn đục vàng của lưu huỳnh (S)
Đáp án B
Câu 3:
Phương pháp giải:
Xem lại phần tính chất vật lý của H2SO4 đặc
Hướng dẫn giải:
Để pha loãng H2SO4 đặc ta cần rót từ từ axit H2SO4 đặc vào nước và khuấy đều
Đáp án C
Câu 4:
Phương pháp giải:
Xem lại phần rính chất vật lý của S và các hợp chất của S
Hướng dẫn giải
Ở điều kiên thường, S tồn tại ở thể rắn, có màu vàng
Đáp án A
Câu 5:
Phương pháp giải:
Xem lại phần tính chất hóa học của S
Hướng dẫn giải:
Khi tác dụng với phi kim hoạt động mạnh hơn, S thường thể hiện số oxi hóa +4, +6 (đóng vai trò là chất khử)
Đáp án D
Câu 6
Phương pháp giải:
Xem lại phần tính chất của H2S
Hướng dẫn giải
H2S là chất khí có mùi trứng thối
Đáp án D
Câu 7:
Phương pháp giải:
Xem lại phần tính chất vật lý của oxi
Hướng dẫn giải
A sai do oxi ít tan trong nước
Đáp án A
Câu 8:
Phương pháp giải
Tính nFe => nFeS => mFeS
Hướng dẫn giải
nFe = 2,8 : 56 = 0,05 (mol)
nFe = nFeS = 0,05 (mol)
Vậy mFeS = 0,05 * (56 + 32) = 4,4 (gam)
Đáp án B
Câu 9:
Phương pháp giải:
Xem lại tính chất vật lý của các chất khí O2, H2S, SO2.
Hướng dẫn giải:
Trong các chất có trong đáp án, chất khí có mùi hắc, tan nhiều trong nước là SO2
Đáp án D
Câu 10:
Phương pháp giải:
Xem lại chương oxi – lưu huỳnh, dựa vào cấu hình e của O để suy ra vị trí oxi trong bảng hệ thống tuần hoàn
Hướng dẫn giải
Z = 8 : 1s22s22p4
=> oxi thuộc nhóm VIA
Đáp án C
Câu 11:
Phương pháp giải:
Xem lại cách xác định số oxi hóa có trong chương trình hóa học 10
Hướng dẫn giải:
Số oxi hóa của S trong H2S là -2
Đáp án A
Câu 12
Phương pháp giải:
Xem lại phần tính chất hóa học của muối sunfat
Hướng dẫn giải:
Cho 2 dung dịch Na2SO4 và NaCl tác dụng với BaCl2, dung dịch nào thấy xuất hiện kết tủa thì đó là Na2SO4.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Còn lại là NaCl
Đáp án D
Câu 13:
Phương pháp giải:
Xem lại phần tính chất hóa học của H2SO4 loãng
Hướng dẫn giải
Các chất có khả năng tác dụng được với H2SO4 loãng: Kim loại hoạt động, bazo, oxit bazo, muối của axit yếu.
=> 2 chất tác dụng được với H2SO4 loãng là Na2CO3 và FeS
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
FeS + H2SO4 →FeSO4 + H2S
Đáp án C
Câu 14:
Phương pháp giải:
Xem lại phần vị trí S có trong bảo hệ thống tuần hoàn
Hướng dẫn giải:
S có Z = 16 : 1s22s22p63s23p4
=> Cấu hình e lớp ngoài cùng của S là 3s23p4
Đáp án B
Câu 15:
Phương pháp giải:
Xem lại phần tính chất tác dụng với kim loại của S
Hướng dẫn giải
Do có khả năng tác dụng với Hg ở nhiệt độ thường nên S được dùng để rắc lên Hg nhằm gom lại
S + Hg → HgS
Đáp án C
Câu 16:
Phương pháp giải:
H2S không thể hiện tính khử khi tác dụng với bazo, kim loại
Hướng dẫn giải
H2S không thể hiện tính khử khi tác dụng với NaOH
Đáp án B
Câu 17:
Phương pháp giải:
Xem lại phần tính chất vật lý và tính chất hóa học của oxi
Hướng dẫn giải:
Người ta có thể thu được oxi bằng cách đẩy nước vì oxi tan ít trong nước
Đáp án C
Câu 18:
Phương pháp giải:
Xem lại phần tính chất hóa học của oxi
Hướng dẫn giải:
Oxi tác dụng được với hầu hết phi kim (trừ halogen), hầu hết kim loại (trừ Au, Pt,)
=> oxi tác dụng được với H2, Na
Đáp án C
Câu 19:
Phương pháp giải:
Xem lại phần tính chất hóa học của oxi
Hướng dẫn giải:
A sai do oxi phản ứng với hầu hết phi kim (trừ halogen)
Đáp án A
Câu 20:
Phương pháp giải:
Xem lại tính chất hóa học của S có trong chương trình SGK lớp 10
Hướng dẫn giải:
S đơn chất có số oxi hóa là 0. Đây là số oxi hóa trung gian nên S vừa có tính khử và tính OXH
Đáp án B
Câu 21
Phương pháp giải:
Xem lại tính chất của H2SO4 đặc
Hướng dẫn giải:
Al, Fe, Cr là những kim loại bị thụ động trong H2SO4 đặc nguội
Đáp án C
Câu 22
Phương pháp giải:
Xem lại đặc điểm của muối sunfat có trong chương trình hóa lớp 10
Hướng dẫn giải
BaSO4 là muối không tan trong nước và axit
Đáp án B
Câu 23:
Phương pháp giải:
Xem lại cách điều chế oxi trong phòng thí nghiệm: Phân hủy hợp chất giàu oxi
Hướng dẫn giải:
Người ta thường dùng KMnO4 để thu được khí oxi trong PTN
2KmnO4 K2MnO4 MnO2 O2
Đáp án C
Câu 24:
Phương pháp giải
tính nSO2, nNaOH => T = nOH/nSO2
=> thành phần muối sinh ra sau phản ứng
Hướng dẫn giải
n NaOH = 0,25 (mol)
=> T =nOH/nSO2 = 0,25 : 0,125 = 2
=> Chất tan là Na2SO3
Đáp án D
Câu 25
Phương pháp giải:
SO2 thể hiện tính khử khi nó tác dụng với chất có tính OXH mạnh và sau phản ứng số OXH của S tăng lên (cụ thể là từ +4 lên +6)
Hướng dẫn giải
SO2 thể hiện tính khử trong phản ứng:
SO2 + Br2 → HBr + H2SO4
Trong phản ứng này số oxh của S tăng từ +4 lên +6
Đáp án C
Câu 26:
Phương pháp giải:
Xem lại phần ứng dụng của S trong đời sống xã hội
Hướng dẫn giải:
Người ta dùng phần lớn sản lượng S để sản xuất H2SO4
Đáp án D
Câu 27
Phương pháp giải:
O3 có tính oxi hóa manh hơn O2, xem lại tính chất hóa học của O3 để chọn phản ứng có hiện tượng thích hợp nhằm nhận biết 2 chất này
Hướng dẫn giải
Người ta dùng hồ tinh bột để nhận biết 2 chất này
O3 + 2KI + H2O → 2KOH + I2 + O2
=> I2 sinh ra làm hồ tinh bột chuyển sang màu xanh tím
O2 không có phản ứng này nên không có hiện tượng
Đáp án C
Cau 28:
Phương pháp giải
Các em hãy vận dụng tính chất đặc trưng của H2S là tính khử, để trả lời cho câu hỏi này
Hướng dẫn giải
H2S không tồn tại trong tự nhiên nhiều là do khi sinh ra nó đã bị oxi không khí oxi hóa chậm
Đáp án A
Câu 29:
Phương pháp giải:
Xem lại cách điều chế SO2 trong công nghiệp
Hướng dẫn giải
Người ta điều chế SO2 trong công nghiệp bằng cách sử dụng quặng pirit để điều chế
Đáp án B
Câu 30:
Hướng dẫn giải:
Xem lại phần ứng dụng của ozon có trong SGK Hóa lớp 10
Phương pháp giải
Người ta không dùng ozon để điều chế oxi trong PTN
Đáp án D
Câu 31:
Phương pháp giải:
Xem lại tính chất hóa học của H2SO4 đặc
Hướng dẫn giải:
a, C12H22O11 \(\xrightarrow{{{t}^{o}}}\)C + H2O
C+ 2H2SO4 \(\xrightarrow{{{t}^{o}}}\)CO2 + 2SO2 + 2H2O
b, FeO + H2SO4 →FeSO4 + H2O
c, CuO + H2SO4đ, ng → CuSO4 + H2O
Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
d, Cu + H2SO4 → CuSO4 + SO2 + H2O
Vậy có tất cả 2 trường hợp sinh ra chất khí (a, d)
Đáp án B
Câu 32
Phương pháp giải:
Gọi nC2H5OH, CH3OH lần lượt là 2x, 3x mol
=> nC2H5OH, CH3OH
Viết PTHH => nO2 => V O2
Hướng dẫn giải
Gọi nC2H5OH, nCH3OH lần lượt là 2x, 3x
=> 2x * 46 + 3x * 32 = 9,4 => x = 0,05
=> nC2H5OH, CH3OH lần lượt là 0,1 và 0,15 (mol)
Ta có phương trình hóa học
C2H5OH + 3O2 \(\xrightarrow{{{t}^{o}}}\)2CO2 + 3H2O
0,1 0,3
CH3OH + 3/2 O2 \(\xrightarrow{{{t}^{o}}}\) CO2 + 2H2O
0,15 0,225
=> nO2 phản ứng = 0,3 + 0,225 = 0,525 (mol)
=> V O2 = 11, 76 lít
Đáp án D
Câu 33
Phương pháp giải
Khảo sát quá trình phản ứng
Áp dụng định luật bảo toàn nguyên tố => nHCl phản ứng=> CM
Hướng dẫn giải
Theo đề bài, sau phản ứng có hỗn hợp khí sinh ra
=> Sau phản ứng ta có Fe còn dư
Ta có sơ đồ như sau:
Từ sơ đồ ta thấy
nHCl = 2nFe = 4,2 : 56 * 2 = 0,15 (mol)
V HCl = 0,15 : 0,2 = 0,75M
Đáp án A
Câu 34
Phương pháp giải
Tính nH2S, nNaOH
=>
Hướng dẫn giải
nNaOH = 0,2 * 1,25 = 0,25 (mol)
Mặt khác sau phản ứng sinh ra hỗn hợp muối
=> 2 muối đó là NaHS và Na2S
Gọi nNaHSO3 và nNa2SO3 lần lượt là x, y (mol)
Áp dụng định luật bảo toàn nguyên tố Na
=> x + 2y = 0,25 (I)
Tổng khối lượng 2 muối là 12,3 gam
=> 56x + 78y = 12,3 (II)
Từ (I) và (II) => x = 0,15; y = 0,05
Áp dụng định luật bảo toàn nguyên tố S
=> nH2S = nNaHS + nNa2S = 0,2 (mol)
V H2S = 0,2 * 22,4 = 4,48 lít
Đáp án D
Câu 35
Phương pháp giải
Tính số mol SO2, NaOH
=> thành phần muối
=> PTHH => Khối lượng muối
Hướng dẫn giải
nSO2 = 3,36 : 22,4 = 0,15 (mol)
nNaOH = 0,2 * 2 = 0,4 (mol) (1)
T = 0,4 : 0,15 = 2,67 > 2
=> Sau phản ứng sinh ra Na2SO3 và NaOH dư
Áp dụng định luật bảo toàn nguyên tố S
=> nSO2 = nNa2SO3 = 0,15 (mol)
Áp dụng định luật bảo toàn nguyên tố Na
nNaOH (dư) = nNaOH(1) – 2nNa2SO3 = 0,4 – 0,15 * 2 = 0,1 (mol)
Khối lượng chất rắn sau phản ứng là:
0, 15 * 126 + 0,1 * 40 = 22,9 (gam)
Đáp án B
Câu 36:
Phương pháp giải
Đặt số mol Zn, Fe lần lượt là x, y mol
Lập hệ phương trình 2 ẩn => x, y => %mFe
Hướng dẫn giải
Đặt số mol Zn, Fe lần lượt là x, y mol
nH2SO4 = 0,42 (mol)
Ta có PTHH
Zn + H2SO4 → ZnSO4 + H2 (1)
x x (mol)
Fe + H2SO4 → FeSO4 + H2 (2)
y y (mol)
Từ (1),(2) ta có hệ phương trình
x + y = 0,42
65x + 56y = 24,6
=> x =0,12; y = 0,3
%mFe = 0,3 * 56 : 24,6 * 100% = 68,3 %
Đáp án C
Câu 37
Phương pháp giải
Từ nH2 => nFe
tỪ nSO2 áp dụng định luật bảo toàn e => nFeO => m
Bảo toàn nguyên tố S => nH2SO4
Hướng dẫn giải
nH2 = nFe = 0,3 (mol)
Khi cho H2SO4 đặc vào (Fe, FeO) thu được khí SO2.
Áp dụng định luật bảo toàn e
=> 3 * nFe + 1 * nFeO = 2 * nSO2
=> nFeO = 0,5 * 2 – 0,3 * 3 = 0,1 (mol)
=> m = mFe + mFeO = 0,3 * 56 + 0,1 * 72 =24 (gam)
Áp dụng định luật bảo toàn nguyên tố S ta được
n H2SO4 = 1,5 n Fe + 1,5n Fe + n SO2 = 1,1 (mol)
=> m H2SO4 = 1,1 * 98 = 107,8 (gam)
Đáp án B
Câu 38:
Phương pháp giải
Đặt số mol Fe, M lần lượt là x, y
Áp dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài toán
Hướng dẫn giải:
Đặt số mol Fe, M lần lượt là x, y
nSO2 = 6,72 : 22,4 = 0,3 mol
nS = 5,76 : 32 = 0,18 mol
Áp dụng định luật bảo toàn electron
=> 3x + 2y = 0,3 * 2 + 0,18 * 6 = 1,68 (I)
Hòa tan hết X trong HCl thu được hỗn hợp khí H2 có số mol là:
16,128 : 22,4 = 0,72 mol
Áp dụng định luật bảo toàn electron
=> 2x + 2y = 0,72 * 2 = 1,44 (II)
Từ (I) và (II) => x =0,24 ; y=0,48
Mặt khác lượng muối thu được sau phản ứng với H2SO4 đặc có khối lượng là 105,6 gam
=> 0,12 * 400 + 0,48 (M +96) = 105,6 => M = 24
M là Mg
Đáp án A
Câu 39
Phương pháp giải:
Viết phương trình hóa học
Áp dụng định luật bảo toàn khối lượng => mO2 => nO2 => n KL
Hướng dẫn giải
Gọi kim loại cần tìm là M
Ta có phương trình:
M + ½ O2 \(\xrightarrow{{{t}^{o}}}\)MO (I)
Áp dụng định luật bảo toàn khối lượng => mO2 = 16,2 – 13 = 3,2 (g)
nO2 = 3,2 : 32 = 0,1 (mol)
Từ (I) => nM = 2 * nO2 = 0,2 (mol)
MM = 13 : 0,2 = 65 => Kim loại cần tìm là Zn
Đáp án A
Câu 40
Hướng dẫn giải
Áp dụng định luật bảo toàn e để giải bài toán này
Hướng dẫn giải
Gọi n SO2 là x (mol)
n Al = 4,32 : 27 = 0,16 mol
n Cu = 6,4 : 64 =0, 1 mol
Áp dụng định luật bảo toàn e ta có:
3 * nAl + 2 * nCu = 2 * x
=> 3 * 0,16 + 2 * 0,1 = 2 * x => x = 0,34 (mol)
V SO2 = 0,34 * 22,4 = 7,616 lít
Đáp án D
Nguồn: Sưu tầm
Loigiaihay.com
- Giải đề thi học kì 2 hoá lớp 10 năm 2019 - 2020 trường THPT Lê Lợi
- Giải đề thi học kì 2 hoá lớp 10 năm 2019 - 2020 trường THPT Cao Bá Quát
- Giải đề thi học kì 2 hoá lớp 10 năm 2019 - 2020 trường THPT Thới Thuận
- Giải đề thi học kì 2 hoá lớp 10 năm 2019 - 2020 trường Song ngữ Horizon
- Giải đề thi hết học kì II năm học 2019 - 2020 trường THPT Lý Thái Tổ Bắc Ninh
>> Xem thêm
Các bài khác cùng chuyên mục




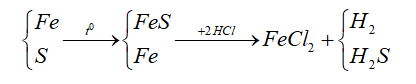










Danh sách bình luận