50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
Làm đề thiCâu hỏi 1 :
Số thứ tự của nguyên tố clo là 17, clo thuộc
- A chu kì 3, nhóm VIIB.
- B chu kì 4, nhóm VIIA
- C chu kì 3, nhóm VIIA
- D chu kì 4, nhóm VIA
Đáp án: C
Lời giải chi tiết:
Cấu hình e của nguyên tố Clo là [Ne]3s23p5
Vậy A thuộc ck 3 nhóm VIIA
Đáp án C
Câu hỏi 2 :
Nguyên tố R có công thức oxit cao nhất là RO3,Công thức hợp chất khí với hidro là:
- A RH4
- B RH3
- C RH2
- D RH
Đáp án: C
Phương pháp giải:
Tổng hóa trị của một nguyên tố trong hợp chất với H và trong oxi cao nhất có giá trị bằng 8.
Lời giải chi tiết:
Trong oxit cao nhất RO3 thì R có hóa trị VI nên trong hợp chất khí với H, R có hóa trị II.
=> RH2
Đáp án C
Câu hỏi 3 :
Phát biểu nào sau đây sai?
- A
Nguyên tử kim loại thường có 1,2 hoặc 3 electron ở lớp ngoài cùng.
- B Các nhóm A bao gồm các nguyên tố s và nguyên tố p
- C
Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim
- D
Trong bảng tuần hoàn, hầu hết các nguyên tố hóa học là kim loại.
Đáp án: C
Lời giải chi tiết:
A,B, D đúng
C. Sai vì trong một chu kì, bán kính nguyên tử kim loại lớn hơn bán kính nguyên tử phi kim
Đáp án C
Câu hỏi 4 :
Oxit cao nhất của một nguyên tố R ứng với công thức R2O7. R là nguyên tố nào?
- A Nitơ (Z=7)
- B Cacbon (Z=6)
- C Clo (Z=17)
- D Lưu huỳnh (Z=16)
Đáp án: C
Lời giải chi tiết:
Do Clo thuộc nhóm VIIA nên có công thức oxit cao nhất là Cl2O7.
Đáp án C
Câu hỏi 5 :
Nguyên tố X thuộc nhóm VA. Công thức oxit cao nhất của X là:
- A X2O5
- B XO2
- C X5O2
- D X2O3
Đáp án: A
Phương pháp giải:
Nguyên tố X thuộc nhóm nA thì công thức oxit cao nhất của X là X2On
Lời giải chi tiết:
Vì nguyên tố X thuộc nhóm VA nên công thức oxit cao nhất của X là X2O5
Đáp án A
Câu hỏi 6 :
Một kim loại X tạo hợp chất với oxi cho oxit có công thức : X2O. Kết luận đúng là:
- A X thuộc nhóm IB
- B X thuộc nhóm I
- C X thuộc chu kì 2
- D X có số oxi hóa là -1
Đáp án: B
Lời giải chi tiết:
A không chắc chắn vì X có thể thuộc nhóm IA
B đúng
C không chắc chắn vì không thể biết được chu kì
D sai vì X có số oxh là +1
Đáp án B
Câu hỏi 7 :
Nguyên tố X có cấu hình e là : 1s22s22p63s23p4. Kết luận không đúng là :
- A X có 16 proton nên X có số thứ tự là 16 trong bảng hệ thống tuần hoàn
- B X có 3 lớp electron nên X thuộc chu 3 trong bảng hệ thống tuần hoàn
- C Số electron lớp ngoài cùng của X bằng 4 nên X thuộc nhóm IVA trong bảng hệ thống tuần hoàn
- D X có xu hướng nhận thêm 2 electron trong các phản ứng hóa học để đạt được cấu hình electron bền vững của khí hiếm.
Đáp án: C
Lời giải chi tiết:
A đúng
B đúng
C sai X thuộc nhóm VIA
D đúng
Đáp án C
Câu hỏi 8 :
Số hiệu nguyên tử trong bảng tuần hoàn cho biết:
1. Số điện tích hạt nhân
2. Số nơtron trong nguyên tử
3. Số electron trên lớp ngoài cùng
4. Số thứ tự nguyên tố trong bảng hệ thống tuần hoàn
5. Số proton trong nhân hoặc electron trên vỏ
6. Số đơn vị điện tích hạt nhân
Hãy cho biết các thông tin đúng:
- A 1,4,5,6
- B 1,2,3,4
- C 1,3,5,6
- D 2,3,5,6
Đáp án: A
Lời giải chi tiết:
Đáp án A
Câu hỏi 9 :
Phát biểu nào sau đây là không đúng?
- A Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
- B Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ He).
- C Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức R2O7.
- D Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A và 8 nhóm B.
Đáp án: C
Lời giải chi tiết:
C sai vì oxit của F với oxi là OF2
Đáp án C
Câu hỏi 10 :
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
- A RH2, RO
- B RH3, R2O5
- C RH5, R2O3
- D RH4, RO2
Đáp án: B
Phương pháp giải:
Tổng hóa trị của một nguyên tố trong oxit cao nhất và trong hợp chất khí với H bằng 8
Lời giải chi tiết:
R có cấu hình electron 1s22s22p3 => R có 5e ở lớp ngoài cùng => R ở nhóm VA
=> Oxit cao nhất: R2O5
=> Hợp chất khí với H: RH3
Đáp án B
Câu hỏi 11 :
Đồng có Z=29. Nhận định đúng là:
- A Đồng có 2 electron ở mức năng lượng cao nhất
- B Đồng thuộc ô 29, chu kì 4, nhóm IIA
- C Đồng có 1 electron ở lớp ngoài cùng.
- D Đồng thuộc nguyên tố s
Đáp án: C
Lời giải chi tiết:
Đáp án C
Cấu hình e : 1s22s22p63s23p63d104s1
Câu hỏi 12 :
Nguyên tử của nguyên tố R có hai lớp electron và nó tạo hợp chất khí với hidro có dạng RH. Công thức hợp chất oxit cao nhất của nguyên tố R là:
- A R2O7
- B R2O5
- C RO3
- D R2O
Đáp án: D
Lời giải chi tiết:
R có 2 lớp electron => R thuộc chu kì 2 trong bảng HTTH
R tạo hợp chất khí vơí H có dạng RH
=> R là nguyên tố F (1s22s22p5)
=> Oxit cao nhất của F với O là F2O
Đáp án D
Câu hỏi 13 :
Anion đơn nguyên tử Xn- có tổng số hạt mang điện là 18. Vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hóa học là:
- A ô thứ 16, chu kì 3, nhóm VIA
- B ô thứ 9, chu kì 2, nhóm VIIA
- C ô thứ 17, chu kì 3, nhóm VIIA
- D ô thứ 8, chu kì 2, nhóm VIA
Đáp án: D
Phương pháp giải:
Vì anion đơn nguyên tử Xn- có tổng số hạt mang điện là 18 nên nguyên tố X có Z < 18:2 = 9
→ Nguyên tố X thuộc chu kì 2.
Ta xét các trường hợp: n= 1, n=2 , n= 3 và n = 4.
Viết cấu hình electron để xác định vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải chi tiết:
Vì anion đơn nguyên tử Xn- có tổng số hạt mang điện là 18 nên nguyên tố X có Z < 18:2 = 9
→ Nguyên tố X thuộc chu kì 2.
Ta xét các trường hợp:
- Nếu n = 1 thì số hạt mang điện là Z + Z + 1= 18 → Z= 8,5 (Loại).
- Nếu n = 2 thì số hạt mang điện là Z + Z + 2= 18 → Z= 8 (thỏa mãn)
Cấu hình electron của X là 1s22s22p4.
Vậy X thuộc ô thứ 8, chu kì 2, nhóm VIA.
Đáp án D
Câu hỏi 14 :
Hợp chất khí với hidro của 1 nguyên tố ứng với công thức RH4. Oxit cao nhất của nó chứa 72,73% oxi theo khối lượng. R là nguyên tố:
- A Cacbon.
- B Silic.
- C Lưu huỳnh.
- D
Nitơ
Đáp án: A
Phương pháp giải:
Công thức hợp chất của R với hidro là RH4 → Hóa trị của R với oxi là 8 - 4 = 4
→ Công thức oxit cao nhất của R là: RO2
Dựa vào thành phần phần trăm đề cho lập phương trình sẽ tìm ra R = ?
Lời giải chi tiết:
Công thức hợp chất của R với hidro là RH4 → Hóa trị của R với oxi là 8 - 4 = 4
→ Công thức oxit cao nhất của R là: RO2
Theo bài ta có:
\(\eqalign{
& \% O = {{2.16} \over {R + 2.16}}.100\% = 72,73\% \cr
& \Rightarrow 3200 = 72,73R + 2327,36 \cr
& \Rightarrow 72,73R = 872,64 \cr
& \Rightarrow R = {{872,64} \over {72,73}} = 12 \cr} \)
→ R là nguyên tố cacbon (Kí hiệu: C)
Đáp án A
Câu hỏi 15 :
Cho 2,4g hỗn hợp 2 loại kiềm ở hai chu kỳ liên tiếp vào H2O dư thu được 1,12 lít H2 (đktc) và dung dịch A. Trung hòa hết dung dịch A cần V lít dung dịch H2SO4 1M thu được a gam muối khan. Giá trị của V và a là:
- A V = 500 ml và a = 7,2 (g).
- B
V = 50 ml và a = 7,2 (g).
- C V = 100 ml và a = 12 (g).
- D
V = 10 ml và a = 12 (g).
Đáp án: B
Phương pháp giải:
Đặt công thức chung của hai kim loại kiềm là M. Tính toán theo 2 PTHH sau:
2M + 2H2O → 2MOH + H2↑ (1)
2MOH + H2SO4 → M2SO4 + 2H2O (2)
Lời giải chi tiết:
\({n_{{H_2}(dktc)}} = {{1,12} \over {22,4}} = 0,05\,(mol)\)
Đặt công thức chung của hai kim loại kiềm là M
PTHH: 2M + 2H2O → 2MOH + H2↑ (1)
0,1 ← 0,05 (mol)
2MOH + H2SO4 → M2SO4 + 2H2O (2)
0,1 → 0,05 (mol)
Theo PTHH (1) và (2): nH2SO4 = 0,05 (mol) → nSO42- = nH2SO4 = 0,05 (mol)
VH2SO4 = nH2SO4 : CM H2SO4 = 0,05 : 1 = 0,05 (lít) = 50 (ml)
Muối thu được là M2SO4
BTKL ta có: mM2SO4 = mM + mSO42- = 2,4 + 0,05 × 96 = 7,2 (g)
Đáp án B
Câu hỏi 16 :
Nguyên tố Si ở nhóm IVA trong bảng tuần hoàn. Trong phân tử oxit cao nhất của Si, phần trăm khối lượng của oxi là (Cho: O = 16; Si = 28)
- A 63,64%.
- B 36,36%.
- C 46,67%.
- D 53,33%.
Đáp án: D
Phương pháp giải:
Nguyên tố thuộc nhóm nA → Hóa trị trong oxit cao nhất là n → CT của oxit cao nhất.
Lời giải chi tiết:
Si thuộc nhóm IVA → Hóa trị trong oxit cao nhất là IV → Oxit là SiO2.
→ %mO = \(\frac{{16.2.100\% }}{{28 + 16.2}}\) = 53,33%
Đáp án D
Câu hỏi 17 :
X, Y là 2 nguyên tố thuộc một nhóm A ở hai chu kì liên tiếp. Tổng số hiệu nguyên tử của X, Y là 22. Nhận xét đúng về X, Y là:
- A X, Y đều thuộc nhóm IIIA
- B X thuộc chu kì 3, Y thuộc chu kì 4
- C X, Y đều là kim loại
- D X, Y đều là phi kim
Đáp án: D
Phương pháp giải:
- Xác định số hiệu nguyên tử của X, Y
- Viết cấu hình electron của X, Y
- Kết luận.
Lời giải chi tiết:
X, Y thuộc hai chu kì liên tiếp \( \to {p_X} - {p_Y} = 8\)
Tổng số hiệu nguyên tử của X, Y là 22 \( \to {p_X} + {p_Y} = 22\)
Suy ra pX = 15 và pY = 7
Cấu hình electron của X: 1s22s22p63s23p3
Cấu hình electron của Y: 1s22s22p3
A sai. Do X, Y thuộc nhóm VA
B sai. X thuộc chu kì 3, Y thuộc chu kì 2
C sai, X, Y là phi kim
D đúng
Đáp án D
Câu hỏi 18 :
Phát biểu nào sau đây là sai?
- A Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
- B Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
- C Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
- D Trong bảng tuần hoàn, hầu hết các nguyên tố hoá học là kim loại.
Đáp án: C
Lời giải chi tiết:
C sai vì trong cùng một chu kì, theo chiều tăng dần của đơn vị điện tích hạt nhân thì bán kính nguyên tử của các nguyên tố giảm dần.
Đáp án C
Câu hỏi 19 :
Nguyên tố T có cấu hình electron lớp ngoài cùng là ns2np3. Trong hợp chất khí với hidro, T chiếm 82,35% về khối lượng. Trong oxit cao nhất, T chiếm % về khối lượng là:
- A 17,65%.
- B 25,93%.
- C 74,08%.
- D 43,66%.
Đáp án: B
Phương pháp giải:
Nguyên tố T có cấu hình electron lớp ngoài cùng là ns2np3 => T thuộc nhóm VA
T thuộc nhóm VA, công thức hợp chất khí với hidro là TH3
Lời giải chi tiết:
Nguyên tố T có cấu hình electron lớp ngoài cùng là ns2np3 => T thuộc nhóm VA
T thuộc nhóm VA, công thức hợp chất khí với hidro là TH3
\(\% {m_T} = \frac{T}{{T + 3}}.100\% = 82,35\% \to T = 14(N)\)
=> Công thức oxit cao nhất N2O5
\(\% {m_N} = \frac{{2.14}}{{2.14 + 5.16}}{\rm{.100\% = 25,93\% }}\)
Đáp án B
Câu hỏi 20 :
Cho 8,15 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp nhau và thuộc cùng nhóm IA, tác dụng với H2O dư thì thu được 2,8 lít khí H2 ở đktc. Hai nguyên tố đó là:
- A Li và Na.
- B Na và K.
- C K và Rb.
- D Li và K.
Đáp án: B
Phương pháp giải:
Gọi \(\overline R \) là công thức kim loại trung bình của 2 kim loại
\(\overline R \) + H2O → \(\overline R \)OH + ½ H2
Từ số mol H2 tính được số mol KL => \({M_{\overline R }}\) => 2 kim loại
Lời giải chi tiết:
nH2 = 2,8: 22,4 = 0,125mol
Gọi \(\overline R \) là công thức kim loại trung bình của 2 kim loại
\(\overline R \) + H2O → \(\overline R \)OH + ½ H2
0,25 ← 0,125
\({M_{\overline R }}\) = 8,15: 0,25 = 32,6 g/mol
2 kim loại nằm ở 2 chu kì liên tiếp cùng thuộc nhóm IA
=> 2 kim loại là Na và K
Đáp án B
Câu hỏi 21 :
Cho hỗn hợp X gồm hai nguyên tố thuộc nhóm IIA ở hai chu kỳ liên tiếp trong bảng HTTH. Hoà tan hoàn toàn 7,6 gam hỗn hợp X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít khí H2 (đktc). Phần trăm theo khối lượng của kim loại có nguyên tử khối nhỏ hơn là:
- A 31,58%.
- B 68,42%.
- C 47,37%.
- D 52,63%.
Đáp án: C
Phương pháp giải:
Gọi \(\overline R \) là kim loại trung bình của 2 kim loại
\(\overline R \) + 2HCl → \(\overline R \)Cl2 + H2
Từ số mol H2 tính được số mol KL => \({M_{\overline R }}\) => 2 kim loại
Lời giải chi tiết:
nH2 = 5,6: 22,4 = 0,25mol
Gọi \(\overline R \) là kim loại trung bình của 2 kim loại
\(\overline R \) + 2HCl → \(\overline R \)Cl2 + H2
0,25 ← 0,25
\({M_{\overline R }}\) = 7,6: 0,25 = 30,4 g/mol
2 kim loại nằm ở 2 chu kì liên tiếp cùng thuộc nhóm IIA
=> 2 kim loại là Mg và Ca
Có 24x + 40y = 7,6 và x + y = 0,25
=> x = 0,15 và y = 0,1
=> \(\% {\bf{Mg}}{\rm{ }} = \frac{{0,15.24}}{{7,6}}.100\% = 47,37\% \)
Đáp án C
Câu hỏi 22 :
Một nguyên tố X gồm 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % đồng vị thứ nhất gấp 3 lần % đồng vị thứ hai. Nguyên tử khối trung bình của X là:
- A 13,5
- B 13
- C 12,5
- D 14,5
Đáp án: C
Lời giải chi tiết:
X1 và X2 là đồng vị của nhau => có cùng số proton
Đặt số proton của X1 và X2 là p
Số notron của X1 là n1; số notron của X2 là n2
Xét X1: có tổng số hạt là 18
=> p + n1 + e = 18
Vì p = e => 2p + n1 = 18 (*)
Với các nguyên tố có Z ≤ 82
p ≤ n ≤ 1,5p
Thế (*) vào => p ≤ (18-2p) ≤ 1,5p
=> 3p ≤ 18 ≤ 3,5p
=> 5,1 ≤ p ≤ 6
P nguyên dương => p = 6 thỏa mãn
Thay p = 6 vào (*) => n1 = 18 – 2.6 = 6
=> số khối của X1 là: MX1 = p + n1 = 6 + 6 = 12
Theo bài X2 có tổng số hạt là 20 hạt: => p + n2 + e = 20
=> 2p + n2 = 20 (**)
Thay p = 6 (đã tìm được bên trên) vào (**) => n2 = 8
=> Số khối của X2 là: MX2 = p + n2 = 6 + 8 = 14
%Đồng vị thứ nhất gấp 3 lần % đồng vị thứ hai
Đặt % đồng vị X2 = x
=> % đồng vị X1 = 3x
Ta có: x + 3x = 100%
=> 4x = 100%
=> x = 25%
Nguyên tử khối trung bình của X là:
\({M_X} = {{{A_{{X_1}}}.\% {X_1} + {A_{{X_2}}}.\% {X_2}} \over {100\% }} = {{12 \times 75\% + 14 \times 25\% } \over {100\% }} = 12,5\)
Đáp án C
Câu hỏi 23 :
A, B là 2 nguyên tố thuộc cùng 1 nhóm và thuộc 2 chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hạt nhân 2 nguyên tử là 30. A có hóa trị cao nhất với oxi bằng
- A 1
- B 3
- C 4
- D 2
Đáp án: A
Lời giải chi tiết:
Đáp án A
p1 + p2 = 30
+) Nếu A chu kỳ 1 và B chu kỳ 2 => p2 – p1 = 8
=> p2 = 19 (K) và p1 = 11 (Na)
=> Hóa trị cao nhất của A(Na) với oxi là I
+) Nếu p2 – p1 = 18 => p1 = 6 ; p2 = 24 (Loại)
Câu hỏi 24 :
Oxit cao nhất của một nguyên tố có dạng R2O5. Hợp chất khí với Hiđro của nguyên tố này chứa 8,82% hiđro về khối lượng. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì:
- A 3
- B 2
- C 4
- D 5
Đáp án: A
Lời giải chi tiết:

Câu hỏi 25 :
X, Y, Z là 3 nguyên tố thuộc cùng chu kì của bảng hệ thống tuần hoàn. Biết oxit của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím, Y phản ứng với nước được dung dịch làm xanh giấy quỳ tím, còn Z phản ứng được với cả axit và kiềm. Số thứ tự các nguyên tố trong bảng hệ thống tuần hoàn tăng theo chiều:
- A X< Y< Z
- B X<Z< Y
- C Y<Z<X
- D Z < Y< X
Đáp án: C
Lời giải chi tiết:
Đáp án C
Trong cùng 1 chu kì đứng đầu chu kì là kim loại đứng cuối chu kì là phi kim
Oxit của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím ( axit ) => X là phi kim
Y phản ứng với nước được dung dịch làm xanh giấy quỳ tím ( bazo ) => Y là kim loại
Z phản ứng được với cả axit và kiềm , Z thuộc phần chuyển tiếp nằm ở giữa chu kì
ð Y<Z<X theo chiều của số thứ tự trong bảng tuần hoàn
Câu hỏi 26 :
X là nguyên tố có hóa trị cao nhất đối với oxi bằng hóa trị của X trong hợp chất với hiđro. Trong oxit cao nhất của X có 53,33% O về khối lượng. X là:
- A Al
- B N
- C C
- D Si
Đáp án: D
Phương pháp giải:
Phương pháp: Hóa trị của X trong hợp chất O và hóa trị của X trong hợp chất với H có tổng số oxh là 8
Do đó tìm được công thức của X với O nên tìm ra được X
Lời giải chi tiết:
Vì hóa trị của X trong hợp chất O và hóa trị của X trong hợp chất với H có tổng số oxh là 8 và hóa trị của X trong 2 hợp chất này bằng nhau nên hóa trị của X trong cả 2 hợp chất là 4
Công thức hóa học của X với O là XO2
Thành phần % O trong X là
\[\% O = \frac{{16.2}}{{16.2 + X}}.100\% = 53,33\% \]
Nên X là Si
Đáp án D
Câu hỏi 27 :
Một nguyên tố R có hóa trị cao nhất với oxi bằng 3 lần hóa trị của R trong hợp chất khí với hiđro. Trong oxit cao nhất có chứa 40% nguyên tố R về khối lượng. Định tên R.
Phương pháp giải:
Tổng hóa trị của nguyên tố trong hợp chất với hidro và hóa trị của nguyên tố đó trong oxit cao nhất bằng 8.
Lời giải chi tiết:
Gọi n là hóa trị của R trong hợp chất với hidro, m là hóa trị của R trong oxit cao nhất.
Ta có:
\(\left\{ \begin{array}{l}
n + m = 8\\
n = \frac{m}{3}
\end{array} \right. \to \left\{ \begin{array}{l}
n = 2\\
m = 6
\end{array} \right.\)
Công thức của oxit cao nhất là: RO3
%mR = 40%→ %mO =60%
Ta có: \(\frac{{16.3}}{{{M_R} + 16.3}}.100\% = 60\% \to {M_R} = 32\)
Vậy R là lưu huỳnh, kí hiệu: S
Câu hỏi 28 :
Hòa tan hoàn toàn 4,6 gam một kim loại R thuộc nhóm IA vào 100 gam nước, thu được 2,24 lít khí H2 (đktc)
Câu 2: Tính khối lượng dung dịch thu được sau phản ứng?
Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng
Câu hỏi 29 :
A, B là hai nguyên tố thuộc cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng hệ thống tuần hoàn. Tổng số hạt nhân của A và B là 32. A và B là:
- A Na và K
- B Mg và Ca
- C Mg và Al
- D N và P
Đáp án: B
Lời giải chi tiết:
Vì số hạt nhân của A và B là 32 nên A, B thuộc chu kì nhỏ và chỉ hơn nhau 8 proton
Ta có pA+ pB=32 và pA- pB= 8 nên pA=20 và pB=12
A và B là Mg và Ca
Đáp án B
Câu hỏi 30 :
Hòa tan hoàn toàn 8,4 gam một kim loại M hóa trị II vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí H2 (đkc). Kim loại M là:
- A Zn(65)
- B Mg( 24)
- C Fe(56)
- D Ca( 40)
Đáp án: C
Lời giải chi tiết:
Phương pháp: tính theo pthh tìm số mol của M rồi tìm M
Lời giải
Ta có M + 2HCl → MCl2 + H2
Số mol H2 lag 3,36:22,4=0,15 mol
Theo phương trình hóa học số mol của M là 0,15 mol
ð M = 8,4 :0,15=56
Đáp án C
Câu hỏi 31 :
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 31. Nhận xét nào sau đây về
X, Y là không đúng?
- A X, Y đều là nguyên tố phi kim.
- B Độ âm điện của X nhỏ hơn độ âm điện của Y.
- C Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 6 electron.
- D Oxit cao nhất của X có công thức XO2.
Đáp án: D
Lời giải chi tiết:
- X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X => ZY – ZX = 1
- Tổng số hạt proton trong nguyên tử X và Y là 31 => ZX + ZY = 31
=> ZX = 15 và ZY = 16
Cấu hình e của X: 1s22s22p63s23p3
Cấu hình e của Y: 1s22s22p63s23p4
Xét các phương án:
A đúng vì X có 5e lớp ngoài cùng và Y có 6e lớp ngoài cùng
B đúng vì trong một chu kì theo chiều tăng điện tích hạt nhân độ âm điện tăng dần
C đúng
D sai vì X có 5e lớp ngoài cùng => nhóm VA => oxit cao nhất của X là X2O5
Đáp án D
Câu hỏi 32 :
Nguyên tố R tạo hợp chất khí với hidro có công thức RH4. Trong hợp chất oxit cao nhất R chiếm 46,7% về khối lượng. Xác định R?
Phương pháp giải:
Tổng hóa trị của nguyên tố trong hợp chất với H và trong oxit cao nhất có giá trị bằng 8.
Lời giải chi tiết:
Hợp chất khí với hiđro của một nguyên tố là RH4 => R có hóa trị IV trong hợp chất khí với H
Hóa trị của R trong oxit cao nhất là VIII – IV = IV => Oxit cao nhất là RO2
\(\begin{array}{l}
\% {m_R} = \frac{R}{{R + 2.16}}.100\% = 46,7\% \\
\to R = 28
\end{array}\)
Vậy R là Si (silic)
Câu hỏi 33 :
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,04% về khối lượng. Nguyên tố R là
- A As
- B S
- C N
- D P
Đáp án: C
Phương pháp giải:
Tổng hóa trị của nguyên tố trong hợp chất khí với hidro và trong oxit cao nhất có trị số bằng 8.
Công thức hợp chất khí là RH3 => Oxit cao nhất là R2O5
\(\% {m_O} = \frac{{16.5}}{{2R + 16.5}}.100\% = 74,04\% \to R\)
Lời giải chi tiết:
Tổng hóa trị của nguyên tố trong hợp chất khí với hidro và trong oxit cao nhất có trị số bằng 8.
Công thức hợp chất khí là RH3 => Oxit cao nhất là R2O5
\(\% {m_O} = \frac{{16.5}}{{2R + 16.5}}.100\% = 74,04\% \to R = 14\)
Vậy R là N
Đáp án C
Câu hỏi 34 :
Hợp chất khí với hiđro của một nguyên tố là RH4. Oxit cao nhất của nó chứa 53,3% oxi về khối lượng. Tìm nguyên tử khối của nguyên tố đó.
- A 12 đvC
- B 28 đvC
- C 32 đvC
- D 60 đvC
Đáp án: B
Phương pháp giải:
Tổng hóa trị của 1 nguyên tố trong hợp chất khí với H và trong oxit cao nhất có trị số là 8.
Hợp chất khí với hiđro của một nguyên tố là RH4 => Oxit cao nhất có công thức: RO2
\(\% {m_O} = \frac{{16.2}}{{{M_R} + 16.2}}\)
Lời giải chi tiết:
Hợp chất khí với hiđro của một nguyên tố là RH4 => Oxit cao nhất có công thức: RO2
\(\% {m_O} = \frac{{16.2}}{{{M_R} + 16.2}} = 53,3\% \to {M_R} = 28\)
Vậy nguyên tử khối của nguyên tố đó là 28 đvC.
Đáp án B
Câu hỏi 35 :
Cho 8,8 gam hỗn hợp hai kim loại A và B (MA <MB) nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thu được 6,72 lít khí hiđro (đktc). Tên của hai kim loại là:
- A B và Al
- B Al và Ga
- C Ga và In
- D In và Tl
Đáp án: B
Phương pháp giải:
Gọi kim loại tương đương với 2 kim loại trên là R.
R + 3HCl → RCl3 + 3/2 H2
Từ số mol H2, tính được số mol của R và tính được khối lượng mol trung bình của hai kim loại.
Khi đó xác định được tên của hai kim loại.
Lời giải chi tiết:
Gọi kim loại tương đương với 2 kim loại A và B là R.
R + 3HCl → RCl3 + 3/2 H2
Ta có: nR= 2/3 . nH2= 2/3 . 0,3= 0,2 mol
Suy ra MR= 8,8 : 0,2= 44 (g/mol)
→ MA < 44 < MB
Vì hai kim loại A và B nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA nên 2 kim loại đó là Al (27) và Ga (70).
Đáp án B
Câu hỏi 36 :
Cho 11,2 gam hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kì liên tiếp, tác dụng hết với dung dịch H2SO4 dư thu được 4,48 lít khí H2 (đktc). Các kim loại đó là:
- A Be và Mg
- B Mg và Ca
- C Ca và Sr
- D Sr và Ba
Đáp án: C
Phương pháp giải:
Gọi kim loại tương đương với 2 kim loại trên là R.
R + H2SO4 → RSO4 + H2 ↑
Từ số mol H2, tính được số mol của R và tính được khối lượng mol trung bình của hai kim loại.
Khi đó xác định được tên của hai kim loại.
Lời giải chi tiết:
Gọi kim loại tương đương với 2 kim loại trên là R.
R + H2SO4 → RSO4 + H2 ↑
Ta có: nR= nH2= 0,2 mol → MR= m:n = 11,2 : 0,2= 56 (g/mol)
Mà hỗn hợp gồm hai kim loại nhóm IIA (giả sử đó là A và B), thuộc hai chu kì liên tiếp và MA < 56 < MB.
Vậy hai kim loại đó là Ca (40) và Sr (88).
Đáp án C
Câu hỏi 37 :
Cho 12 gam kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl thì thu được 11,2 lít khí H2 (đktc). Kim loại R là:
- A Mg.
- B Be.
- C Ca.
- D Ba.
Đáp án: A
Phương pháp giải:
R + 2HCl → RCl2 + H2 ↑
Từ số mol H2 ta tính được số mol R, từ đó tính được khối lượng mol của kim loại R và tìm được tên của R.
Lời giải chi tiết:
R + 2HCl → RCl2 + H2 ↑
Ta có: nR = nH2 = 11,2 : 22,4= 0,5 mol
Vậy MR= m/n = 12 : 0,5= 24 (g/mol)
Vậy R là kim loại Mg.
Đáp án A
Câu hỏi 38 :
Hỗn hợp X gồm 2 kim loại Y và Z đều thuộc nhóm IIA và ở 2 chu kì liên tiếp trong bảng tuần hoàn (MY < MZ). Cho m gam hỗn hợp X vào nước dư thấy thoát ra V lít khí H2. Mặt khác, cho m gam hỗn hợp X vào dung dịch HCl dư, sau phản ứng hoàn toàn thấy thoát ra 3V lít khí H2 (thể tích các khí đo ở cùng điều kiện tiêu chuẩn). Phần trăm khối lượng của Y trong hỗn hợp X là:
- A 54,54%
- B 66,67%
- C 33,33%
- D 45,45%
Đáp án: A
Phương pháp giải:
Vì m gam hỗn hợp X tác dụng với dung dịch HCl dư thu được lượng khí H2 lớn hơn khi phản ứng với nước nên trong X có 1 kim loại không phản ứng với H2O. Mặt khác Y và Z đều thuộc nhóm IIA và ở 2 chu kì liên tiếp trong bảng tuần hoàn (MY < MZ) nên Y là Mg và Z là Ca.
Chọn V= 22,4 lít
Khi đó tìm được số mol của Mg và số mol của Ca. Khi đó tính được % khối lượng của Mg trong hỗn hợp.
Lời giải chi tiết:
Vì m gam hỗn hợp X tác dụng với dung dịch HCl dư thu được lượng khí H2 lớn hơn khi phản ứng với nước nên trong X có 1 kim loại không phản ứng với H2O. Mặt khác Y và Z đều thuộc nhóm IIA và ở 2 chu kì liên tiếp trong bảng tuần hoàn (MY < MZ) nên Y là Mg và Z là Ca.
Mg + H2O → không phản ứng
Ca + 2H2O → Ca(OH)2 + H2 (1)
Mg + 2HCl → MgCl2 + H2 (2)
Ca + 2HCl → CaCl2 + H2 (3)
Ta có: nCa= nH2 (1)= \({V \over {22,4}}(mol)\)
Ta có: nMg= nH2 (2), (3) – nH2 (1)=
Chọn V=22,4 lít ta suy ra nCa= 1 mol và nMg= 2 mol
Vậy %mMg= \({{2.24} \over {2.24 + 1.40}}.100\% = 54,54\% \)
Đáp án A
Câu hỏi 39 :
X là kim loại nhóm IIA. Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (ở đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là:
- A Ba.
- B Ca.
- C Sr.
- D Mg.
Đáp án: B
Phương pháp giải:
*Khi cho 1,7 gam hỗn hợp gồm X và Zn + dung dịch HCl dư thu được 0,03 mol H2.
*Khi cho1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc).
Từ đó tìm được khoảng giá trị của nguyên tử khối của X. Từ đó tìm được tên của kim loại X.
Lời giải chi tiết:
*Khi cho 1,7 gam hỗn hợp gồm X và Zn + dung dịch HCl dư thu được 0,03 mol H2.
Gọi công thức chung của X và Zn là R
R +2HCl → RCl2 + H2 ↑
Ta có: nR= nH2= 0,03 mol → MR= 1,7 : 0,03 = 56,67.
Mà MZn= 65 nên MX < 56,67 (1)
*Khi cho1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc):
X + H2SO4 → XSO4 + H2
Ta có: nX= nH2 < 1,12:22,4 hay nX < 0,05 mol → MX > \({{1,9} \over {0,05}} = 38\) (2)
Từ (1) và (2) ta có 38 < MX < 56,67
Mà X là kim loại hóa trị II nên X là Ca (40).
Đáp án B
Câu hỏi 40 :
Cho dung dịch chứa 8,04 gam hỗn hợp 2 muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, ZX<ZY) vào trong dung dịch AgNO3 (dư) thu được 11,48 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là:
- A 47,2%
- B 58,2%
- C 41,8%
- D 52,8%
Đáp án: A
Phương pháp giải:
Xét 2 trường hợp:
*TH1: Cả 2 muối NaX và NaY đều tác dụng với dung dịch AgNO3.
Khi đó dùng phương pháp trung bình để giải.
*TH2: Chỉ có NaY phản ứng với dung dịch AgNO3, còn NaX không phản ứng.
Lời giải chi tiết:
Xét 2 trường hợp:
*TH1: Cả 2 muối NaX và NaY đều tác dụng với dung dịch AgNO3.
Gọi công thức trung bình của 2 muối NaX và NaY là NaR
PTHH xảy ra là NaR + AgNO3 → AgR ↓ + NaNO3
Ta có: nNaR= nAgR → \({{8,04} \over {R + 23}} = {{11,48} \over {R + 108}}\)
Giải phương trình trên ta được: R= 175,66
Loại vì không có nguyên tố thỏa mãn.
*TH2: Chỉ có NaY phản ứng với dung dịch AgNO3, còn NaX không phản ứng.
Vậy X là F, còn Y là Cl.(do X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, ZX<ZY).
NaCl + AgNO3 → AgCl ↓ + NaNO3
Ta có: nNaCl= nAgCl= 11,48 : 143,5= 0,08 mol → mNaF= 8,04- 0,08.58,5= 3,36 gam
Vậy %mNaF= 3,36.100%/8,04= 41,79%
Đáp án A
Câu hỏi 41 :
Hai cốc đựng dung dịch HCl đặt trên hai đĩa cân X, Y, cân ở trạng thái cân bằng. Cho 5 gam CaCO3 vào cốc X và 4,784 gam M2CO3 (M là kim loại kiềm) vào cốc Y. Sau khi hai muối đã tan hoàn toàn, cân trở lại vị trí thăng bằng. Kim loại M là:
- A K
- B Cs
- C Li
- D Na
Đáp án: D
Phương pháp giải:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (1)
M2CO3 + 2HCl → 2MCl + CO2 + H2O (2)
Sau khi hai muối đã tan hoàn toàn, cân trở lại vị trí thăng bằng nên độ tăng khối lượng ở hai đĩa cân là bằng nhau. Từ đó tính được số mol CO2 thoát ra ở đĩa Y. Từ đó xác định được khối lượng mol của M và tên kim loại M.
Lời giải chi tiết:
Ta có: nCaCO3= 0,05 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (1)
M2CO3 + 2HCl → 2MCl + CO2 + H2O (2)
Ta có: Trên đĩa X, khối lượng tăng một lượng là mCaCO3-mCO2 (1)= 5- 0,05.44= 2,8 gam
Vậy trên đĩa Y, khối lượng cũng tăng một lượng bằng 2,8 gam → mM2CO3- mCO2 (2)= 2,8 gam
→ mCO2 (2)= 4,784 – 2,8=1,984 (gam) → nCO2 (2)= 0,045 mol → nM2CO3= 0,045 mol
→ MM2CO3= 4,784 : 0,045= 106 → M=23 → M là kim loại Na
Đáp án D
Câu hỏi 42 :
Cho 2,3 gam hỗn hợp hai kim loại kiềm X và Y vào nước được 200 gam dung dịch Z chứa các chất tan có nồng độ mol bằng nhau (MX<MY). Cô cạn dung dịch Z thu được 4,0 gam chất rắn khan. Nồng độ % của chất tan tạo bởi kim loại Y là:
- A 3,9%
- B 1,4%
- C 0,4%
- D 0,6%
Đáp án: B
Phương pháp giải:
Gọi công thức trung bình của 2 kim loại kiềm X, Y là M.
2M + 2H2O → 2MOH + H2
Ta có: nM= nMOH → \({{2,3} \over M} = {4 \over {M + 17}}\) → M = 23
Vì trong Z chứa 2 chất tan (XOH và YOH) có nồng độ mol bằng nhau nên 2 kim loại X và Y có số mol bằng nhau. Khi đó tìm được tên của X và Y và nồng độ % chất tan YOH.
Lời giải chi tiết:
Gọi công thức trung bình của 2 kim loại kiềm X, Y là M.
2M + 2H2O → 2MOH + H2
Ta có: nM= nMOH → \({{2,3} \over M} = {4 \over {M + 17}}\) → M = 23
Vì trong Z chứa 2 chất tan (XOH và YOH) có nồng độ mol bằng nhau nên 2 kim loại X và Y có số mol bằng nhau. Vậy X là Li (MLi= 7) và Y là K (MK=39). Gọi x là số mol của Li cũng là số mol của K.
Ta có: mhỗn hợp kim loại= mLi + mK= 7x + 39x = 2,3 suy ra x = 0,05mol → mKOH= 0,05.56= 2,8 (gam)
Do đó C%KOH = \({{{m_{KOH}}} \over {{m_{{\rm{dd}}}}}}.100\% = {{2,8} \over {200}}.100\% = 1,4\% \)
Đáp án B
Câu hỏi 43 :
Hòa tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại nhóm IIA vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là:
- A Mg và Ca
- B Be và Mg
- C Mg và Sr
- D Be và Ca
Đáp án: D
Phương pháp giải:
Với bài toán này ta chia thành 2 trường hợp:
-Trường hợp 1: HCl phản ứng hết thì chất tan chỉ chứa là 2 muối clorua của 2 kim loại kiềm thổ.
-Trường hợp 2: HCl còn dư thì chất tan chứa 2 muối clorua và HCl dư
Lời giải chi tiết:
Với bài toán này ta chia thành 2 trường hợp:
-Trường hợp 1: HCl phản ứng hết thì chất tan chỉ chứa là 2 muối clorua của 2 kim loại kiềm thổ.
Gọi kim loại tương đương với 2 kim loại trên là R
R + 2HCl → RCl2+ H2
Ta có: nR= ½ . nHCl= ½ . 0,25= 0,125 mol
→ MR= mR/ nR= 2,45: 0,125= 19,6 g/mol
Mà số mol của 2 muối này bằng nhau nên tổng khối lượng mol của 2 kim loại này bằng 19,6.2=39,2
→Loại
-Trường hợp 2: HCl còn dư thì chất tan chứa 2 muối clorua và HCl dư
Gọi 2 kim loại là A, B
A + 2HCl → ACl2+ H2
B + 2HCl → BCl2+ H2
dung dịch Y chứa các chất tan có nồng độ mol bằng nhau → Số mol của các chất tan này bằng nhau
→nAcl2= nBCl2= nHCl dư= x mol
→nHCl = 2.nAcl2+ 2.nBCl2+ nHCl dư= 2x+ 2x + x= 5x= 0,2.1,25= 0,25 mol nên x= 0,05 mol
→mkim loại= A.x + B.x= 2,45 gam → A+ B= 2,45: 0,05= 49 →A là Ca (40) và B là Be (9)
Đáp án D
Câu hỏi 44 :
Kim loại R thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hoá học. Cho 4,11 gam R vào 95,95 ml H2O (DH2O = 1 g/ml), sau phản ứng thu được dung dịch bazơ và 0,672 lít khí H2 (đktc).
a) Tìm kim loại R.
b) Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Phương pháp giải:
a) R + 2H2O → R(OH)2 + H2
nH2 = 0,03 mol → nR = 0,03 → MR = mR : nR, từ đó xác định được tên kim loại.
b) Tính được khối lượng của chất tan trong dung dịch sau pư.
Áp dung BTKL → m dd sau pư = mBa + mH2O - mH2
Từ khối lượng của chất tan và khối lượng dung dịch sau pư tính được nồng độ phần trăm của dung dịch thu được sau phản ứng.
Lời giải chi tiết:
a) R + 2H2O → R(OH)2 + H2
nH2 = 0,03 mol → nR = 0,03 → MR = 4,11 : 0,03 = 137 → R là Ba
b) mBa(OH)2 = 0,03.171 = 5,13 gam
m dd sau pư = mBa + mH2O - mH2 = 4,11 + 95,95 - 0,06 = 100 gam
→ C%Ba(OH)2 = 5,13%
Câu hỏi 45 :
Nguyên tử của nguyên tố X có tổng số hạt trong nguyên tử là 20, trong đó hạt mang điện nhiều hơn hạt không mang điện là 4.
a) Xác định nguyên tố X, cho biết vị trí của X trong bảng tuần hoàn các nguyên tố hóa học.
b) Y là một hợp chất của X với hiđro có tổng số hạt mang điện tích dương là 16. Viết công thức electron, công thức cấu tạo của Y biết tổng số nguyên tử trong Y nhỏ hơn 7.
Phương pháp giải:
a) Ta có p + n + e = 20; p + e - n = 4 và p = e
Giải hệ trên tìm được số p, e và n.
Từ số electron ta viết cấu hình và xác định vị trí của X
+ Xác định số electron của nguyên tử.
+ Các e được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử và tuân theo quy tắc: phân lớp s chứa tối đa 2 e; phân lớp p chứa tối đa 6 e; phân lớp d chứa tối đa 10 e; phân lớp f chứa tối đa 14 e.
+ Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thức tự của các lớp electron.
b) Đặt công thức của Y là CaHb
Ta có 6a + b = 8; a + b < 7
Biện luận tìm công thức của Y.
Lời giải chi tiết:
a) Ta có p + n + e = 20; p + e - n = 4 và p = e
Giải hệ trên ta có p = e = 6 và n = 8
Cấu hình electron nguyên tử của X là 1s22s22p2
Vị trí của X trong bảng tuần hoàn: ô 6 (do có 6 electron), chu kì 2 (do có 2 lớp electron), nhóm IVA (do có 4 electron ở lớp ngoài cùng).
b) Đặt công thức của Y là CaHb
Ta có: 6a + b = 16; a + b < 7
Ta thấy chỉ có a = 2 và b = 4 thỏa mãn
Vậy công thức phân tử của Y là C2H4.
Viết công thức electron, công thức cấu tạo của Y:
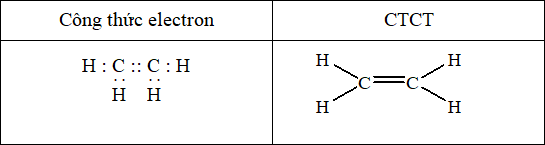
Câu hỏi 46 :
Hợp chất khí với hiđro của nguyên tử nguyên tố R là RH. Trong oxit cao nhất, R chiếm 38,798% về khối lượng.
a) Xác định nguyên tố R.
Viết phương trình hóa học của phản ứng xảy ra (nếu có) khi cho khí R2 tác dụng với Fe đun nóng, dung dịch KI, dung dịch NaOH, dung dịch FeCl2.
b) Viết phương trình hóa học của phản ứng xảy ra (nếu có):
- Khi cho HR loãng tác dụng với Al, CaCO3, KOH, Fe3O4, AgNO3.
- Khi cho HR đặc, nóng tác dụng với KMnO4 tinh thể.
Phương pháp giải:
Từ công thức hợp chất khí với hidro suy ra R thuộc nhóm VIIA.
Từ đó suy ra công thức oxit cao nhất của R.
Từ % khối lượng R trong oxit cao nhất ta xác định được MR, từ đó tìm được tên nguyên tố R.
Sau khi xác định tên nguyên tố R ta viết các phương trình hóa học theo yêu cầu của đề bài.
Lời giải chi tiết:
a) Vì hợp chất khí với hiđro của nguyên tử nguyên tố R là RH nên R thuộc nhóm VIIA.
Suy ra công thức oxit cao nhất của R là R2O7.
Vì trong oxit cao nhất, R chiếm 38,798% về khối lượng nên ta có:
\(\% {m_R} = \frac{{2{M_R}}}{{2{M_R} + 16.7}}.100\% = 38,798\% \)
Giải phương trình trên ta được MR = 35,5.
Vậy nguyên tố R là clo (kí hiệu Cl).
Khi cho khí R2 tác dụng với Fe đun nóng, dung dịch KI, dung dịch NaOH, dung dịch FeCl2 các phản ứng có thể xảy ra là:
2Fe + 3Cl2 → 2FeCl3
Cl2 + 2KI → 2Cl + I2
Cl2 + 2NaOH → NaCl + NaClO + H2O
Cl2 + 2FeCl2 → 2FeCl3
b)
- Khi cho HR loãng tác dụng với Al, CaCO3, KOH, Fe3O4, AgNO3 các phản ứng có thể xảy ra là:
2Al + 6HCl → 2AlCl3 + 3H2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
KOH + HCl → KCl + H2O
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
HCl + AgNO3 → AgCl + HNO3
- Khi cho HR đặc, nóng tác dụng với KMnO4 tinh thể.
2KMnO4 tt + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu hỏi 47 :
Hòa tan hoàn toàn 23 gam hỗn hợp gồm Ba và 2 kim loại kiềm A, B thuộc 2 chu kì liên tiếp vào nước thu được dung dịch D và 5,6 lít khí (đktc). Nếu thêm 0,09 mol Na2SO4 vào dung dịch D thì sau phản ứng vẫn còn dư ion Ba2+. Nếu thêm 0,105 mol Na2SO4 vào dung dịch D thì sau phản ứng còn dư Na2SO4. Tìm 2 kim loại kiềm.
Phương pháp giải:
Đặt công thức chung của 2 kim loại kiềm A, B là R
PTHH:
Ba + 2H2O → Ba(OH)2 + H2
x x x (mol)
2R + 2H2O → 2ROH + H2
y y y/2 (mol)
Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
x x
Theo bài ra ta có:
nH2 = x + y/2 = 0,25 (1)
m hh = 137x + Ry = 23 (2)
0,09 < x < 0,105 (3)
Từ (1), (2), (3) tìm khoảng biến đổi của R.
Mà 2 kim loại kiềm ở 2 chu kì liên tiếp nhau nên tìm được 2 nguyên tố A và B.
Lời giải chi tiết:
Đặt công thức chung của 2 kim loại kiềm A, B là R
PTHH:
Ba + 2H2O → Ba(OH)2 + H2
x x x (mol)
2R + 2H2O → 2ROH + H2
y y y/2 (mol)
Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
x x
Theo bài ra ta có:
nH2 = x + y/2 = 0,25 (1)
m hh = 137x + Ry = 23 (2)
0,09 < x < 0,105 (3)
Từ (1) và (2) → \(x = \frac{{0,5R - 23}}{{2R - 137}}\)
Kết hợp với (3) → 29,7 < R < 33,3
Mà 2 kim loại kiềm ở 2 chu kì liên tiếp nhau nên là Na và K
Câu hỏi 48 :
Cho dung dịch chứa 6,09 gam hỗn hợp gồm 2 muối NaX và NaY ( X, Y là hai nguyên tố có trong tự nhiên, ở 2 chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 dư, thu được 10,34 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là:
- A 58,2 %
- B 50,74%
- C 41,8%
- D 47,2%
Đáp án: B
Phương pháp giải:
Phương pháp
Gọi Z là công thức trung bình của X và Y :
PYHH tổng quát : NaZ + AgNO3 → AgZ + NaNO3
MX < MZ < MY
Áp dụng định luật bảo toàn khối lượng
m NaZ + m AgNO3 = m AgZ + m NaNO3
số mol của các chất bằng nhau
Lời giải chi tiết:
Hướng dẫn giải :
Đặt số mol của AgNO3 là a => số mol của NaNO3 cũng là a
BTKL : m NaZ + m AgNO3 = m AgZ + m NaNO3
ð 6,09 + a . 170 = 10,34 + a . 85
ð a = 0,05 = n NaZ
ð M NaZ = 6,09 : 0,05 = 121,8
ð M Z = 98,8
ð MX < MZ < MY mà X và Y là kế tiếp nhau nên X là Br ( 80 ) , Y là Iot ( 127)
Ta có hệ : 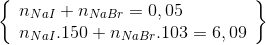 n NaI = 0,02 mol và n NaBr = 0,03 mol
n NaI = 0,02 mol và n NaBr = 0,03 mol
ð m NaBr = 0,03 . 103 = 3,09
ð % m = 3,09 : 6,09 . 100 % = 50,74%
Đáp số B
Câu hỏi 49 :
Nguyên tố X thuộc nhóm VIA trong bảng tuần hoàn. Phần trăm khối lượng của X trong oxit cao nhất là 40%.
Câu 1: Tìm nguyên tố X.
- A O
- B C
- C S
- D N
Đáp án: C
Phương pháp giải:
Hóa trị trong oxit cao nhất của một nguyên tố nhóm A bằng số thứ tự nhóm của nguyên tố đó.
X thuộc nhóm VIA nên có hóa trị VI trong oxit cao nhất => Công thức của oxit cao nhất là: XO3
\(\% {m_X} = \frac{{{M_X}}}{{{M_X} + 16.3}}.100\% = 40\% \to {M_X} = ?\)
Lời giải chi tiết:
Hóa trị trong oxit cao nhất của một nguyên tố nhóm A bằng số thứ tự nhóm của nguyên tố đó.
X thuộc nhóm VIA nên có hóa trị VI trong oxit cao nhất => Công thức của oxit cao nhất là: XO3
\(\% {m_X} = \frac{{{M_X}}}{{{M_X} + 16.3}}.100\% = 40\% \to {M_X} = 32\)
Vậy nguyên tố X là lưu huỳnh, kí hiệu: S
Đáp án C
Câu 2: Gọi Y là hidroxit cao nhất của X. Viết công thức cấu tạo của Y (thỏa mãn qui tắc bát tử) và viết phương trình phản ứng của Y với K2CO3; BaCl2. Y là:
- A H2SO3
- B H2SO4
- C H6SO6
- D H8SO8
Đáp án: B
Phương pháp giải:
Xác định công thức hidroxit (các nguyên tố nhóm A):
- Nếu R là kim loại: Công thức hidroxit là R(OH)n (n là STT nhóm).
- Nếu R là phi kim: Từ công thức nháp: R(OH)n (n là STT nhóm) => công thức HnROn và bỏ bớt các phân tử H2O đến khi không bỏ được nữa ta thu được công thức hidroxit hoàn chỉnh.
Lời giải chi tiết:
Công thức hiroxit cao nhất của S là: S(OH)6 khi bớt 2 H2O ta được H2SO4
- Công thức cấu tạo H2SO4:

- PTHH:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2
H2SO4 + BaCl2 → BaSO4 + 2HCl
Câu hỏi 50 :
X, Y,Z là 3 nguyên tố thuộc cùng chu kì của bảng hệ thống tuần hoàn. Biết oxit của X khi tan trong nước tạo thành một dung dịch làm hồng quỳ tím. Y phản ứng với nước làm xanh giấy quỳ tím, còn Z phản ứng được với cả axit và kiềm. Nếu xếp theo trật tự tăng dần số hiệu nguyên tử thì trật tự đúng sẽ là:
- A X,Y,Z
- B Y, Z, X
- C X, Z, Y
- D Z, Y, X
Đáp án: B
Lời giải chi tiết:
X là phi kim vì oxit của X tan trong nước tạo axit
Y phản ứng với nước làm xanh quỳ nên Y là bazơ
Z phản ứng với cả axit và kiềm nên Z là kim loại có oxit lưỡng tính như Al
Vì theo chiều tăng ĐTHN thì tính axit tăng dần nên sắp xếp trật tự là Y, Z, X
Đáp án B
30 bài tập vận dụng về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học có đáp án và lời giải chi tiết
30 câu hỏi lý thuyết mức độ thông hiểu về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học có đáp án và lời giải chi tiết
40 câu hỏi lý thuyết mức độ nhận biết về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học có đáp án và lời giải chi tiết
20 bài tập về ý nghĩa của bảng tuần hoàn các nguyên tố hóa học đáp án và lời giải chi tiết
20 bài tập vận dụng về bảng tuần hoàn các nguyên tố hóa học có đáp án và lời giải chi tiết
20 câu hỏi lý thuyết mức độ thông hiểu về bảng tuần hoàn các nguyên tố hóa học có đáp án và lời giải chi tiết
20 câu hỏi lý thuyết mức độ nhận biết về bảng tuần hoàn các nguyên tố hóa học có đáp án và lời giải chi tiết
25 câu hỏi lý thuyết mức độ nhận biết về bảng tuần hoàn các nguyên tố hóa học có đáp án và lời giải chi tiết
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









