CHƯƠNG MỞ ĐẦU
Mở đầu
CHƯƠNG 1. PHẢN ỨNG HÓA HỌC
Phản ứng hóa học
Mol và tỉ khối chất khí
Dung dịch và nồng độ
Định luật bảo toàn khối lượng
Tính theo phương trình hóa học
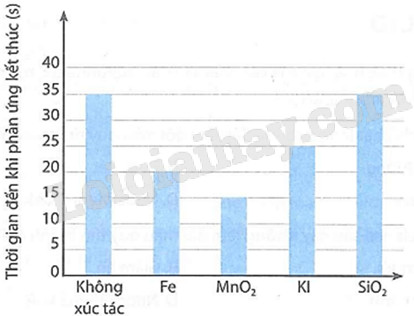
Tốc độ phản ứng và chất xúc tác
CHƯƠNG 2. MỘT SỐ HỢP CHẤT THÔNG DỤNG
Acid
Base - thang pH
Oxide
Muối
Phân bón hóa học
CHƯƠNG 3. KHỐI LƯỢNG RIÊNG VÀ ÁP SUẤT
Khối lượng riêng
Thực hành xác định khối lượng riêng
Áp suất trên một bề mặt
Áp suất chất lỏng. Áp suất khí quyển
Lực đẩy Archimedes
CHƯƠNG 4. TÁC DỤNG LÀM QUAY CỦA LỰC
Tác dụng làm quay của lực. Moment lực
Đòn bẩy và ứng dụng
CHƯƠNG 5. ĐIỆN
Hiện tượng nhiễm điện do cọ xát
Dòng điện, nguồn điện
Mạch điện đơn giản
Tác dụng của dòng điện
Cường độ dòng điện và hiệu điện thế
Thực hành đo cường độ dòng điện và hiệu điện thế
CHƯƠNG 6. NHIỆT
Năng lượng nhiệt và nội năng
Thực hành đo năng lượng nhiệt bằng Joulemeter
Sự truyền nhiệt
Sự nở vì nhiệt
Giải SGK, SBT, VTH Khoa học tự nhiên 8 Bài 7. Tốc độ phản ứng và chất xúc tác Kết nối tri thức
Giải SGK, SBT, VTH Khoa học tự nhiên 8 KNTT Bài 7. Tốc độ phản ứng và chất xúc tác
29 câu hỏi
30 phút
Tự luận
CÁC BÀI TẬP KHÁC