Đề thi học kì 1 Hóa 10 Cánh diều - Đề số 1
Các hạt cấu tạo nên hầu hết các nguyên tử là
Đề bài
Các hạt cấu tạo nên hầu hết các nguyên tử là
-
A.
Nơtron và proton
-
B.
Electron, nơtron và proton
-
C.
Electron và proton
-
D.
Electron và nơtron
Chọn định nghĩa đúng về đồng vị
-
A.
Đồng vị là những nguyên tố có cùng số khối.
-
B.
Đồng vị là những nguyên tố có cùng điện tích hạt nhân.
-
C.
Đồng vị là những nguyên tử có cùng điện tích hạt nhân và cùng số khối.
-
D.
Đồng vị là những nguyên tử có cùng số proton, khác nhau số nơtron.
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
-
A.
2, 6, 8, 18
-
B.
2, 8, 18, 32
-
C.
2, 4, 6, 8
-
D.
2, 6, 10, 14
Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p5. Nguyên tử M là
-
A.
11Na
-
B.
18Ar
-
C.
17Cl
-
D.
19K
Nguyên tố X có số hiệu nguyên tử là 14. Nguyên tố X thuộc nhóm
-
A.
IA.
-
B.
VIA.
-
C.
IB.
-
D.
IVA.
Nguyên tố Y có số hiệu nguyên tử là 24, A thuộc nhóm
-
A.
IA.
-
B.
VIA.
-
C.
IB.
-
D.
VIB.
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \({}_{11}^{23}Na\) là
-
A.
23.
-
B.
24.
-
C.
25.
-
D.
11.
Số khối của nguyên tử bằng tổng
-
A.
số p và n
-
B.
số p và e
-
C.
số n, e và p
-
D.
số điện tích hạt nhân
Nhận định nào không đúng về hai nguyên tử \(_{{\rm{29}}}^{{\rm{63}}}{\rm{Cu}}\) và \(_{{\rm{29}}}^{{\rm{65}}}{\rm{Cu}}\)là
-
A.
là đồng vị của nhau.
-
B.
có cùng số electron.
-
C.
có cùng số nơtron.
-
D.
có cùng số hiệu nguyên tử
Cho cấu hình electron nguyên tử các nguyên tố sau:
a) 1s22s1 b) 1s22s22p63s23p1 c) 1s22s22p5
d) 1s22s22p63s23p4 e) 1s22s22p63s2
Cấu hình của các nguyên tố phi kim là
-
A.
a, b.
-
B.
b, c.
-
C.
c, d.
-
D.
b, e.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
-
A.
4
-
B.
5.
-
C.
6.
-
D.
7.
Hãy cho biết lớp N có thể chứa tối đa số electron là
-
A.
2.
-
B.
8.
-
C.
18.
-
D.
32.
Phát biểu đúng là
-
A.
Trong tất cả các nguyên tử, số proton bằng số nơtron.
-
B.
Những nguyên tử có cùng số khối thuộc cùng một nguyên tố hóa học.
-
C.
Hạt nhân của tất cả các nguyên tử đều có proton và nơtron.
-
D.
Nguyên tố M có Z = 11 thuộc chu kì 3 nhóm IA.
Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Tên nguyên tố R là
-
A.
clo (A=35,5)
-
B.
brom (A=80)
-
C.
photpho (A=31)
-
D.
lưu huỳnh (A=32)
Cho hai nguyên tố X và Y (MX < MY) thuộc 2 nhóm A liên tiếp nhau trong một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân bằng 39. Vị trí của Y trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm IA
-
B.
chu kì 4, nhóm IIA
-
C.
chu kì 3, nhóm IIA
-
D.
chu kì 3, nhóm IA
X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp. Tổng số proton trong hai hạt nhân nguyên tử của X,Y bằng 32. Cấu hình electron của X và Y là
-
A.
1s22s22p63s23p64s2 và 1s22s22p63s23p64s1
-
B.
1s22s22p5 và 1s22s22p63s23p63d54s1
-
C.
1s22s22p6 và 1s22s22p63s23p63d24s2
-
D.
1s22s22p63s2 và 1s22s22p63s23p64s2
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (ZX < ZY). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
-
A.
X và Y đều là nguyên tố kim loại
-
B.
X có 6 electron hóa trị và Y thuộc chu kì 2 trong bảng tuần hoàn.
-
C.
X là nguyên tố p và hạt nhân Y có điện tích là 16+
-
D.
X là nguyên tố phi kim và Y thuộc nhóm IVA trong bảng tuần hoàn.
Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Số khối A của đồng vị thứ 3 của nguyên tố agon là (biết nguyên tử khối trung bình của agon bằng 39,98)
-
A.
40
-
B.
39
-
C.
37
-
D.
35
Khi cho 10 gam một kim loại R thuộc nhóm IIA tác dụng hết với nước tạo ra 0,25 mol khí hiđro. Kim loại R là
-
A.
Mg
-
B.
Ca
-
C.
Sr
-
D.
Be
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
-
A.
8 electron tương ứng với khí hiếm gần nhất.
-
B.
2 electron tương ứng với kim loại gần nhất.
-
C.
8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
-
D.
6 electron tương ứng với phi kim gần nhất.
H2O có nhiệt độ sôi cao hơn H2S là vì
-
A.
H2O có kích thước phân tử nhỏ hơn H2S.
-
B.
H2O có khối lượng phân tử nhỏ hơn H2S.
-
C.
Giữa các phân tử H2O có liên kết hydrogen.
-
D.
Cả A, B và C đều sai
Liên kết trong hợp chất nào dưới đây thuộc loại liên kết ion (biết độ âm điện của Cl(3,16), Al(1,61), Ca(1), S (2,58))
-
A.
AlCl3.
-
B.
CaCl2.
-
C.
CaS.
-
D.
Al2S3.
Cho các phân tử: H2, CO2, HCl, Cl2. Có bao nhiêu phân tử có cực?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Công thức Lewis nào sau đây viết sai?
-
A.
.
-
B.
-
C.
-
D.
Cho các hợp chất sau: Na2O ; H2O ; HCl ; Cl2 ; O3 ; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị không phân cực?
-
A.
2.
-
B.
3.
-
C.
5.
-
D.
6.
Lời giải và đáp án
Các hạt cấu tạo nên hầu hết các nguyên tử là
-
A.
Nơtron và proton
-
B.
Electron, nơtron và proton
-
C.
Electron và proton
-
D.
Electron và nơtron
Đáp án : B
Dựa vào cấu tạo của nguyên tử
Các hạt cấu tạo nên nguyên tử là hạt proton, neutron và electron
Đáp án B
Chọn định nghĩa đúng về đồng vị
-
A.
Đồng vị là những nguyên tố có cùng số khối.
-
B.
Đồng vị là những nguyên tố có cùng điện tích hạt nhân.
-
C.
Đồng vị là những nguyên tử có cùng điện tích hạt nhân và cùng số khối.
-
D.
Đồng vị là những nguyên tử có cùng số proton, khác nhau số nơtron.
Đáp án : D
Dựa vào khái niệm của đồng vị
Đồng vị là những nguyên tố có cùng số proton, khác nhau số neutron
Đáp án D
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
-
A.
2, 6, 8, 18
-
B.
2, 8, 18, 32
-
C.
2, 4, 6, 8
-
D.
2, 6, 10, 14
Đáp án : D
Dựa vào sự phân bố electron trên các phân lớp
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là 2, 6, 10, 14
Đáp án D
Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p5. Nguyên tử M là
-
A.
11Na
-
B.
18Ar
-
C.
17Cl
-
D.
19K
Đáp án : C
Dựa vào cấu hình electron của nguyên tử
Nguyên tử M có cấu hình: 1s22s22p63s23p5 có tổng 17 electron
Đáp án C
Nguyên tố X có số hiệu nguyên tử là 14. Nguyên tố X thuộc nhóm
-
A.
IA.
-
B.
VIA.
-
C.
IB.
-
D.
IVA.
Đáp án : D
Dựa vào số hiệu nguyên tử = số p = số e
Nguyên tố X có số Z = 14 => ô số 14, chu kì 3, nhóm IVA
Đáp án D
Nguyên tố Y có số hiệu nguyên tử là 24, A thuộc nhóm
-
A.
IA.
-
B.
VIA.
-
C.
IB.
-
D.
VIB.
Đáp án : D
Dựa vào số hiệu nguyên tử = số p = số e
Nguyên tố Y có số hiệu nguyên tử là 24 => A thuộc nhóm VIB
Đáp án D
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \({}_{11}^{23}Na\) là
-
A.
23.
-
B.
24.
-
C.
25.
-
D.
11.
Đáp án : D
Số điện tích hạt nhân = số Z
Z = 11
Đáp án D
Số khối của nguyên tử bằng tổng
-
A.
số p và n
-
B.
số p và e
-
C.
số n, e và p
-
D.
số điện tích hạt nhân
Đáp án : A
Số khối của nguyên tử bằng tổng số p và n
Đáp án A
Nhận định nào không đúng về hai nguyên tử \(_{{\rm{29}}}^{{\rm{63}}}{\rm{Cu}}\) và \(_{{\rm{29}}}^{{\rm{65}}}{\rm{Cu}}\)là
-
A.
là đồng vị của nhau.
-
B.
có cùng số electron.
-
C.
có cùng số nơtron.
-
D.
có cùng số hiệu nguyên tử
Đáp án : A
Dựa vào khái niệm của đồng vị
Hai nguyên tử có cùng số proton, khác nhau về số neutron => là đồng vị của nhau
Đáp án A
Cho cấu hình electron nguyên tử các nguyên tố sau:
a) 1s22s1 b) 1s22s22p63s23p1 c) 1s22s22p5
d) 1s22s22p63s23p4 e) 1s22s22p63s2
Cấu hình của các nguyên tố phi kim là
-
A.
a, b.
-
B.
b, c.
-
C.
c, d.
-
D.
b, e.
Đáp án : C
Các nguyên tố phi kim thường có 5, 6, 7 electron lớp ngoài cùng
a) có 3e lớp ngoài cùng => kim loại
b) có 3e lớp ngoài cùng => kim loại
c) có 7e lớp ngoài cùng => phi kim
d) có 6e lớp ngoài cùng => phi kim
e) có 2e lớp ngoài cùng => kim loại
đáp án C
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
-
A.
4
-
B.
5.
-
C.
6.
-
D.
7.
Đáp án : C
Lớp K có tối đa 2 electron
Lớp L có tối đa 8 electron
Vì nguyên tử X có 4 electron lớp L, và 2 electron lớp X => có tổng 6 electron
Đáp án C
Hãy cho biết lớp N có thể chứa tối đa số electron là
-
A.
2.
-
B.
8.
-
C.
18.
-
D.
32.
Đáp án : D
Lớp N là lớp thứ 4 có tối đa 32 electron
Đáp án D
Phát biểu đúng là
-
A.
Trong tất cả các nguyên tử, số proton bằng số nơtron.
-
B.
Những nguyên tử có cùng số khối thuộc cùng một nguyên tố hóa học.
-
C.
Hạt nhân của tất cả các nguyên tử đều có proton và nơtron.
-
D.
Nguyên tố M có Z = 11 thuộc chu kì 3 nhóm IA.
Đáp án : D
Dựa vào kiến thức về nguyên tử
Nguyên tố M có Z = 11 => M là Na thuộc chu kì 3, nhóm IA
Đáp án D
Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Tên nguyên tố R là
-
A.
clo (A=35,5)
-
B.
brom (A=80)
-
C.
photpho (A=31)
-
D.
lưu huỳnh (A=32)
Đáp án : B
Ta có : p + n + e = 115
P + e = n + 25
=> n = 45 ; p = e = 35
Đáp án B
Cho hai nguyên tố X và Y (MX < MY) thuộc 2 nhóm A liên tiếp nhau trong một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân bằng 39. Vị trí của Y trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm IA
-
B.
chu kì 4, nhóm IIA
-
C.
chu kì 3, nhóm IIA
-
D.
chu kì 3, nhóm IA
Đáp án : A
Vì X và Y thuộc 2 nhóm A nên tiếp nên PX – PY = 1
Vì tổng số đơn vị điện tích hạt nhân bằng 39 => PX + PY = 39
Vì X và Y thuộc 2 nhóm A nên tiếp nên PX – PY = 1
PX = 20; PY = 19
Vậy Y là K thuộc chu kì 4 nhóm IA
Đáp án A
X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp. Tổng số proton trong hai hạt nhân nguyên tử của X,Y bằng 32. Cấu hình electron của X và Y là
-
A.
1s22s22p63s23p64s2 và 1s22s22p63s23p64s1
-
B.
1s22s22p5 và 1s22s22p63s23p63d54s1
-
C.
1s22s22p6 và 1s22s22p63s23p63d24s2
-
D.
1s22s22p63s2 và 1s22s22p63s23p64s2
Đáp án : D
Dựa vào X, Y thuộc cùng một nhóm và thuộc hai chu kì liên tiếp
Vì X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp nên PY – PX = 8
Tổng số proton trong hai hạt nhân nguyên tử X, Y bằng 32 => PX + PY = 32
PX = 12; PY = 20
Cấu hình X và Y là: 1s22s22p63s2 và 1s22s22p63s23p64s2
Đáp án D
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (ZX < ZY). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
-
A.
X và Y đều là nguyên tố kim loại
-
B.
X có 6 electron hóa trị và Y thuộc chu kì 2 trong bảng tuần hoàn.
-
C.
X là nguyên tố p và hạt nhân Y có điện tích là 16+
-
D.
X là nguyên tố phi kim và Y thuộc nhóm IVA trong bảng tuần hoàn.
Đáp án : A
Gọi ZX, ZY lần lượt là số proton của nguyên tử nguyên tố X và Y. Ta có:
ZX + ZY = 32 (1)
Vì X và Y thuộc cùng nhóm A ở hai chu kì kế tiếp nhau nên số proton của chúng khác nhau 8, 18 hoặc 32 đơn vị.
Giả sử ZY > ZX.
Trường hợp 1: ZY – ZX = 8 (2)
Kết hợp (1) và (2) giải hệ phương trình ta được: ZX = 12; ZY = 20.
Cấu hình electron của X: 1s22s22p63s2 (nhóm IIA).
Cấu hình electron của Y: 1s22s22p63s23p64s2 (nhóm IIA).
Vậy trường hợp 1 thỏa mãn, X là magnesium (Mg) và Y là calcium (Ca).
Trường hợp 2: ZY – ZX = 18 (3)
Kết hợp (1) và (3) giải hệ phương trình ta được: ZX = 7; ZY = 25.
Cấu hình electron của X: 1s22s22p3 (nhóm VA)
Cấu hình electron của Y: 1s22s22p63s23p63d54s2 (nhóm VIIB)
Vậy trường hợp 2 không thỏa mãn.
Trường hợp 3: ZY – ZX = 32 (4)
Kết hợp (1) và (4) giải hệ phương trình ta được: ZX = 0; ZY = 32.
Vậy trường hợp 3 không thỏa mãn.
Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Số khối A của đồng vị thứ 3 của nguyên tố agon là (biết nguyên tử khối trung bình của agon bằng 39,98)
-
A.
40
-
B.
39
-
C.
37
-
D.
35
Đáp án : A
Dựa vào công thức tính nguyên tử khối trung bình
Gọi số khối của đồng vị thứ 3 của agon là x
Ta có : \(\begin{array}{l}\bar A = \frac{{36.0,34 + 38.0,06 + x.99,6}}{{100}} = 39,98\\ \to x = 39,99 \approx 40\end{array}\)
Đáp án A
Khi cho 10 gam một kim loại R thuộc nhóm IIA tác dụng hết với nước tạo ra 0,25 mol khí hiđro. Kim loại R là
-
A.
Mg
-
B.
Ca
-
C.
Sr
-
D.
Be
Đáp án : B
Dựa vào số mol của H2 để tính nguyên tử khối của R
\(\begin{array}{l}R + 2{H_2}O \to R{(OH)_2} + {H_2}\\{\rm{ 0,25 }} \leftarrow {\rm{ 0,25}}\\{{\rm{M}}_R} = \frac{{10}}{{0,25}} = 40(Ca)\end{array}\)
Đáp án B
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
-
A.
8 electron tương ứng với khí hiếm gần nhất.
-
B.
2 electron tương ứng với kim loại gần nhất.
-
C.
8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
-
D.
6 electron tương ứng với phi kim gần nhất.
Đáp án : C
Dựa vào kiến thức về quy tắc octet
Theo quy tắc octet, các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
Đáp án C
H2O có nhiệt độ sôi cao hơn H2S là vì
-
A.
H2O có kích thước phân tử nhỏ hơn H2S.
-
B.
H2O có khối lượng phân tử nhỏ hơn H2S.
-
C.
Giữa các phân tử H2O có liên kết hydrogen.
-
D.
Cả A, B và C đều sai
Đáp án : C
Giải thích dựa trên liên kết hydrogen và liên kết van der Waals
H2O có nhiệt độ sôi cao hơn H2S vì H2O có liên kết hydrogen
Đáp án C
Liên kết trong hợp chất nào dưới đây thuộc loại liên kết ion (biết độ âm điện của Cl(3,16), Al(1,61), Ca(1), S (2,58))
-
A.
AlCl3.
-
B.
CaCl2.
-
C.
CaS.
-
D.
Al2S3.
Đáp án : B
Liên kết ion có hiệu độ âm điện \( \ge 1,7\)
CaCl2 có hiệu độ âm điện bằng 2,16 > 1,7 => chứa liên kết ion
Đáp án B
Cho các phân tử: H2, CO2, HCl, Cl2. Có bao nhiêu phân tử có cực?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : A
Liên kết cộng hóa trị phân cực có: \(0,4 \le \Delta \chi < 1,7\)
HCl có hiệu độ âm điện nằm trong khoảng 0,4 – 1,7 => là liên kết cộng hóa trị phân cực
Đáp án A
Công thức Lewis nào sau đây viết sai?
-
A.
.
-
B.
-
C.
-
D.
Đáp án : B
Công thức Lewis biểu thị sự góp chung electron để tạo thành liên kết và dùng dấu – để thể hiện cho liên kết, các electron chưa liên kết được biểu thị bằng dấu “.”
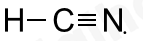
Đáp án B
Cho các hợp chất sau: Na2O ; H2O ; HCl ; Cl2 ; O3 ; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị không phân cực?
-
A.
2.
-
B.
3.
-
C.
5.
-
D.
6.
Đáp án : B
Liên kết cộng hóa trị không phân cực có: \(\Delta \chi < 0,4\)
Cl2, O3, CH4 chứa liên kết cộng hóa trị không phân cực
Đáp án B
Cho kí hiệu các nguyên tử sau:
Cấu hình electron nào sau đây là của fluorine (Z = 9)
Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 3, 11, 19. Phát biểu nào sau đây là sai?
Trong nguyên tử X, electron cuối cùng phân bố ở 3d8. Số electron lớp ngoài cùng của X là
Nguyên tử X có khối lượng xấp xỉ bằng 16 amu, số hạt không mang điện là 8. Số hạt mang điện là
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận