Đề thi giữa kì 2 Hóa 10 - Cánh diều - Đề số 6
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
Đề bài
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
-
A.
electron
-
B.
neutron
-
C.
proton
-
D.
cation
Trong quá trình: Br2 \( \to \)2Br- thì một phân tử Br2 đã:
-
A.
nhận thêm 1 electron
-
B.
nhận thêm 2 electron
-
C.
nhường đi 2 electron
-
D.
nhường đi 1 electron
Số oxi hóa là một đại lượng đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
-
A.
Hóa trị
-
B.
Điện tích
-
C.
Khối lượng
-
D.
Số hiệu
Số oxi hóa của nitrogen trong hợp chất KNO3 là
-
A.
+3
-
B.
+5
-
C.
+7
-
D.
+2
Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
-
A.
+2
-
B.
+3
-
C.
+5
-
D.
+6
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 + O2 \( \to \)2NO \({\Delta _r}H_{298}^o = 180kJ\)
Kết luận nào sau đây đúng?
-
A.
Phản ứng tỏa nhiệt ra môi trường
-
B.
Phản ứng xảy ra thuận lợi ở điều kiện thường
-
C.
Phản ứng hóa học xảy ra có sự hấp thu nhiệt từ môi trường
-
D.
Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Cho các phương trình nhiệt hóa học sau:
(a) CO(g) + O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283,00kJ\)
(b) C2H6OH(l) +O2(g) \( \to \) 2CO2(g) + 3H2O(l) \({\Delta _r}H_{298}^o = - 21366,89kJ\)
(c) ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^o = + 235,21kJ\)
Số phản ứng tỏa nhiệt là
-
A.
2
-
B.
1
-
C.
0
-
D.
3
Phản ứng nào biểu diễn nhiệt tạo thành tiêu chuẩn của CO(g), biết \({\Delta _f}H_{298}^o\)(CO, g) = -110,5 kJ/mol?
-
A.
C(graphite) + ½ O2(g) \( \to \) CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
B.
C (graphite) + CO2(g) \( \to \) 2CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
C.
CO(g) + O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
D.
2C(graphite) + O2(g) \( \to \) 2CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
Số oxi hóa của S trong phân tử Na2S2O3 là
-
A.
0
-
B.
-2
-
C.
+2
-
D.
+4
Cho phản ứng có dạng: \(aA(g) + bB(g) \to mM(g) + nN(g)\)
Công thức tính biến thiến enthalpy phản ứng theo năng lượng liên kết Eb là
-
A.
\({\Delta _r}H_{298}^o = {E_b}(A) + {E_b}(B) - {E_b}(M) - {E_b}(N)\)
-
B.
\({\Delta _r}H_{298}^o = a.{E_b}(A) + b.{E_b}(B) - m.{E_b}(M) - n.{E_b}(N)\)
-
C.
\({\Delta _r}H_{298}^o = {E_b}(M) + {E_b}(N) - {E_b}(A) - {E_b}(B)\)
-
D.
\({\Delta _r}H_{298}^o = m.{E_b}(M) + n.{E_b}(N) - a.{E_b}(A) - b.{E_b}(B)\)
Phát biểu nào sau đây là sai?
-
A.
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất
-
B.
Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn
-
C.
Nhiệt tọa thành của các đơn chất ở dạng bền vững nhất bằng một.
-
D.
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các sản phẩm và tổng nhiệt tạo thành các chất đầu
Trong phản ứng thu nhiệt, dấu của \(\Delta \)H dương vì
-
A.
năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm
-
B.
năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm
-
C.
hệ giải phóng năng lượng dưới dạng nhiệt
-
D.
enthalpy của chất phản ứng lớn hơn enthalpu của chất sản phẩm
Trong phản ứng: 3Cl2 + 6KOH \( \to \) KClO3 + 5KCl + 3H2O. Thì Cl2 đóng vai trò
-
A.
chất khử
-
B.
chất oxi hóa
-
C.
vừa là chất oxi hóa, vừa là chất khử
-
D.
môi trường
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oix hóa – khử là phản ứng luôn xảy ra đồng thời sự oxi hóa và sự khử
-
B.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố
-
C.
Phản ứng oxi hóa – khử là phản ứng có sự thay đổi số oxi hóa của tất cả các nguyên tố
-
D.
Phản ứng oxi hóa – khử là phản ứng có sự chuyển electron giữa các chất tham gia
Hỗn hợp potassium chlorate (KClO3) và phosphorus đỏ là thành phần chính của “thuốc súng” sử dụng báo hiệu cuộc đua bắt đầu. Phản ứng giữa hai chất sinh ra lượng lớn khói màu trắng theo phản ứng sau: KClO3 + P \( \to \) KCl + P2O5
Hệ số cân bằng nguyên tối giản của chất oxi hóa là
-
A.
6
-
B.
5
-
C.
4
-
D.
3
Carbon đóng vai trò chất oxi hóa ở phản ứng nào sau đây?
-
A.
-
B.
-
C.
-
D.
Phản ứng tự oxi hóa – tự khử là phản ứng oxi hóa – khử trong đó nguyên tử nhường và nguyên tử nhận electron thuộc cùng một nguyên tố, có cùng số oxi hóa ban đầu và thuộc cùng một chất. Trong các phản ứng, phản ứng nào là phản ứng tự oxi hóa – tự khử.
-
A.
3Cl2 + 3Fe \( \to \) 2FeCl3
-
B.
CH4 + 2O2 \( \to \) CO2 + 2H2O
-
C.
NH4NO3 \( \to \) N2 + 2H2O
-
D.
Cl2 + 6KOH \( \to \) KClO3 + 5KCl + 3H2O
Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình

Biến thiên enthalpy chuẩn của phản ứng sau: 2NO2(g) \( \to \) N2O4(g) là
-
A.
-57,24 kJ
-
B.
24,04 kJ
-
C.
57,24 kJ
-
D.
-24,04 kJ
Biến thiên enthalpy chuẩn của một phản ứng được biểu thị tại hình vẽ bên dưới. Kết luận nào sau đây là đúng với sơ đồ hình vẽ?

-
A.
Phản ứng trong hình vẽ là phản ứng tỏa nhiệt
-
B.
Biến thiên enthalpy của phản ứng là a kJ/mol.
-
C.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm
-
D.
Phản ứng trong hình vẽ là phản ứng thu nhiệt.
Cho \({\Delta _f}H_{298}^o\)(NaCl(s)) = -411,1 kJ/mol. Biết 1J = 0,239 cal. Enthalpy tạo thành chuẩn của NaCl(2) là
-
A.
98,2529 kcal/mol
-
B.
-98,2529 kcal/mol
-
C.
411,1 kcal/mol
-
D.
-411,1 kcal/mol
Cho 2 phương trình nhiệt hóa học sau:

Khẳng định đúng là
a) Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng (2) là phản ứng thu nhiệt
b) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng tỏa nhiệt.
c) Phản ứng (1) và phản ứng (2) là phản ứng thu nhiệt
d) Phản ứng (1) và phản ứng (2) là phản ứng tỏa nhiệt
Số khẳng định đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Cho từng chất. Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa khử là
-
A.
5
-
B.
6
-
C.
7
-
D.
8
Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là:
Fe3O4 + H2SO4 \( \to \)Fe2(SO4)3 + SO2 + H2O
-
A.
21
-
B.
26
-
C.
19
-
D.
28
Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sản phẩm khử duy nhất của N+5). Biểu thức liên hệ giữa x và y là
-
A.
y = 17x
-
B.
x = 15y
-
C.
x = 17y
-
D.
y = 15x
Tính biến thiên enthalpy chuẩn của phản ứng:
C3H6(g) + H2(g) \( \to \) C3H8(g)
Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau

-
A.
126 (kJ)
-
B.
-134 (kJ)
-
C.
-156 (kJ)
-
D.
-126 (kJ)
Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
\(S{O_2}(g) + \frac{1}{2}{O_2}(g) \to S{O_3}(l)\) \({\Delta _r}H_{298}^o = - 144,2kJ\)
Biết \({\Delta _f}H_{298}^0(S{O_3}(g)) = - 441,0kJ/mol\). Nhiệt tạo thành chuẩn của SO2 là
-
A.
-441,0 kJ/mol
-
B.
-144,2 kJ/mol
-
C.
-296,8 kJ/mol
-
D.
-167,2 kJ/mol
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) \( \to \) 2NO(g) \({\Delta _r}H_{298}^o = 180kJ\)
Kết luận nào sau đây đúng?
-
A.
Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
-
B.
Phản ứng tỏa nhiệt
-
C.
Phản ứng xảy ra thuận lợi hơn ở điều kiện thường
-
D.
Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Cho các phản ứng dưới đây:
(1) CO(g) + ½ (O2) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283kJ\)
(2) C(s) + H2O(g) \( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^o = + 131,25kJ\)
(3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\)
(4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\)
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,…) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hư hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25oC, phản ứng giữa 1 mol sulfur với oxygen xảy ra theo phương trình: S(s) + O2(g) \( \to \) SO2(g) và tỏa ra một lượng nhiệt là 296,8 kJ. Cho các phát biểu sau:
(a) 28,8 gam sulfuric cháy hoàn toàn tỏa ra một lượng nhiệt là 267120 J
(b) Biến thiên enthalpy chuẩn của phản ứng là – 296,8 kJ
(c) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,8 kJ/mol
(d) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia. Biết trong hợp chất, sulfur có các số oxi hóa thường gặp là -2, +4, +6
(e) 0,6 mol sulfur tác dụng hết với oxygen giải phóng 178,08 kJ năng lượng dưới dạng nhiệt
Số phát biết đúng là
-
A.
3
-
B.
4
-
C.
5
-
D.
2
Trong phòng thí nghiệm, hydrochloric acid đặc có thể dùng để điều chế khí chlorine theo hai phản ứng:
16HCl(aq) + 2KMnO4(s) \( \to \) 2 MnCl2 (aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
4HCl(aq) + MnO2(s) \( \to \) MnCl2(aq) + 2H2O (l) + Cl2(g) (2)
Cho bảng giá trị enthalpy tạo thành chuẩn (kJ/mol) của các chất như dưới đây:

Biến thiên enthalpy chuẩn của phản ứng (1) là
-
A.
118 kJ
-
B.
198 kJ
-
C.
122 kJ
-
D.
176 kJ
Lời giải và đáp án
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
-
A.
electron
-
B.
neutron
-
C.
proton
-
D.
cation
Đáp án : A
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận electron
Đáp án A
Trong quá trình: Br2 \( \to \)2Br- thì một phân tử Br2 đã:
-
A.
nhận thêm 1 electron
-
B.
nhận thêm 2 electron
-
C.
nhường đi 2 electron
-
D.
nhường đi 1 electron
Đáp án : B
Br2 + 2e \( \to \)Br-
Đáp án B
Số oxi hóa là một đại lượng đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
-
A.
Hóa trị
-
B.
Điện tích
-
C.
Khối lượng
-
D.
Số hiệu
Đáp án : B
Dựa vào lý thuyết về khái niệm số oxi hóa
Số oxi hóa là một đại lượng đặc trưng cho đại lượng điện tích của nguyên tử trong phân tử
Số oxi hóa của nitrogen trong hợp chất KNO3 là
-
A.
+3
-
B.
+5
-
C.
+7
-
D.
+2
Đáp án : B
Cách xác định số oxi hóa
Số oxi hóa của nitrogen trong hợp chất KNO3 là +5
Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
-
A.
+2
-
B.
+3
-
C.
+5
-
D.
+6
Đáp án : D
Dựa vào cách xác định số oxi hóa
Gọi số oxi hóa của S trong SO3 là x
1.x + 3.(-2) = 0 => x = 6
Đáp án D
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 + O2 \( \to \)2NO \({\Delta _r}H_{298}^o = 180kJ\)
Kết luận nào sau đây đúng?
-
A.
Phản ứng tỏa nhiệt ra môi trường
-
B.
Phản ứng xảy ra thuận lợi ở điều kiện thường
-
C.
Phản ứng hóa học xảy ra có sự hấp thu nhiệt từ môi trường
-
D.
Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
Phản ứng có \({\Delta _r}H_{298}^o\)> 0 nên là phản ứng thu nhiệt, hấp thu nhiệt từ môi trường
Phản ứng xảy ra ở nhiệt độ cao
Đáp án C
Cho các phương trình nhiệt hóa học sau:
(a) CO(g) + O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283,00kJ\)
(b) C2H6OH(l) +O2(g) \( \to \) 2CO2(g) + 3H2O(l) \({\Delta _r}H_{298}^o = - 21366,89kJ\)
(c) ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^o = + 235,21kJ\)
Số phản ứng tỏa nhiệt là
-
A.
2
-
B.
1
-
C.
0
-
D.
3
Đáp án : A
Dựa vào lý thuyết về năng lượng hóa học
(a), (b) có \({\Delta _r}H_{298}^o\)< 0, nên là phản ứng tỏa nhiệt
Đáp án A
Phản ứng nào biểu diễn nhiệt tạo thành tiêu chuẩn của CO(g), biết \({\Delta _f}H_{298}^o\)(CO, g) = -110,5 kJ/mol?
-
A.
C(graphite) + ½ O2(g) \( \to \) CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
B.
C (graphite) + CO2(g) \( \to \) 2CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
C.
CO(g) + O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
-
D.
2C(graphite) + O2(g) \( \to \) 2CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
Đáp án : A
Dựa vào lý thuyết về biến thiên enthalpy
Phản ứng biểu diễn nhiệt tạo thành chuẩn của CO(g) là:
C(graphite) + ½ O2(g) \( \to \) CO(g) \({\Delta _r}H_{298}^o = - 110,5kJ\)
Đáp án A
Số oxi hóa của S trong phân tử Na2S2O3 là
-
A.
0
-
B.
-2
-
C.
+2
-
D.
+4
Đáp án : C
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Số oxi hóa của S trong phân tử Na2S2O3 là +2
Đáp án C
Cho phản ứng có dạng: \(aA(g) + bB(g) \to mM(g) + nN(g)\)
Công thức tính biến thiến enthalpy phản ứng theo năng lượng liên kết Eb là
-
A.
\({\Delta _r}H_{298}^o = {E_b}(A) + {E_b}(B) - {E_b}(M) - {E_b}(N)\)
-
B.
\({\Delta _r}H_{298}^o = a.{E_b}(A) + b.{E_b}(B) - m.{E_b}(M) - n.{E_b}(N)\)
-
C.
\({\Delta _r}H_{298}^o = {E_b}(M) + {E_b}(N) - {E_b}(A) - {E_b}(B)\)
-
D.
\({\Delta _r}H_{298}^o = m.{E_b}(M) + n.{E_b}(N) - a.{E_b}(A) - b.{E_b}(B)\)
Đáp án : B
Dựa vào lý thuyết về năng lượng hóa học
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
\({\Delta _r}H_{298}^o = a.{E_b}(A) + b.{E_b}(B) - m.{E_b}(M) - n.{E_b}(N)\)
Đáp án B
Phát biểu nào sau đây là sai?
-
A.
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất
-
B.
Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn
-
C.
Nhiệt tọa thành của các đơn chất ở dạng bền vững nhất bằng một.
-
D.
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các sản phẩm và tổng nhiệt tạo thành các chất đầu
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
C sai, vì nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0
Đáp án C
Trong phản ứng thu nhiệt, dấu của \(\Delta \)H dương vì
-
A.
năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm
-
B.
năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm
-
C.
hệ giải phóng năng lượng dưới dạng nhiệt
-
D.
enthalpy của chất phản ứng lớn hơn enthalpu của chất sản phẩm
Đáp án : B
Dựa vào lý thuyết về enthalpy
Trong phản ứng thu nhiệt, dấu của \(\Delta \)H dương vì năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm
Đáp án B
Trong phản ứng: 3Cl2 + 6KOH \( \to \) KClO3 + 5KCl + 3H2O. Thì Cl2 đóng vai trò
-
A.
chất khử
-
B.
chất oxi hóa
-
C.
vừa là chất oxi hóa, vừa là chất khử
-
D.
môi trường
Đáp án : B
Chất oxi hóa, chất khử trong phản ứng
\(C{l_2}^o + 2{\rm{e}} \to 2C{l^ - }\)
=> Cl2 đóng vai trò là chất oxi hóa
Đáp án B
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oix hóa – khử là phản ứng luôn xảy ra đồng thời sự oxi hóa và sự khử
-
B.
Phản ứng oxi hóa – khử là phản ứng trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố
-
C.
Phản ứng oxi hóa – khử là phản ứng có sự thay đổi số oxi hóa của tất cả các nguyên tố
-
D.
Phản ứng oxi hóa – khử là phản ứng có sự chuyển electron giữa các chất tham gia
Đáp án : C
Dựa vào lý thuyết về phản ứng oxi hóa – khử
C sai, vì phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của 1 vài nguyên tố
Đáp án C
Hỗn hợp potassium chlorate (KClO3) và phosphorus đỏ là thành phần chính của “thuốc súng” sử dụng báo hiệu cuộc đua bắt đầu. Phản ứng giữa hai chất sinh ra lượng lớn khói màu trắng theo phản ứng sau: KClO3 + P \( \to \) KCl + P2O5
Hệ số cân bằng nguyên tối giản của chất oxi hóa là
-
A.
6
-
B.
5
-
C.
4
-
D.
3
Đáp án : B
Dựa vào lý thuyết về phản ứng oxi hóa – khử
5KClO3 + 6P ⟶ 5KCl + 3P2O5
Cl+5 + 6e ⟶ Cl-1
P0 ⟶ P+5 + 5e
Chất oxi hoá là KClO3
Đáp án B
Carbon đóng vai trò chất oxi hóa ở phản ứng nào sau đây?
-
A.
-
B.
-
C.
-
D.
Đáp án : D
Cách xác định số oxi hóa
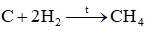
C + 4e \( \to \) C-4
=> Carbon đóng vai trò chất oxi hóa
Đáp án D
Phản ứng tự oxi hóa – tự khử là phản ứng oxi hóa – khử trong đó nguyên tử nhường và nguyên tử nhận electron thuộc cùng một nguyên tố, có cùng số oxi hóa ban đầu và thuộc cùng một chất. Trong các phản ứng, phản ứng nào là phản ứng tự oxi hóa – tự khử.
-
A.
3Cl2 + 3Fe \( \to \) 2FeCl3
-
B.
CH4 + 2O2 \( \to \) CO2 + 2H2O
-
C.
NH4NO3 \( \to \) N2 + 2H2O
-
D.
Cl2 + 6KOH \( \to \) KClO3 + 5KCl + 3H2O
Đáp án : D
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Cl2 + 6KOH \( \to \) KClO3 + 5KCl + 3H2O là phản ứng tự oxi hóa – tự khử.
Đáp án D
Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình

Biến thiên enthalpy chuẩn của phản ứng sau: 2NO2(g) \( \to \) N2O4(g) là
-
A.
-57,24 kJ
-
B.
24,04 kJ
-
C.
57,24 kJ
-
D.
-24,04 kJ
Đáp án : A
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(sp) - {\Delta _f}H_{298}^o(c{\rm{d}})\)
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o({N_2}{{\rm{O}}_4}) - 2{\Delta _f}H_{298}^o(N{O_2}) = 9,16 - 2.33,2 = - 57,24kJ\)
Đáp án A
Biến thiên enthalpy chuẩn của một phản ứng được biểu thị tại hình vẽ bên dưới. Kết luận nào sau đây là đúng với sơ đồ hình vẽ?

-
A.
Phản ứng trong hình vẽ là phản ứng tỏa nhiệt
-
B.
Biến thiên enthalpy của phản ứng là a kJ/mol.
-
C.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm
-
D.
Phản ứng trong hình vẽ là phản ứng thu nhiệt.
Đáp án : A
Sử lí đồ thị biến thiên enthalpy các chất trong phản ứng
Phản ứng trong hình vẽ là phản ứng tỏa nhiệt do \({\Delta _r}H_{298}^o\)< 0.
Đáp án A
Cho \({\Delta _f}H_{298}^o\)(NaCl(s)) = -411,1 kJ/mol. Biết 1J = 0,239 cal. Enthalpy tạo thành chuẩn của NaCl(2) là
-
A.
98,2529 kcal/mol
-
B.
-98,2529 kcal/mol
-
C.
411,1 kcal/mol
-
D.
-411,1 kcal/mol
Đáp án : B
Bài toán đổi đơn vị
\({\Delta _f}H_{298}^o\)(NaCl(s)) = -411,1 kJ/mol = -98,2529 kcal/mol.
Đáp án B
Cho 2 phương trình nhiệt hóa học sau:

Khẳng định đúng là
a) Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng (2) là phản ứng thu nhiệt
b) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng tỏa nhiệt.
c) Phản ứng (1) và phản ứng (2) là phản ứng thu nhiệt
d) Phản ứng (1) và phản ứng (2) là phản ứng tỏa nhiệt
Số khẳng định đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Đáp án : D
Dựa vào lý thuyết về năng lượng hóa học
Vì \({\Delta _r}H_{298}^o\)của phản ứng (1) > 0 => phản ứng thu nhiệt
Vì \({\Delta _r}H_{298}^o\)của phản ứng (2) < 0 => phản ứng tỏa nhiệt
b) đúng
a), c), d) sai
Đáp án D
Cho từng chất. Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa khử là
-
A.
5
-
B.
6
-
C.
7
-
D.
8
Đáp án : C
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng thuộc loại phản ứng oxi hóa khử
Đáp án C
Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là:
Fe3O4 + H2SO4 \( \to \)Fe2(SO4)3 + SO2 + H2O
-
A.
21
-
B.
26
-
C.
19
-
D.
28
Đáp án : B
Dựa vào lý thuyết về phản ứng oxi hóa – khử
2Fe3O4 + 10H2SO4 \( \to \) 3Fe2(SO4)3 + SO2 + 10H2O
Tổng hệ số cân bằng của các chất trong phản ứng = 2 + 10 + 3 + 1 + 10 = 26
Đáp án B
Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sản phẩm khử duy nhất của N+5). Biểu thức liên hệ giữa x và y là
-
A.
y = 17x
-
B.
x = 15y
-
C.
x = 17y
-
D.
y = 15x
Đáp án : A
Dựa vào lý thuyết về phản ứng oxi hóa – khử
\(\begin{array}{l}CuFe{S_2} \to C{u^{2 + }} + F{e^{3 + }} + 2{S^{ + 6}} + 17e\\{H^{ + 5}} + 1e \to {N^{ + 4}}\end{array}\)
Bảo toàn e => Biểu thức liên hệ giữa x và y là y = 17x
Đáp án A
Tính biến thiên enthalpy chuẩn của phản ứng:
C3H6(g) + H2(g) \( \to \) C3H8(g)
Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau

-
A.
126 (kJ)
-
B.
-134 (kJ)
-
C.
-156 (kJ)
-
D.
-126 (kJ)
Đáp án : B
Dựa vào lý thuyết về năng lượng hóa học
\({\Delta _r}H_{298}^o = 6{E_{C - H}} + {E_{C - C}} + {E_{C = C}} + {E_{H - H}} - 8{{\rm{E}}_{C - H}} - 2{{\rm{E}}_{C - C}} = 134kJ\)
Đáp án B
Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
\(S{O_2}(g) + \frac{1}{2}{O_2}(g) \to S{O_3}(l)\) \({\Delta _r}H_{298}^o = - 144,2kJ\)
Biết \({\Delta _f}H_{298}^0(S{O_3}(g)) = - 441,0kJ/mol\). Nhiệt tạo thành chuẩn của SO2 là
-
A.
-441,0 kJ/mol
-
B.
-144,2 kJ/mol
-
C.
-296,8 kJ/mol
-
D.
-167,2 kJ/mol
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(S{O_3}) - {\Delta _f}H_{298}^o(S{O_2}) - \frac{1}{2}{\Delta _f}H_{298}^o({O_2}) = 144,2\\ \Rightarrow {\Delta _f}H_{298}^o(S{O_2}) = - 441,0 + 144,2 = - 296,8kJ/mol\end{array}\)
Đáp án C
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) \( \to \) 2NO(g) \({\Delta _r}H_{298}^o = 180kJ\)
Kết luận nào sau đây đúng?
-
A.
Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
-
B.
Phản ứng tỏa nhiệt
-
C.
Phản ứng xảy ra thuận lợi hơn ở điều kiện thường
-
D.
Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đáp án : D
Dựa vào lý thuyết về năng lượng hóa học
A sai, vì nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ cao
B sai, vì phản ứng thu nhiệt
C sai, vì phản ứng xảy ra thuận lợi hơn ở nhiệt độ cao
D đúng.
Đáp án D
Cho các phản ứng dưới đây:
(1) CO(g) + ½ (O2) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283kJ\)
(2) C(s) + H2O(g) \( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^o = + 131,25kJ\)
(3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\)
(4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\)
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
Phản ứng xảy ra thuận lợi nhất là phản ứng (3)
Đáp án C
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,…) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hư hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25oC, phản ứng giữa 1 mol sulfur với oxygen xảy ra theo phương trình: S(s) + O2(g) \( \to \) SO2(g) và tỏa ra một lượng nhiệt là 296,8 kJ. Cho các phát biểu sau:
(a) 28,8 gam sulfuric cháy hoàn toàn tỏa ra một lượng nhiệt là 267120 J
(b) Biến thiên enthalpy chuẩn của phản ứng là – 296,8 kJ
(c) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,8 kJ/mol
(d) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia. Biết trong hợp chất, sulfur có các số oxi hóa thường gặp là -2, +4, +6
(e) 0,6 mol sulfur tác dụng hết với oxygen giải phóng 178,08 kJ năng lượng dưới dạng nhiệt
Số phát biết đúng là
-
A.
3
-
B.
4
-
C.
5
-
D.
2
Đáp án : B
Biến thiên enthalpy của phản ứng
n S = 28,8 : 32 = 0,9 mol\( \to \) Nhiệt tỏa ra = 0,9 . 296,8 = 267,12 kJ = 167 120 J \( \to \) (a) đúng.
Tỏa ra một lượng nhiệt 296,8 kJ \( \to \) \(\Delta rH_{298}^o = 296,8kJ \to (b)\)đúng
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(S{O_2}) = - 296,8kJ\)\( \to \) (c) đúng
(d) đúng
0,6 mol sulfur tác dụng hết với oxygen giải phóng: 0,6.296,8 = 178,08 kJ \( \to \) (e) sai
\( \to \) Có 4 phát biểu đúng
Trong phòng thí nghiệm, hydrochloric acid đặc có thể dùng để điều chế khí chlorine theo hai phản ứng:
16HCl(aq) + 2KMnO4(s) \( \to \) 2 MnCl2 (aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
4HCl(aq) + MnO2(s) \( \to \) MnCl2(aq) + 2H2O (l) + Cl2(g) (2)
Cho bảng giá trị enthalpy tạo thành chuẩn (kJ/mol) của các chất như dưới đây:

Biến thiên enthalpy chuẩn của phản ứng (1) là
-
A.
118 kJ
-
B.
198 kJ
-
C.
122 kJ
-
D.
176 kJ
Đáp án : A
Dựa vào cách tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
\({\Delta _r}H_{298}^o = 8.( - 285) + 2.( - 419) + 2.( - 555) - 2.( - 837) - 16.( - 167) = 118kJ\)
Đáp án A
Số oxi hóa của các nguyên tử trong đơn chất bằng
Phát biểu nào sau đây là đúng?
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất):
Trong phản ứng oxi hóa – khử, chất nhường electron được gọi là:
Cho dãy gồm các phân tử và ion: Zn, S, FeO, SO2, Fe2+, Cu2+, HCl.
. Số oxi hóa của N trong NH3, HNO2, NO3- lần lượt là:
Số oxi hóa của S trong SO2 và SO42- lần lượt là:
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận