30 bài tập lý thuyết về phản ứng OXH - Khử có lời giải (phần 2)
Làm đề thiCâu hỏi 1 :
Trong sơ đồ phản ứng: \(M + NO_3^ - + {H^ + } \to {M^{n + }} + NO + {H_2}O\) chất oxi hóa là:
- A M
- B \(NO_3^ - \)
- C \({H^ + }\)
- D \({M^{n + }}\)
Đáp án: B
Phương pháp giải:
Ghi nhớ:
+ chất khử là chất nhường e, số oxi hóa tăng sau phản ứng
+ chất oxi hóa là chất nhận e, số oxi hóa giảm sau phản ứng
Lời giải chi tiết:
Các quá trình cho – nhận e:
\({M^0} + ne \to {M^{ + n}}\)
\({N^{ + 5}} + 3e \to {N^{ + 2}}(NO)\)
Chất đóng vai trò là chất oxi hóa là \({N^{ + 5}}\) (\(NO_3^ - \))
Đáp án B
Câu hỏi 2 :
Trong phản ứng \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\) , vai trò của HCl là:
- A oxi hóa
- B khử
- C Tạo môi trường
- D Vừa là chất khử, vừa tạo môi trường
Đáp án: D
Phương pháp giải:
Ghi nhớ:
+ chất khử là chất nhường e, số oxi hóa tăng sau phản ứng
+ chất oxi hóa là chất nhận e, số oxi hóa giảm sau phản ứng
+ chất tham gia vào phản ứng oxi hóa khử nhưng không thay đổi số oxi hóa được gọi là môi trường.
Lời giải chi tiết:
Các quá trình cho – nhận e:
\(M{n^{ + 4}} + 2e \to M{n^{ + 2}}\)
\(2C{l^{ - 1}} \to C{l_2} + 2e\)
Vậy HCl vừa là chất tạo môi trường (môi trường axit), vừa là chất khử.
Đáp án D
Câu hỏi 3 :
Cho phương trình hóa học: 6KI + 2KMnO4 + 4H2O → 3I2 + 2MnO2 + 8KOH
Trong phản ứng, chất bị oxi hóa là:
- A KI
- B \(KMn{O_4}\)
- C \({H_2}O\)
- D \({I^ - }\)
Đáp án: A
Phương pháp giải:
chất khử là chất cho electron, là chất bị oxi hóa
Chất oxi hóa là chất nhận electron, là chất bị khử
Lời giải chi tiết:
Phương trình phản ứng (có kèm theo số oxi hóa của các nguyên tố)
\(6\mathop K\limits^{ + 1} \mathop I\limits^{ - 1} + 2\mathop K\limits^{ + 1} \mathop {Mn}\limits^{ + 7} {\mathop O\limits^{ - 2} _4} + 4{\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \to 3{\mathop I\limits^0 _2} + 2\mathop {Mn}\limits^{ + 4} {\mathop O\limits^{ - 2} _2} + 8\mathop K\limits^{ + 1} \mathop O\limits^{ - 2} \mathop H\limits^{ + 1} \)
Chất bị oxi hóa là chất khử sẽ có số oxi hóa tăng sau khi phản ứng
Như vậy chất bị oxi trong phản ứng hóa học trên là KI
Đáp án A
Câu hỏi 4 :
Cho phản ứng \(F{e^{2 + }} + MnO_4^ - + {H^ + } \to F{e^{3 + }} + M{n^{2 + }} + {H_2}O\) sau khi cân bằng, tổng hệ số (có tỉ lệ nguyên và tối giản nhất) là:
- A 22
- B 24
- C 18
- D 16
Đáp án: B
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
- Bước 1: Xác định số oxi hóa của các ion (nguyên tố thay đổi số oxi hóa trong pthh)
\(F{e^{2 + }} + \mathop {Mn}\limits^{ + 7} O_4^ - + {H^ + } \to F{e^{3 + }} + M{n^{2 + }} + {H_2}O\)
- Bước 2: Các quá trình cho – nhận e
\(\left| \matrix{ F{e^{ + 2}} \to F{e^{ + 3}} + 1e \hfill \cr {M^{ + 7}} + 5e \to M{n^{ + 2}} \hfill \cr} \right.\)
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
![]()
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng.
\(5F{e^{2 + }} + MnO_4^ - + 8{H^ + } \to 5F{e^{3 + }} + M{n^{2 + }} + 4{H_2}O\)
Tổng hệ số cân bằng là: 24
Đáp án C
Câu hỏi 5 :
Hệ số cân bằng của \(C{u_2}S\) và \(HN{O_3}\) trong phản ứng \(C{u_2}S + HN{O_3} \to Cu{(N{O_3})_2} + {H_2}S{O_4} + NO + {H_2}O\) là:
- A 3 và 22
- B 3 và 18
- C 3 và 10
- D 3 và 12
Đáp án: A
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
Sơ đồ phản ứng \(\overbrace {C{u_2}S}^0 + H\mathop {{\text{ }}N}\limits^{ + 5} {O_3} \to \mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + {H_2}\mathop {{\text{ }}S}\limits^{ + 6} {O_4} + \mathop {{\text{ }}N}\limits^{ + 2} O + {H_2}O\)
Các quá trình oxi hóa – khử
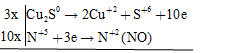
\(3C{u_2}S + 22HN{O_3} \to 6Cu{(N{O_3})_2} + 3{H_2}S{O_4} + 10NO + 8{H_2}O\)
Hệ số cân bằng của \(C{u_2}S\) và \(HN{O_3}\) lần lượt là 3 và 22
Đáp án A
Câu hỏi 6 :
Cho phương trình hoá học: FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O. Khi cân bằng với hệ số nguyên tối giản thì hệ số của KHSO4 là
- A 18
- B 8
- C 16
- D 9
Đáp án: C
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Các quá trình cho – nhận e
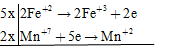
đặt hệ số của KHSO4 = a; K2SO4 = b => nH2O = a/2 (BTNT "H")
10FeSO4 + 2KMnO4 + aKHSO4 → 5Fe2(SO4)3 + 2MnSO4 +bK2SO4 + a/2H2O
Ta có:
=> 10FeSO4 + 2KMnO4 + 16KHSO4 → 5Fe2(SO4)3 + 2MnSO4 +9K2SO4 + 8H2O
=> hệ số tối giản của KHSO4 là 16
Đáp án C
Câu hỏi 7 :
Cho phương trình phản ứng: \(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\) . Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3:2, hãy xác định tỉ lệ mol nAl : nN2O : nN2 trong các kết quả sau
- A 44 : 6 : 9
- B 46 : 9 : 6
- C 46 : 6 : 9
- D 44 : 9 : 6
Đáp án: D
Phương pháp giải:
Phương pháp cân bằng phương trình phản ứng bằng phương pháp thăng bằng e
Nguyên tắc: Dựa vào định luật bảo toàn e, số e mà chất khử nhường bằng số e chất oxi hóa nhận.
cân bằng theo 4 bước
- Bước 1: Xác định số oxi hóa của các nguyên tố có số oxi hóa thay đổi
- Bước 2: Viết các quá trình oxi hóa, quá trình khử.
- Bước 3: Nhân các hệ số thích hợp để cân bằng số e cho – nhận
- Bước 4: Đặt hệ số chất oxi hóa, chất khử vào sơ đồ phản ứng. Cân bằng các nguyên tố theo thứ tự:
Kim loại (cation) – gốc axit (anion) – môi trường (axit, bazơ) – cân bằng số nguyên từ H – cân bằng số nguyên tử hiđro.)
Lời giải chi tiết:
\(Al + HN{O_3} \to Al{(N{O_3})_3} + {N_2} + {N_2}O + {H_2}O\)
Các quá trình cho – nhận e
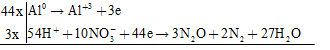
\(44Al + 162HN{O_3} \to 44Al{(N{O_3})_3} + 6{N_2} + 9{N_2}O + 81{H_2}O\)
\( \Rightarrow {n_{Al}}:{n_{{N_2}O}}:{n_{{N_2}}} = 44:9:6\)
Đáp án D
Câu hỏi 8 :
Phản ứng oxi hóa khử là phản ứng xảy ra theo chiều tạo thành
- A Chất oxi hóa yếu hơn so với ban đầu
- B Chất khử yếu hơn so với chất đầu
- C Chất oxi hóa (hoặc khử) mới yếu hơn
- D Chất oxi hóa (mới) và chất khử (mới) yếu hơn
Đáp án: D
Lời giải chi tiết:
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất (thay đổi số oxi hóa của một số nguyên tố); phản ứng oxi hóa – khử xảy ra theo chiều tạo ra chất oxi hóa (chất khử) mới hơn tính oxi hóa (tính khử) của chất ban đầu
Đáp án D
Câu hỏi 9 :
Nguyên tử sắt chuyển thành ion \(F{e^{3 + }}\) bằng cách
- A Nhận 3 electron
- B Nhận 3 proton
- C Nhường 3 electron
- D Nhường 3 proton
Đáp án: C
Lời giải chi tiết:
Từ nguyên tử sắt (số oxi hóa là 0) chuyển thành ion \(F{e^{3 + }}\) (có số oxi hóa là +3) số oxi hóa tăng
=> đã xảy ra quá trình oxi hóa: \(Fe \to F{e^{3 + }} + 3e\)
Đáp án C
Câu hỏi 10 :
Cho phản ứng sau:
\(KMn{O_4} + FeS{O_4} + {H_2}S{O_4} \to {K_2}S{O_4} + MnS{O_4} + F{e_2}{(S{O_4})_3} + {H_2}O\)
Trong phản ứng trên, số nguyên tố có sự thay đổi số oxi hóa là:
- A 2
- B 3
- C 1
- D Không có nguyên tố nào
Đáp án: A
Phương pháp giải:
Xác định số oxi hóa của các nguyên tố trước và sau phản ứng => nguyên tố nào có sự thay đổi
Lời giải chi tiết:
\(\mathop K\limits^{ + 1} \mathop {Mn}\limits^{ + 7} {\mathop O\limits^{ - 2} _4} + \mathop {Fe}\limits^{ + 2} \mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + {\mathop H\limits^{ + 1} _2}\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} \to {\mathop K\limits^{ + 1} _2}\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + \mathop {Mn}\limits^{ + 2} \mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + {\mathop {Fe}\limits^{ + 3} _2}{(\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4})_3} + {\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \)
Nhận thấy các nguyên tố thay đổi số oxi hóa là Mn và Fe
Đáp án A
Câu hỏi 11 :
Cho phản ứng sau:\(Zn + {H_2}S{O_4} \to ZnS{O_4} + {H_2}\) . Trong phản ứng trên kẽm đã:
- A bị oxi hóa
- B bị oxi hóa và bị khử
- C bị khử
- D không bị oxi hóa và không bị khử
Đáp án: A
Phương pháp giải:
Xác định số oxi hóa của Zn trước và sau phản ứng
Nếu tăng sau phản ứng thì Zn là chất khử và Zn bị oxi hóa
Nếu giảm sau phản ứng thì Zn là chất oxi hóa và Zn bị khử
Lời giải chi tiết:
Trước phản ứng Zn có số oxi hóa là 0, sau phản ứng Zn có số oxi hóa là +2
\(Z{n^0} \to Z{n^{ + 2}} + 2e\) (quá trình oxi hóa hay là bị oxi hóa)
Đáp án A
Câu hỏi 12 :
Cho phản ứng:\(N{O_2} + NaOH \to NaN{O_3} + NaN{O_2} + {H_2}O\) . Trong phản ứng trên, nhận xét nào sau đây đúng?
- A \(N{O_2}\) là chất oxi hóa
- B \(N{O_2}\) vừa là chất oxi hóa, vừa là chất khử
- C NaOH là chất oxi hóa
- D NaOH là chất khử.
Đáp án: B
Phương pháp giải:
Xác định số oxi hóa của NO2; NaOH trước và sau phản ứng
Chất khử là chất nhường e, có số oxi hóa tăng sau phản ứng
Chất oxi hóa là chất nhận e, có số oxi hóa giảm sau phản ứng.
Lời giải chi tiết:
\(\eqalign{ & \mathop N\limits^{ + 4} {O_2} + NaOH \to Na\mathop N\limits^{ + 5} {O_3} + Na\mathop N\limits^{ + 3} {O_2} + {H_2}O \cr & \mathop N\limits^{ + 4} + 1e \to \mathop N\limits^{ + 3} \cr & \mathop N\limits^{ + 4} \to \mathop N\limits^{ + 5} + 1e \cr} \)
\(N{O_2}\) vừa có nhường 1e và vừa nhận 1 e
=> \(N{O_2}\) vừa là chất oxi hóa, vừa là chất khử
Đáp án B
Câu hỏi 13 :
Dãy chất nào sau đây gồm các chất chỉ có tính oxi hóa?
- A \(C{l_2},{H_2}{O_2},HN{O_3},{H_2}S{O_4}\)
- B \(S{O_2},S{O_3},B{r_2},{H_2}S{O_4}\)
- C \(Fe{(N{O_3})_3},CuO,HCl,HN{O_3}\)
- D \({O_3},F{e_2}{O_3},{H_2}S{O_4},{F_2}\)
Đáp án: D
Phương pháp giải:
Chất chỉ có tính oxi hóa (khả năng nhận e) là chất mà ở đó có các nguyên tố có oxi hóa ở mức cao nhất mà nguyên tố đó có thể có
Lời giải chi tiết:
Đáp án D
Câu hỏi 14 :
Trong phản ứng: \(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2NO + 4{H_2}O\). Số phân tử đóng vai trò là chất oxi hóa là:
- A 8
- B 6
- C 4
- D 2
Đáp án: D
Phương pháp giải:
HNO3 đóng vai trò là chất oxi hóa trong quá trình tạo ra NO.
Lời giải chi tiết:
HNO3 đóng vai trò là chất oxi hóa trong quá trình tạo ra NO.
Trong phản ứng hóa học trên ta có: 8 phân tử HNO3 thì có 6 phân tử tham gia tạo muối Cu(NO3)2 và 2 phân tử tham gia vào quá trình khử tạo thành NO
Đáp án D
Câu hỏi 15 :
Cho phản ứng hóa học sau:\(X + HN{O_3} \to Fe{(N{O_3})_3} + NO + {H_2}O\) . Số chất X thỏa mãn sơ đồ trên là:
- A 2
- B 3
- C 4
- D 5
Đáp án: C
Phương pháp giải:
Chọn Fe và các hợp chất của sắt có số oxi hóa trung gian
Lời giải chi tiết:
Phương trình hóa học: \(X + HN{O_3} \to Fe{(N{O_3})_3} + NO + {H_2}O\)
Dựa vào phương trình hóa học trên
-Sản phẩm có muối sắt (III) X phải là hợp chất chứa Fe
- Sản phẩm chỉ gồm muối nitrat và NO là sản phẩm khử duy nhất của HNO3 nên X chỉ có thể là sắt, oxit sắt hoặc muối nitrat của sắt và có thể tham gia vào quá trình oxi hóa (do N+5 tham gia quá trình khử
N+5 + 3e → N+2 (NO) để khử N+5 thành NO
X có thể là: \(Fe,FeO,F{e_3}{O_4},Fe{(N{O_3})_2}\)
Đáp án C
Câu hỏi 16 :
Cho các phản ứng sau:
a) FeO + HNO3 đặc, nóng → b) FeS + H2SO4 đặc, nóng →
c) Al2O3 + HNO3 đặc, nóng → d) Cu + dung dịch FeCl3 →
Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hóa – khử là:
- A a, b, c
- B a, d
- C a, c, d
- D a, b, d
Đáp án: D
Lời giải chi tiết:
Phản ứng oxi hóa – khử là phản ứng ở đó có sự thay đổi số oxi hóa của một hoặc một số nguyên tố
Phương trình phản ứng của các phản ứng trên:
\(a)\mathop {Fe}\limits^{ + 2} \mathop O\limits^{ - 2} + \mathop H\limits^{ + 1} \mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3} \to \mathop {Fe}\limits^{ + 3} {(\mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3})_3} + \mathop N\limits^{ + 2} \mathop O\limits^{ - 2} + {\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \): Có Fe và N thay đổi số oxi hóa
\(b)\mathop {Fe}\limits^{ + 2} \mathop S\limits^{ - 2} + {\mathop H\limits^{ + 1} _2}\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} \to {\mathop {Fe}\limits^{ + 3} _2}{(\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4})_3} + \mathop S\limits^{ + 4} {\mathop O\limits^{ - 2} _2} + {\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \): Có Fe, S thay đổi số oxi hóa
\(c){\mathop {Al}\limits^{ + 3} _2}{\mathop O\limits^{ - 2} _3} + \mathop H\limits^{ + 1} \mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3} \to \mathop {Al}\limits^{ + 3} {(\mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _3})_3} + {\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \): không có sự thay đổi số oxi hóa
d) \(\mathop {Cu}\limits^0 + \mathop {Fe}\limits^{ + 3} {\mathop {Cl}\limits^{ - 1} _3} \to \mathop {Cu}\limits^{ + 2} {\mathop {Cl}\limits^{ - 1} _2} + \mathop {Fe}\limits^{ + 2} {\mathop {Cl}\limits^{ - 1} _2}\):Có sự thay đổi số oxi hóa của Fe, Cu
Có 3 phản ứng là phản ứng oxi hóa – khử: a, b, d
Đáp án D
Câu hỏi 17 :
Tổng hệ số của các chất ( là những số nguyên, tối giản ) trong phương trình phản ứng là:
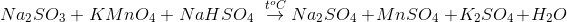
- A 23
- B 27
- C 47
- D 31
Đáp án: B
Phương pháp giải:
cân bằng theo thăng bằng e
Lời giải chi tiết:
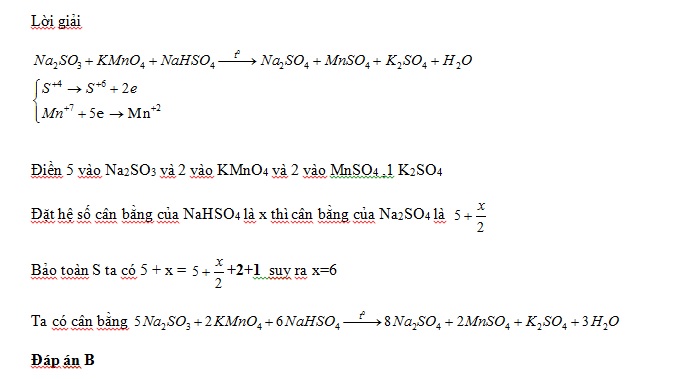
Câu hỏi 18 :
Tỉ lệ số phân tử HNO3 là chất oxi hóa và số phân tử HNO3 là môi trường trong phản ứng :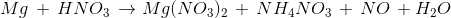
( tỉ lệ NH4NO3 : NO = 1: 1)
- A 1: 6
- B 6:1
- C 1:8
- D 8:1
Đáp án: A
Phương pháp giải:
Phương pháp ; thăng bằng e
Lời giải chi tiết:
Lời giải :
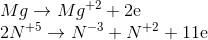
Ta có
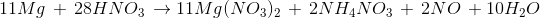
Tỉ lệ số phân tử HNO3 là chất oxi hóa và số phân tử HNO3 là môi trường là 4:24=1:6
Đáp án A
Câu hỏi 19 :
Trong phản ứng : Fe + CuSO4 → FeSO4 + Cu.
1 mol ion Cu2+ đã
- A nhường 1 mol electron.
- B nhận 1 mol electron
- C nhận 2 mol electron
- D nhường 2 mol electron
Đáp án: C
Lời giải chi tiết:
Cu+2 + 2e →Cu
Vậy 1 mol Cu+2 nhận 2 mol e
Đáp án C
Câu hỏi 20 :
Cho các chất và ion sau: Mg, Cl2, Fe2O3, Fe3O4, NO2, H2S, Fe2+, Ag+. Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
- A 3
- B 6
- C 5
- D 4
Đáp án: D
Lời giải chi tiết:
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa có số oxh không phải là số thấp nhất hoặc lớn nhất
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, Fe3O4, NO2, Fe2+
Đáp án D
Câu hỏi 21 :
Trong các ion (phân tử) cho dưới đây, ion (phân tử) có tính oxi hóa là:
- A Mg
- B Cl-
- C Cu2+
- D S2-
Đáp án: C
Lời giải chi tiết:
Chất và ion đóng vai trò chất oxi hóa có số oxh không phải là số thấp nhất
Mg, Cl−, S2− có số oxh thấp nhất
Đáp án C
Câu hỏi 22 :
Trong các phản ứng dưới đây, phản ứng nào không là phản ứng oxi hóa – khử
- A
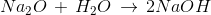
- B
![2S{O_2}\, + \,{O_2} \xrightarrow[V_{2}O_{5}]{t^{o}C},\,2S{O_3}](https://images.tuyensinh247.com/picture/learning/exam/2017/1114/214792_829303_1.gif)
- C
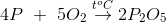
- D
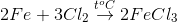
Đáp án: A
Lời giải chi tiết:
Các pư thay đổi số oxh cũng là phản ứng oxh là B, C, D
Pư không thay đỏi số oxh là A
Đáp án A
Câu hỏi 23 :
Trong phản ứng : Mg + HNO3 → Mg(NO3)2 + NO + H2O
HNO3 đóng vai trò là:
- A Chất oxi hóa
- B Chất khử
- C Môi trường
- D chất oxi hóa đồng thời đóng vai trò môi trường tạo muối
Đáp án: D
Lời giải chi tiết:
HNO3 đóng vai trò là chất oxi hóa đồng thời đóng vai trò môi trường tạo muối
Đáp án D
Câu hỏi 24 :
Trong phản ứng : Fe + HNO3 → Fe(NO3)3 + NO2 + H2O
1 mol HNO3 đã:
- A nhường 1 mol electron.
- B nhận 1 mol electron
- C nhận 3 mol electron
- D nhường 3 mol electron
Đáp án: B
Lời giải chi tiết:
N+5 + 1e → N+4nên 1 mol HNO3 đã nhận 1 mol electron
Đáp án B
Câu hỏi 25 :
Cho các chất và ion sau: Zn, HCl, FeO, Fe3O4, NO2, H2S, Fe2+, Ag+. Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
- A 3
- B 6
- C 5
- D 4
Đáp án: C
Lời giải chi tiết:
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa có số oxh không phải là số thấp nhất hoặc lớn nhất
Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là HCl, FeO, Fe3O4, NO2, Fe2+
Đáp án C
Câu hỏi 26 :
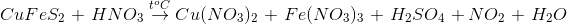
Tổng hệ số của các chất ( là những số nguyên, tối giản ) bên sản phẩm tạo thành là:
- A 23
- B 53
- C 32
- D 30
Đáp án: D
Phương pháp giải:
Phương pháp : thăng bằng e
Lời giải chi tiết:
Lời giải
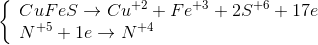
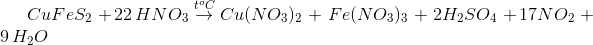
Đáp án D
Câu hỏi 27 :
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
- A 2HgO → 2Hg + O2.
- B CaCO3 → CaO + CO2.
- C 2Al(OH)3 → Al2O3 + 3H2O.
- D 2NaHCO3 → Na2CO3 + CO2 + H2O.
Đáp án: A
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Chỉ có phản ứng 2HgO → 2Hg + O2 có sự thay đổi số oxi hóa
Đáp án A
Câu hỏi 28 :
Cân bằng các phản ứng oxi hóa - khử sau theo phương pháp thăng bằng electron. Xác định chất khử, chất oxi hóa.
a. Al + HNO3 → Al(NO3)3 + N2O + H2O
b. NH3 + O2 → N2 + H2O
Phương pháp giải:
*Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron.
*Cách xác định chất khử, chất oxi hóa:
- Chất nhường e là chất khử (chất bị oxi hóa)
- Chất nhận e là chất oxi hóa (chất bị khử)
Lời giải chi tiết:
a.
\(\begin{array}{*{20}{c}}{\mathop {8{\rm{x}}}\limits^{} }\\{\mathop {3{\rm{x}}}\limits^{} }\end{array}\left| \begin{array}{l}\mathop {Al}\limits^0 - 3e \to \;\mathop {Al}\limits^{ + 3} \\2\mathop N\limits^{ + 5} + 8e \to {\mathop N\limits^{ + 1} _2}O\end{array} \right.\)
→ PTHH: 8Al + 30 HNO3 \(\xrightarrow{{{t^o}}}\) 8Al(NO3)3 + 3N2O + 15H2O
Chất khử: Al
Chất oxi hóa: HNO3
b.
\(\begin{array}{*{20}{c}}{\mathop {2{\rm{x}}}\limits^{} }\\{\mathop {3{\rm{x}}}\limits^{} }\end{array}\left| \begin{array}{l}2\mathop N\limits^{ - 3} -6e \to {\mathop N\limits^0 _2}\\{\mathop O\limits^0 _2} + 4e \to 2\mathop O\limits^{ - 2} \end{array} \right.\)
→ PTHH: 4NH3 + 3O2 \(\xrightarrow{{{t^o}}}\) 2N2 + 6H2O
Chất khử: NH3
Chất oxi hóa: O2
Câu hỏi 29 :
Trong phản ứng: 4NH3 + 3O2 -> 2N2 + 6H2O. Vai trò của NH3 là
- A chất khử
- B chất khử, đồng thời là chất oxi hóa
- C chất oxi hóa
- D chất cho và nhận electron.
Đáp án: A
Phương pháp giải:
Xác định số oxi hóa của N trước và sau phản ứng từ đó suy ra vai trò của NH3 trong phản ứng.
Lời giải chi tiết:
\(4\mathop N\limits^{ - 3} {H_3} + {\rm{ }}3{O_2} \to 2{\mathop N\limits^0 _2} + {\rm{ }}6{H_2}O\)
=>\(2\mathop N\limits^{ - 3} - 6e \to {\mathop N\limits^0 _2}\)
NH3 nhường e => NH3 là chất khử
Đáp án A
Câu hỏi 30 :
Quá trình nào sau đây là đúng
- A \(\;\mathop {Al}\limits^0 + 3e\; \to \mathop {Al}\limits^{ + 3} \)
- B \(\;\mathop {Mn}\limits^{ + 7} + 4e\; \to \mathop {Mn}\limits^{ + 4} \)
- C \(\;\mathop S\limits^{ - 2} \; \to \mathop S\limits^0 + 2e\)
- D \(\;\mathop {Mn}\limits^{ + 4} + 3e\; \to \mathop {Mn}\limits^{ + 7} \)
Đáp án: C
Lời giải chi tiết:
Quá trình đúng là: \(\;\mathop S\limits^{ - 2} \; \to \mathop S\limits^0 + 2e\)
Đáp án C
30 bài tập lý thuyết về phản ứng OXH - Khử có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
Tổng hợp 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao đầy đủ các dạng từ dễ đến khó có đáp án và lời giải chi tiết
30 bài tập lý thuyết về phản ứng OXH Khử có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 1) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 2) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
20 bài tập vận dụng về phản ứng OXH - Khử (phần 1) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
20 bài tập vận dụng về phản ứng OXH - Khử (phần 2) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









