20 bài tập vận dụng về phản ứng OXH - Khử có lời giải (phần 2)
Làm đề thiCâu hỏi 1 :
Nung 11,2 gam Fe trong không khí, sau một thời gian thu được m gam hỗn hợp rắn X gồm: Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch A chỉ chứa muối Fe(NO)3 và 2,24 lít NO (đktc). Giá trị của m là:
- A 13,6 gam.
- B 11,2 gam.
- C 14,4 gam.
- D 12,4 gam.
Đáp án: A
Phương pháp giải:
Quy đổi hh X gồm Fe và O2. Đặt ẩn là số mol của O2.
Viết các quá trình cho và nhận e:
Fe → Fe+3 + 3e
O2 + 4e→ O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn e tính được số mol của O2.
=> m = mFe + mO2 = ?
Lời giải chi tiết:
Quy đổi hh X gồm Fe và O2
nFe = 0,2mol; nNO= 0,1mol
Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 3e → N+2
0,2 → 0,6 mol x→ 4xmol 0,3 ←0,1
Áp dụng định luật bảo toàn e ta có: 0,6 = 4x + 0,3 => x = 0,075mol
=> m = mFe + mO2 = 11,2 + 0,075 . 32 = 13,6g
Đáp án A
Câu hỏi 2 :
Nung 5,6 gam Fe trong không khí, sau một thời gian thu được 6,8 gam hỗn hợp X gồm: Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn hỗn hợp X băng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch A chỉ chứa muối Fe(NO3)3 và V lít khí NO (đktc). Giá trị của V là:
- A 0,56 lít.
- B 1,12 lít.
- C 1,56 lít.
- D 2,24 lít.
Đáp án: B
Phương pháp giải:
Quy đổi hh X gồm Fe và O2
mO = mX – mFe = ? => nO => nO2
Viết các quá trình cho và nhận e:
Fe → Fe+3 + 3e
O2 + 4e→ O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn e tính được số mol NO.
=> VNO = 0,05 . 22,4 = 1,12 lít
Lời giải chi tiết:
Quy đổi hh X gồm Fe và O2
nFe = 0,1mol
mO = mX – mFe = 6,8 – 5,6 = 1,2g
=> nO = 0,075 mol => nO2 = 0,0375 mol
Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 3e → N+2
0,1 → 0,3 mol 0,0375→ 0,15mol 3x ←x
Áp dụng định luật bảo toàn e ta có: 0,3 = 0,15 + 3x => x = 0,05mol
=> VNO = 0,05 . 22,4 = 1,12 lít
Đáp án B
Câu hỏi 3 :
Hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn 13,6 gam hỗn hợp X bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch A chỉ chứa muối Fe(NO3)3 và 2,24 lít NO (đktc). Khối lượng muối Fe(NO3)3 thu được là:
- A 48,4 gam.
- B 72,6 gam.
- C 96,8 gam.
- D 121 gam.
Đáp án: A
Phương pháp giải:
Quy đổi hh X gồm Fe và O2 có số mol lần lượt là x và y
- Từ khối lượng hỗn hợp X => (1)
- Viết các quá trình cho và nhận e. Áp dụng định luật bảo toàn e => (2)
Giải (1) và (2) thu được x và y
BTNT “Fe”: nFe(NO3)3 = nFe = ?
Lời giải chi tiết:
Quy đổi hh X gồm Fe và O2 có số mol lần lượt là x và y
Ta có mX = mFe + mO2 = 56x + 32y = 13,6 (1)
nO = 0,1 mol
Fe → Fe+3 + 3e O2 + 4e → 2O-2 N+5 + 3e → N+2
x → 3x mol y → 4y mol 0,3 ← 0,1
Áp dụng định luật bảo toàn e ta có: 3x = 4y + 0,3=> 3x – 4y = 0,3 (2)
Giải hệ (1) và (2) ta có x = 0,2mol và y = 0,075 mol
nFe(NO3)3 = nFe = 0,2 mol
=> m Fe(NO3)3 = 0,2 . 242 = 48,4g
Đáp án A
Câu hỏi 4 :
Hoà tan hoàn toàn 1,08 gam Al bằng dung dịch HNO3 dư, sản phẩm ứng thu được 0,336 lít khí X (sản phẩm khử duy nhất ở đktc). Công thức phân tử của X là
- A
NO.
- B N2O.
- C N2.
- D NO2
Đáp án: B
Phương pháp giải:
Từ số mol Al tính được số mol e nhường. Áp dụng định luật bảo toàn e ta có: ne nhận = ne cho
Ta đã có số mol sản phẩm khí => số e mà 1 mol sản phẩm khí nhận => công thức khí
Lời giải chi tiết:
nAl = 0,04 mol
Al0 → Al+3 + 3e
ne cho = 3.nAl = 0,12 mol
Áp dụng định luật bảo toàn e => ne nhận = ne cho = 0,12 mol
Mà nX = 0,015 mol => 1 mol X nhận số mol e là: 0,12 : 0,015 = 8 mol
=> X là N2O
Đáp án B
Câu hỏi 5 :
Cho m gam bột Fe vào dụng dịch HNO3 lấy dư, ta được hỗn hợp X gồm hai khí NO2 và NO có VX = 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần % NO và % NO2 theo thể tích trong hỗn hợp X và khối lượng m của Fe đã dùng lần lượt là
- A 25% và 75%; 1,12 gam.
- B 25% và 75%; 11,2 gam.
- C 35% và 65%; 11,2 gam.
- D 45% và 55%; 1,12 gam.
Đáp án: B
Phương pháp giải:
Dựa vào số mol và tỉ khối của hỗn hợp khí ta tính được số mol từng khí.
Viết các quá trình cho và nhận e, áp dụng định luật bảo toàn e tính được số mol của Fe.
Lời giải chi tiết:
Gọi số mol NO2 và NO lần lượt là x, y
Ta có hệ phương trình:
x + y = 0,4
46x + 30y = 0,4.(1,3125.32)
=> x = 0,3 và y = 0,1
(có thể dùng phương pháp đường chéo để tìm số mol các chất)
%VNO2 = 75% ; %VNO = 25%
N+5 + 1e → N+4 (NO2)
0,3 ← 0,3
N+5 + 3e → N+2 (NO)
0,3 ← 0,1
Fe0 → Fe+3 + 3e
0,2 ← 0,6
=> mFe = 0,2.56 = 11,2 gam
Đáp án B
Câu hỏi 6 :
Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol khí N2O và 0,01mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
- A 13,5 gam
- B 1,35 gam.
- C 0,81 gam.
- D 8,1 gam.
Đáp án: B
Lời giải chi tiết:

Câu hỏi 7 :
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có khối lượng là 15,2 gam. Giá trị của m là
- A 25,6
- B 16.
- C 2,56.
- D 8.
Đáp án: A
Phương pháp giải:
Đặt số mol của NO và NO2 lần lượt là x và y (mol)
- Số mol khí => (1)
- Khối lượng khí => (2)
Giải hệ tìm được x và y
Viết quá trình cho và nhận e, áp dụng định luật bảo toàn e tính được số mol Cu.
Lời giải chi tiết:
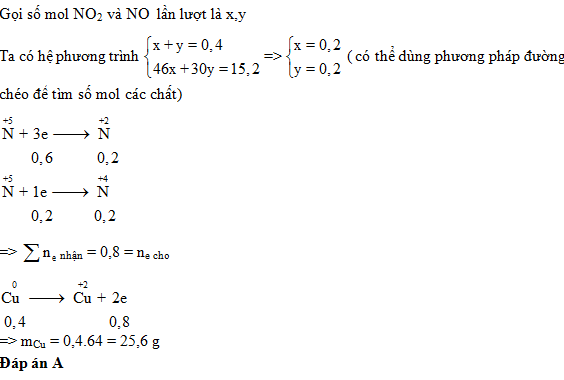
Câu hỏi 8 :
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là:
- A 0,672 lít
- B 6,72 lít
- C 0,448 lít
- D 4,48 lít
Đáp án: C
Phương pháp giải:
Sử dụng định luật bảo toàn e
Lời giải chi tiết:
\({n_{Mg}} = 0,1(mol)\)
Sơ đồ phản ứng:\(Mg + HN{O_3} \to Mg{(N{O_3})_2} + {N_2} + {H_2}O\)
Các quá trình cho – nhận e
Mg0→Mg+2 +2e 2N+5 + 10e → N2
0,1 0,2 (mol) 10x ← x (mol)
Áp dụng định luật bảo toàn e, ta có:
\(\eqalign{ & 10x = 0,2 \cr & \Leftrightarrow x = 0,02(mol) \cr & \Rightarrow {V_{{N_2}}} = 0,02 \cdot 22,4 = 0,448(l) \cr} \)
Đáp án C
Câu hỏi 9 :
Hòa tan hoàn toàn 2,43 gam kim loại M (hóa trị n) vào dung dịch H2SO4 đặc nóng thu được 3, 024 lít( đktc) khí SO2. Kim loại M là:
- A Be
- B Al
- C Mn
- D Ag
Đáp án: B
Phương pháp giải:
Phương pháp : bảo toàn e để tìm liên hệ giữa M và n. Kim loại chỉ cho hóa trị 1,2,3
Lời giải chi tiết:
Biện luận tìm M
Lời giải
Ta có M → M+n + n e
S +6 + 2 e → S+4
Số mol SO2 là 0,135 mol
Theo định luật bảo toàn e ta có 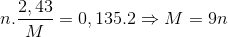
Vì n là hóa trị của kim loại nên n =1,2,3
Thỏa mãn n=3 và M =27 (Al)
Đáp án B
Câu hỏi 10 :
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng thu được V lít khí N2 ( là sản phẩm khử duy nhất). Giá trị của V là:
- A 4,48 lít
- B 2,24 lít
- C 0,448 lít
- D 0,672 lít
Đáp án: C
Phương pháp giải:
Viết các quá trình cho và nhận e:
Mg → Mg+2 + 2e
2N+5 + 10 e → N20
Áp dụng định luật bảo toàn e ta tính được số mol N2:
Lời giải chi tiết:
n Mg = 2,4: 24 = 0,1 mol
Các quá trình cho và nhận e:
Mg → Mg+2 + 2e
0,1 → 0,2 (mol)
2N+5 + 10 e → N20
0,2 → 0,02 (mol)
=> VN2 = 0,02 . 22,4 = 0,448 lít
Đáp án C
Câu hỏi 11 :
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là
- A 25,6 gam.
- B 16 gam.
- C 2,56 gam.
- D 8 gam.
Đáp án: A
Phương pháp giải:
Vận dụng định luật bảo toàn e: 2 n Cu = n NO . 3 + n NO2 . 1
Sử dụng giá trị
\(\overline M = \frac{{{m_{NO}}\;{\text{ }} + {\text{ }}{{\text{m}}_{NO2}}}}{{{n_{NO}}\; + {\text{ }}{n_{NO2}}}} = \frac{{{n_{NO}}\;.{\text{ }}30{\text{ }} + {\text{ }}{n_{NO2}}.{\text{ 46}}}}{{{n_{NO}}\;{\text{ }} + {\text{ }}{n_{NO2}}}}\)
Lời giải chi tiết:
n hh = 0,4 mol
Ta có = 19 .2 = 38 => m NO + m NO2 = 38 . 0,4 = 15,2 g
=> Hệ phương trình:
\(\left\{ \begin{gathered}
{n_{NO}}\; + {\text{ }}{n_{NO2}} = 0,4 \hfill \\
{n_{NO}}\;.{\text{ }}30{\text{ }} + {\text{ }}{n_{NO2}}.{\text{ 46}} = 15,2 \hfill \\
\end{gathered} \right\}\)
=> n NO = 0,2 và n NO2 = 0,2 mol
Vận dụng định luật bảo toàn e: 2 n Cu = n NO . 3 + n NO2 . 1
=> n Cu = (0,2 .3 + 0,2): 2 = 0,4 mol
=> m Cu = 0,4 . 64 = 25,6 g
Đáp án A
Câu hỏi 12 :
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí NO duy nhất (đktc). Giá trị của V là
- A 1,45 lít
- B 1,49 lít
- C 2,24 lít
- D 4,48 lít
Đáp án: B
Phương pháp giải:
Viết các quá trình cho và nhận e:
Mg → Mg+2 + 2 e
N+5 + 3e → N+2
Áp dụng định luật bảo toàn e => 2 nMg = nNO . 3
Lời giải chi tiết:
n Mg = 0,1 mol
Áp dụng định luật bảo toàn e: 2 n Mg = n NO . 3 => n NO = 2/3 mol
=> V NO = 2/3 . 22,4 = 1.4933 l
Đáp án B
Câu hỏi 13 :
Cho 7,2 gam FeO tan hoàn toàn vào dung dịch H2SO4 đặc thấy thoát ra V lít khí SO2 ( ở đktc). Giá trị của V là:
- A 1,12 lít
- B 2,24 lít
- C 0,112 lít
- D 3,36 lít
Đáp án: A
Phương pháp giải:
Viết các quá trình cho và nhận e:
Fe+2 → Fe+3 + 1 e
S+6 + 2e → S+4
Áp dụng định luật bảo toàn e => n FeO = n SO2 . 2
Lời giải chi tiết:
n FeO = 0,1 mol
Áp dụng định luật bảo toàn e: n FeO = n SO2 . 2 => n SO2 = 0,05 mol
=> V SO2 = 0,05 . 22,4 = 1,12 lít
Đáp án A
Câu hỏi 14 :
Hoà tan 62,1 gam kim loại M trong dung dịch HNO3 loãng thu được 16,8 lít hỗn hợp khí X (đktc) gồm 2 khí không màu không hoá nâu trong không khí. Tỉ khối hơi của X so với H2 là 17,2. Kim loại M là
- A Mg.
- B Ag.
- C Cu.
- D Al.
Đáp án: D
Phương pháp giải:
Sản phẩm khử khí không màu không hóa nâu ngoài không khí
=> Không thể là NO2 (nâu đỏ) và NO (hóa nâu ngoài không khí)
=> 2 khí là N2 và N2O
Sử dụng giá trị
\(\overline M = \frac{{{m_{{N_2}O}}\;{\text{ }} + {\text{ }}{{\text{m}}_{{N_2}}}}}{{{n_{{N_2}O}}\;{\text{ }} + {\text{ }}{{\text{n}}_{{N_2}}}}} = \frac{{{n_{{N_2}O}}\;{\text{ }}{\text{.44}} + {\text{ }}{{\text{n}}_{{N_2}}}.28}}{{{n_{{N_2}O}}\;{\text{ }} + {\text{ }}{{\text{n}}_{{N_2}}}}}\)
Vận dụng định luật bảo toàn e: nM.n = 8nN2O + 10nN2 (với n là hóa trị của kim loại là 1 ,2 hoặc 3)
Lời giải chi tiết:
n hh = 0,75 mol \(\overline M \) = 17,2 .2 = 34,4 => mN2O + mN2 = 34,4 . 0,75 = 25,8
Ta có:
nN2O + nN2 = 0,75
44nN2O + 28nN2 = 25,8
Giải hệ thu được nN2O = 0,3 mol và nN2 = 0,45 mol
Áp dụng định luật bảo toàn e => nM . n = 8 nN2O + 10 nN2 = 0,3 . 8 + 0,45 . 10 = 6,9 mol
+ n = 1 => nM = 6,9 mol => MM = 62,1: 6,9 = 9 loại
+ n = 2 => nM = 3,45 mol => MM = 62,1: 3.45 = 18 loại
+ n = 3 => nM = 2,3 mol => MM = 62,1: 2,3 = 27 (Al) chọn
Vậy kim loại cần tìm là Al
Đáp án D
Câu hỏi 15 :
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
- A 180.
- B 90.
- C 45.
- D 135.
Đáp án: B
Phương pháp giải:
HS có thể giải theo cách viết PTHH hoặc theo phương pháp bảo toàn e.
Lời giải chi tiết:
Cách 1:
\(\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,225\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,0,225\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\
10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O \hfill \\
0,225\,\,\,\,\,\,\,\,\, \to 0,045(mol) \hfill \\
\end{gathered} \)
Cách 2:
\(Fe\xrightarrow{{{H_2}S{O_4}\,loang}}\mathop {Fe}\limits^{ + 2} \xrightarrow{{KMn{O_4}}}\mathop {Fe}\limits^{ + 3} \)

=> V dd KMnO4 = 0,045 : 0,5 = 0,09 lít = 90 ml
Đáp án B
Câu hỏi 16 :
Ngâm một vật bằng đồng có khối lượng 4,24 gam vào 80 ml dung dịch AgNO3 CM. Phản ứng kết thúc lấy vật đồng ra khỏi dung dịch, rửa nhẹ, sấy khô; cân nặng 5 gam. Tính CM.
Phương pháp giải:
Tăng giảm khối lượng
Lời giải chi tiết:
m KL tăng = 5 – 4,24 = 0,76 gam
PTHH:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
PƯ: 1 2 1 2 (mol) => m KL tăng = 108.2 – 64 = 152 (g)
ĐB: 0,005 ← 0,01 ← 0,005 ← 0,01 <= m KL tăng = 0,76 (g)
=> CM dd AgNO3 = n/V = 0,01 : 0,08 = 0,125M
Câu hỏi 17 :
Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 28. Lấy 4,48 lít hỗn hợp X (đktc) cho đi qua bình đựng V2O5 nung nóng. Hỗn hợp thu được cho lội qua dung dịch Ba(OH)2 dư thấy có 33,51 gam kết tủa. Hiệu suất phản ứng oxi hóa SO2 thành SO3 là:
- A 25%
- B 40%
- C 60%
- D 75%
Đáp án: C
Phương pháp giải:
Từ MX và nX tìm được số mol SO2 và số mol O2.
Hỗn hợp khí thu được có chứa SO3, O2 và SO2.
Khi cho hỗn hợp X qua dung dịch Ba(OH)2 dư thì xảy ra các phản ứng:
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + SO3 → BaSO4 + H2O
Sau phản ứng thu được 33,51 gam kết tủa gồm BaSO3 và BaSO4. Từ đó tìm được số mol O2 phản ứng và số mol SO2 phản ứng. Từ đó tính được hiệu suất phản ứng.
Lời giải chi tiết:
Trong hỗn hợp X có nSO2 = x mol và nO2 = y mol
Ta có: nX = x + y = 0,2 mol và mX = 64x + 32y = 0,2.28.2 = 11,2 gam
Giải hệ trên ta có: x = 0,15 và y = 0,05
2SO2 + O2 → 2SO3
Ta có: nSO2/2 > nO2 nên hiệu suất phản ứng tính theo O2.
Đặt nO2 pứ = a mol
Sau phản ứng thu được SO3 (2a mol), (0,15-2a) mol SO2 và (0,05-a) mol O2.
Hỗn hợp khí thu được có chứa SO3, O2 và SO2.
Khi cho hỗn hợp X qua dung dịch Ba(OH)2 dư thì xảy ra các phản ứng:
Ba(OH)2 + SO2 → BaSO3 + H2O
(0,15-2a) (0,15-2a) mol
Ba(OH)2 + SO3 → BaSO4 + H2O
2a 2a mol
Sau phản ứng thu được (0,15-2a) mol BaSO3 và 2a mol BaSO4.
→ 217. (0,15-2a) + 233.2a = 33,51 gam
Giải ra a = 0,03 mol
Vậy hiệu suất phản ứng bằng H = a/nO2 ban đầu.100% = 0,03/0,05.100% = 60%
Đáp án C
Câu hỏi 18 :
(1 điểm) Chia a gam hỗn hợp X gồm Mg, Al, Zn thành 2 phần bằng nhau.
- Phần 1: Tác dụng với dung dịch HCl dư thu được 13,44 lít khí H2(đktc).
- Phần 2: Cho tác dụng vừa đủ với m gam dung dịch H2SO4 98%, đun nóng thu được V lít H2S (sản phẩm khử duy nhất, đktc). Tính V, m.
Phương pháp giải:
Định luật bảo toàn electron
Lời giải chi tiết:
- Quá trình trao đổi electron:
+) Phần 1:
Mg0 → Mg+2 + 2e 2H+ + 2e → H20
Al0 → Al+3 + 3e
Zn0 → Zn+2 + 2e
+) Phần 2:
Mg0 → Mg+2 + 2e S+6 + 8e → S-2
Al0 → Al+3 + 3e
Zn0 → Zn+2 + 2e
*Tính V: Vì 2 phần bằng nhau nên lượng e trao đổi cũng bằng nhau.
n e nhận (P1) = n e nhận (P2) => 2nH2 = 8nH2S
=> nH2S = ¼ nH2 = ¼. (13,44 : 22,4) = 0,15 mol
=> VH2S (dktc) = 0,15. 22,4 = 3,36 lít
*Tính m:
nSO4 (muối) = 0,5.ne = 0,5.(8.0,15) = 0,6 mol
BTNT "S": nH2SO4 = nSO4(muối) + nH2S = 0,6 + 0,15 = 0,75 mol
=> mdd H2SO4 = mH2SO4.(100/98) = 98.0,75.(100/98) = 75g
Câu hỏi 19 :
(3 điểm)
Cho 18,4g hỗn hợp X gồm Fe và Mg. Thực hiện 2 thí nghiệm sau:
- Thí nghiệm 1: Cho 18,4g X tác dụng với dung dịch HCl vừa đủ thấy thoát ra 11,2 lít khí H2.
- Thí nghiệm 2: Cho 18,4g X tác dụng với dung dịch H2SO4 đặc nóng dư thấy thoát ra V lít khí SO2 (sản phẩm khử duy nhất). Biết thể tích các khí được đo ở điều kiện tiêu chuẩn.
a) Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp X.
b) Tính giá trị của V.
c) Hấp thụ hoàn toàn V lít khí SO2 ở trên vào 800 ml dung dịch NaOH 1M thu được dung dịch Y. Cô cạn dung dịch Y thu được a gam muối khan. Tính giá trị của a.
Phương pháp giải:
Nhận biết các chât hóa học vô cơ
Lời giải chi tiết:
a) Gọi số mol Fe và Mg lần lượt là x và y
=> mX = 56x + 24y = 18,4g (1)
- Thí nghiệm 1:
Fe + 2HCl → FeCl2 + H2
Mg + 2HCl → MgCl2 + H2
=> nH2 = nFe + nMg = x + y = 11,2: 22,4 = 0,5 mol (2)
Giải hệ phương trình (1), (2) => x = 0,2 mol ; y = 0,3 mol
=> %mFe = 56.0,2: 18,4 = 60,87% và %mMg = 100% - %mFe = 100% - 60,87% = 39,13%
b)
- Thí nghiệm 2:
Các quá trình cho nhận e:
Mg0 → Mg+2 + 2e
Fe0 → Fe+3 + 3e
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron: 2nMg + 3nFe = 2nSO2 = 2.0,3 + 3.0,2 = 1,2mol
=> nSO2 = 0,6 mol
=> VSO2 (dktc) = 0,6.22,4 = 13,44 lít
c) nNaOH = 0,8.1 = 0,8 mol và nSO2 = 0,6 mol
Ta có: 1 < nNaOH/nSO2 = 0,8/0,6 = 1,33 < 2 => Phản ứng tạo 2 muối Na2SO3 và NaHSO3.
Đặt nNa2SO3 = u mol và nNaHSO3 = v mol
PTHH:
SO2 + 2NaOH → Na2SO3 + H2O
u 2u u (mol)
SO2 + NaOH → NaHSO3
v v v (mol)
Theo đề bài ta có:
nSO2 = u + v = 0,6 (*)
nNaOH = 2u + v = 0,8 (**)
Giải hệ (*) và (**) thu được u = 0,2 và v = 0,4
Vậy dung dịch muối thu được chứa Na2SO3 (0,2 mol) và NaHSO3 (0,4 mol)
=> a = mNa2SO3 + mNaHSO3 = 126.0,2 + 104.0,4 = 66,8g
Câu hỏi 20 :
Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol khí N2O và 0,01mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là:
- A 13,5 gam.
- B 1,35 gam.
- C 0,81 gam.
- D 8,1gam.
Đáp án: B
Phương pháp giải:
Sử dụng phương pháp bảo toàn e
Tổng số mol e Al nhường = Tổng mol e N+5 nhận
Lời giải chi tiết:
Đặt nAl = a(mol)
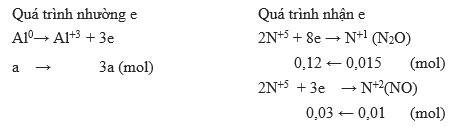
Có: ne(Al nhường) = ne(N+5 nhận)
→ 3a = 0,12 + 0,03
→ a = 0,05 (mol)
→ mAl = 0,05.27 = 1,35 (g)
Đáp án B
20 bài tập vận dụng về phản ứng OXH - Khử (phần 1) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 2) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
10 bài tập vận dụng cao về phản ứng OXH - Khử (phần 1) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
30 bài tập lý thuyết về phản ứng OXH Khử có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
30 bài tập lý thuyết về phản ứng OXH - Khử có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
30 bài tập lý thuyết về phản ứng OXH - Khử có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
Tổng hợp 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao đầy đủ các dạng từ dễ đến khó có đáp án và lời giải chi tiết
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









