30 bài tập khử oxit kim loại bằng CO, H2 có lời giải
Làm đề thiCâu hỏi 1 :
Dẫn CO (dư) qua hỗn hợp rắn X gồm: CuO, MgO, Fe3O4. Chất rắn thu được sau phản ứng (biết các phản ứng xảy ra hoàn toàn) là:
- A Cu, Mg, Fe.
- B Cu, MgO, Fe.
- C CuO, Mg, FeO.
- D Cu, MgO, FeO.
Đáp án: B
Phương pháp giải:
CO khử được các oxit của KL đứng sau Al trong dãy hoạt động hóa học của KL.
Lời giải chi tiết:
CO khử được các oxit của KL đứng sau Al trong dãy hoạt động hóa học của KL.
Do đó các oxit CuO, Fe3O4 bị khử thành Cu và Fe; MgO không bị khử.
Vậy các chất rắn thu được là Cu, Fe, MgO.
Đáp án B
Câu hỏi 2 :
Dẫn V lít khí CO ( dktc) qua ống sứ đựng lượng dư CuO nung nóng. Sau khi phản ứng hoàn toàn, khối lượng chất rắn giảm 4,0 gam so với ban đầu. Giá trị của V là
- A 2,24
- B 3,36
- C 5,60
- D 4,48
Đáp án: C
Phương pháp giải:
Phương pháp:
n CO = n O( oxit)
Lời giải chi tiết:
Hướng dẫn giải:
Khối lượng rắn giảm = khối lượng oxi trong CuO phản ứng
nO = 4: 16 = 0,25 (mol)
=> nCO = nO = 0,25( mol) => VCO = 0,25.22,4 = 5,6 (lít)
Đáp án C
Câu hỏi 3 :
Khử hoàn toàn 24 gam hỗn hợp CuO và Fe2O3 bằng khí CO dư thu được 8,96 lít khí CO2 ở đktc. Phần trăm khối lượng của CuO và Fe2O3 trong hỗn hợp lần lượt là
- A 33,33% và 66,67%.
- B 66,67% và 33,33%.
- C 40,33% và 59,67%.
- D 59,67% và 40,33%.
Đáp án: A
Phương pháp giải:
Đặt nCuO = x và nFe2O3 = y (mol)
+ Từ khối lượng hỗn hợp → (1)
+ Viết PTHH, từ số mol CO2 → (2)
Giải hệ tìm được x, y
Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp
Lời giải chi tiết:
Đặt nCuO = x và nFe2O3 = y (mol)
mhh = 80x + 160y = 24 (1)
PTHH:
CuO + CO → Cu + CO2
x → x (mol)
Fe2O3 + 3CO → 2Fe + 3CO2
y → 3y (mol)
⟹ nCO2 = x + 3y = 8,96/22,4 = 0,4 (2)
Từ (1) (2) ta có hệ phương trình: \(\left\{ \begin{array}{l}80{\rm{x}} + 160y = 24\\x + 3y = 0,4\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,1\end{array} \right.\)
\(\% {m_{CuO}} = \frac{{0,1.80}}{{24}}.100\% = 33,33\% \)
\(\% {m_{F{{\rm{e}}_2}{O_3}}} = 100\% - 33,33\% = 66,67\% \)
Đáp án A
Câu hỏi 4 :
Cho dòng khí CO đi qua ống sứ chứa 32 gam Fe2O3 một thời gian thu được 25,6 gam chất rắn A. Cho khí sinh ra đi qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị của m
- A 5.
- B 60.
- C 15.
- D 40.
Đáp án: D
Phương pháp giải:
mO pư = mchất rắn giảm → nO pư
CO + O → CO2
Ca(OH)2 + CO2 → CaCO3 + H2O
Lời giải chi tiết:
mO pư = mchất rắn giảm = 32 - 25,6 = 6,4 (g) → nO pư = 6,4 : 16 = 0,4 mol
CO + O → CO2
0,4 → 0,4 (mol)
Ca(OH)2 + CO2 → CaCO3 + H2O
0,4 → 0,4 (mol)
⟹ m = 0,4.100 = 40 gam
Đáp án D
Câu hỏi 5 :
Cho 50 gam hỗn hợp gồm (ZnO, Fe3O4, Fe2O3, CuO) tác dụng với CO dư thu được m gam kim loại và hỗn hợp khí. Cho hỗn hợp khí qua bình đựng dung dịch nước vôi trong dư thu được 20 gam kết tủa. Giá trị của m là
- A 46
- B 46,8
- C 47
- D 47,8
Đáp án: B
Phương pháp giải:
Phương pháp:
(ZnO, Fe3O4, Fe2O3, CuO) + CO (Zn, Fe, Cu)+ CO2
* Bảo toàn nguyên tố cacbon
CO CO2 ->CaCO3
=>
* Bảo toàn khối lượng
=> moxit = mKL + mO(oxit) => mKL=moxit -mO(oxit)
Lời giải chi tiết:
Hướng dẫn giải:
(ZnO, Fe3O4, Fe2O3, CuO) + CO (Zn, Fe, Cu)+ CO2
ZnO+ CO -> Zn+ CO2
Fe3O4 + 4CO -> 3Fe+4 CO2
Fe2O3 + 3CO -> 2Fe+ 3CO2
CuO+ CO -> Cu + CO2
=>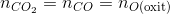
CO2 + Ca(OH)2 CaCO3 + H2O
* Bảo toàn nguyên tố cacbon
CO CO2 -> CaCO3
0,2 0,2 0,2

=> moxit = mKL + mO(oxit) => mKL=moxit -mO(oxit) =50-16.0,2=46,8 gam
Đáp án B
Câu hỏi 6 :
Cho 60 gam hỗn hợp X gồm (MgO, Fe3O4, Fe2O3, CuO) tác dụng với CO dư thu được m gam chất rắn và hỗn hợp khí. Cho hỗn hợp khí qua bình đựng dung dịch nước vôi trong dư thu được 30 gam kết tủa. Giá trị của m là
- A 46,7
- B 48,8
- C 47,9
- D 55,2
Đáp án: D
Phương pháp giải:
Phương pháp:
* Bảo toàn nguyên tố cacbon
* Tăng giảm khối lượng
mchất rắn giảm= m O(oxit phản ứng)= mX - mchất rắn
Lời giải chi tiết:
Hướng dẫn giải:
* Bảo toàn nguyên tố cacbon
CO -> CO2 -> CaCO3
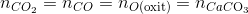
(MgO, Fe3O4, Fe2O3, CuO) + CO => (MgO, Fe, Cu) +CO2
mchất rắn giảm= m O(oxit phản ứng)= mX - mchất rắn = 60-m=0,3.16
=> mchất rắn=mX -mO =60-16.0,3=55,2gam
Đáp án D
Câu hỏi 7 :
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
- A 80%
- B 60%.
- C 20%.
- D 40%.
Đáp án: D
Phương pháp giải:
Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng. Viết PTHH xảy ra, tính mol CuO theo mol CO, từ đó tính được % CuO và suy ra được %MgO còn lại.
Lời giải chi tiết:
nCO(đktc) = 3,36 :22,4 = 0,15 (mol)
Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng
CO + CuO \(\buildrel {{t^0}} \over\longrightarrow \) Cu + H2O
0,15 → 0,15 (mol)
nCuO = 0,15 (mol) => mCuO = 0,15.80 = 12 (g)
%CuO = (mCuO : mhh).100% = (12 : 20).100% = 60%
=> %MgO = 100% -%CuO = 40%.
Đáp án D
Câu hỏi 8 :
Để khử hoàn toàn hỗn hợp FeO, CuO cần 4,48 lít H2 (đktc). Nếu cũng khử hoàn toàn hỗn hợp đó bằng CO thì lượng CO2 thu được khi cho qua dung dịch nước vôi trong dư tạo ra số gam kết tủa là:
- A 10,0 gam.
- B 20,0 gam.
- C 1,0 gam.
- D 2,0 gam.
Đáp án: B
Phương pháp giải:
- Khử oxit KL bằng H2: O + H2 → H2O
=> nO (bị khử) = nH2 pư
- Khử oxit KL bằng CO: O + CO → CO2
=> nO (bị khử) = nCO pư
=> nCO pư = nH2 pư
Lời giải chi tiết:
- Khử oxit KL bằng H2: O + H2 → H2O
=> nO (bị khử) = nH2 pư
- Khử oxit KL bằng CO: O + CO → CO2
=> nO (bị khử) = nCO pư
=> nCO pư = nH2 pư = 4,48/22,4 = 0,2 mol
Ta có: nCaCO3 = nCO2 = nCO => mkết tủa = 20 gam
Đáp án B
Câu hỏi 9 :
Cho khí CO dư đi qua 15 gam hỗn hợp X gồm CuO, NiO, Fe2O3 và ZnO thu được 11,8 gam chất rắn Y gồm các kim loại. Tính thể tích dung dịch Z gồm H2SO4 1,0M và HCl 0,5M cần dùng để hoà tan hêt 15,0 gam hỗn họp X:
- A
0,04 lít
- B
0,2 lit
- C
0,8 lít
- D
0,6 lít
Đáp án: A
Lời giải chi tiết:
nO trong X = (15 – 11,8) : 16 = 0,2mol
nH+ = 2n O trong X = 2 (2V + 0,5V) = 0,2
=> V = 0,04 lít
Đáp án A
Câu hỏi 10 :
Thổi CO dư qua m gam hỗn họp CuO, Fe2O3, ZnO, PbO nóng đỏ thu được 2,32 gam kim loại. Khí thoát ra cho vào bình nước vôi trong được 5 gam kết tủa, đun tiếp dung dịch lại thấy có thêm 10 gam kết tủa. m có giá trị là:
- A
6,32
- B
3,12
- C
3,92
- D
4,72
Đáp án: A
Lời giải chi tiết:
n CaCO3 1 = 0,05mol
n CaCO3 2 = 0,1 mol => n Ca(HCO3)2 = 0,1 mol
nCO2 = nCaCO3 1 + 2nCa(HCO3)2 = 0,05 + 0,1 . 2 = 0,25mol
m = m O trong oxit + m kim loại = 0,25 . 16 + 2,32 = 6,32g
Đáp án A
Câu hỏi 11 :
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
- A
FeO; 75%.
- B
Fe3O4; 75%.
- C
Fe2O3; 65%.
- D
Fe2O3; 75%.
Đáp án: D
Phương pháp giải:
Tính số mol mỗi khí trong hỗn hợp khí thu được sau phản ứng bằng cách lập hệ phương trình:
nCO bđ = nCO dư + nCO2 (1)
mkhí sau pư = 28nCO dư + 44nCO2 (2)
Tính phần trăm thể tích của CO2
Vì CO dư nên oxit sắt phản ứng hết.
nO (oxit) = nCO2
nFe (oxit) = (moxit - mO)/56
→ Tỉ lệ nFe : nO → Công thức oxit sắt
Lời giải chi tiết:
nCO bđ = 0,2 mol
Hỗn hợp sau phản ứng có M = 40 gồm CO dư (x mol) và CO2 (y mol)
+) Bảo toàn C → nCO bđ = nCO dư + nCO2 → x + y = 0,2 (1)
+) mkhí sau pư = 28x + 44y = 0,2.40 = 8 (2)
Giải (1) (2) được x = 0,05 và y = 0,15
\( \to \% {V_{C{O_2}}} = \frac{{0,15}}{{0,2}}.100\% = 75\% \)
Vì CO dư nên oxit sắt phản ứng hết.
nO (oxit) = nCO2 = 0,15 mol
nFe (oxit) = (moxit - mO)/56 = (8 - 0,15.16)/56 = 0,1 mol
→ nFe : nO = 0,1 : 0,15 = 2 : 3
Vậy oxit sắt là Fe2O3.
Đáp án D
Câu hỏi 12 :
Để khử hoàn toàn hổn hợp FeO,CuO cần 4,48 lít H2(đkc).Nếu cũng khử hoàn toàn hổn hợp đó bằng CO thì lượng CO2 thu được khi cho qua dd nước vôi trong dư tạo ra bao nhiêu gam kết tủa?
- A 1,0g
- B 2,0g
- C 20g
- D 10g
Đáp án: C
Phương pháp giải:
Phương pháp:
H2, CO đều khử hoàn toàn FeO, CuO về Fe, Cu
Định luật bảo toàn electron
ne nhường = ne nhận
=> => mkết tủa
Lời giải chi tiết:
Hướng dẫn giải:
H2, CO đều khử hoàn toàn FeO, CuO về Fe, Cu
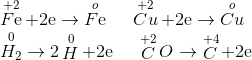
Định luật bảo toàn electron
ne nhường = ne nhận
=> = 4,48:22,4=0,2=nCO2= nkết tủa
=> mkết tủa = 0,2.100=20 gam
Đáp án C
Câu hỏi 13 :
Cho khí CO khử hoàn toàn hổn hợp Fe2O3 và CuO thu được hổn hợp kim loại và khí CO2.Nếu số mol CO2 tạo ra từ Fe2O3 và CuO có tỉ lệ là 3:2 thì % khối lượng của Fe2O3 và CuO trong hổn hợp là
- A 60% và 40%
- B 50% và 50%
- C 40% và 60%
- D 30% và 70%
Đáp án: B
Phương pháp giải:
Phương pháp:
Fe2O3 + 3CO -> 2Fe+ 3CO2
x 3x
CuO+ CO -> Cu + CO2
y y
=> 3x:y=3:2 => y=2x=>%mFe2O3=>%mCuO
Lời giải chi tiết:
Hướng dẫn giải:
Fe2O3 + 3CO -> 2Fe+ 3CO2
x 3x
CuO+ CO -> Cu + CO2
y y
=> 3x:y=3:2 => y=2x => mhh oxit= 160x+ 80y=160x+ 80.2x=320y (gam)
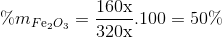
=> %mCuO = 100% - 50% = 50%
Đáp án B
Câu hỏi 14 :
Dẫn 1 luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 14,8 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 30 gam kết tủa. % khối lượng CuO trong hỗn hợp là
- A 40%
- B 40,8%
- C 50%
- D 50,8%
Đáp án: B
Phương pháp giải:
Phương pháp:
Fe3O4 + 4CO -> 3Fe + 4CO2
x 3x 4x
CuO -> Cu + CO2
y y y
=> mFe+ mCu =3x.56 + y.64
nCO2 = 4x+y = nCaCO3
=> x,y=> mCuO, mFe3O4
=>%mCuO
Lời giải chi tiết:
Hướng dẫn giải:
Fe3O4 + 4CO -> 3Fe + 4CO2
x 3x 4x
CuO -> Cu + CO2
y y y
=> mFe+ mCu = 3x.56 + y.64 = 14,8
nCO2 = 4x+y = nCaCO3 = 0,3
=> x= 0,05
y= 0,1
=> mCuO =0,1.80=8 g
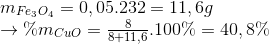
Đáp án B
Câu hỏi 15 :
Cho hỗn hợp A gồm 5,6 gam Fe và 14,4 gam FeO vào trong một bình kín dung tích không đổi 8,96 lít chứa CO (đktc). Nung nóng bình một thời gian thu được hỗn hợp khí có tỉ khối so với H2 là 18. Số gam chất rắn còn lại trong bình sau khi nung là:
- A 20,4
- B 15,5
- C 18,0
- D 16,8
Đáp án: D
Phương pháp giải:
Phương pháp:
mcrắn sau = mcrắn trước p/u - mO
=> x,y => nO= nCO2=>mcrắn sau = mcrắn trước p/u - mO
Lời giải chi tiết:
Hướng dẫn giải:
mcrắn trước p/u = 5,6 +14,4 =20
mcrắn sau = mcrắn trước p/u - mO
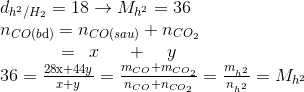
36x+36y=28x+44y
=> 8x-8y=0=> x=y
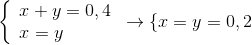
nO= nCO2= 0,2 mol.
=>mcrắn sau = mcrắn trước p/u - mO = 20-16.0,2 = 16,8 gam
Đáp án D
Câu hỏi 16 :
Khử hoàn toàn 14 gam hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32 gam hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
- A 10,304 lít.
- B 1,0304 lít.
- C 5,152 lít.
- D 51,52 lít.
Đáp án: C
Phương pháp giải:
Oxit + CO → KL + CO2
Đặt nCO = nCO2 = x mol
BTKL: m oxit + mCO = mKL + mCO2 => x = ? => VCO
Lời giải chi tiết:
Oxit + CO → KL + CO2
Đặt nCO = nCO2 = x mol
BTKL: m oxit + mCO = mKL + mCO2
→ 14 + 28x = 10,32 + 44x
→ x = 0,23 mol
→ VCO = 0,23.22,4 = 5,152 lít
Đáp án C
Câu hỏi 17 :
Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
- A 50,0.
- B 12,5.
- C 25,0.
- D 20,0.
Đáp án: B
Phương pháp giải:
Khi khử oxit kim loại bằng CO: nCO pư = nO pư = nCO2
Khi CO2 phản ứng với Ca(OH)2 dư: nCaCO3 = nCO2
Lời giải chi tiết:
m rắn giảm = mO pư = 2 gam ⟹ nO = 2/16 = 0,125 mol
Khi khử oxit kim loại bằng CO:
CO + O → CO2
0,125 → 0,125 (mol)
Khi CO2 phản ứng với Ca(OH)2 dư:
nCaCO3 = nCO2 = 0,125 mol
⟹ mCaCO3 = 0,125.100 = 12,5 gam
Đáp án B
Câu hỏi 18 :
Cho khí CO đi qua m gam Fe2O3 nung nóng thì thu được 10,68 gam chất rắn A và khí B. Cho toàn bộ khí B hấp thụ vào dung dịch Ca(OH)2 dư thì thấy tạo ra 3 gam kết tủa. Giá trị của m là:
- A 11,16.
- B 11,58.
- C 12,0.
- D 12,2.
Đáp án: A
Phương pháp giải:
Tính toán theo phương trình phản ứng
Phản ứng khử oxit bằng CO có thể hiểu đơn giản là: CO + Ooxit → CO2
Lời giải chi tiết:
Tổng quát: CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
nCO2 = nCaCO3 = 3/100 = 0,03 mol = nCO pư
BTKL: mCO pư + mFe2O3 = mA + mCO2
⟹ 0,03.28 + m = 10,68 + 0,03.44
⟹ m = 11,16 gam
Đáp án A
Câu hỏi 19 :
Cho 4,48 lít khí CO đktc phản ứng với 8 gam một oxit kim loại, sau phản ứng hoàn toàn, thu được m gam kim loại và hỗn hợp khí có tỉ khối so với H2 là 20. Giá trị của m là
- A 7,2
- B 3,2
- C 6,4
- D 5,6
Đáp án: D
Phương pháp giải:
CO + oxit → kim loại + CO2
Trong hỗn hợp khí sau phản ứng đặt nCO = x mol và nCO2 =y mol
Bảo toàn C có x + y
Tỉ khối hỗn hợp khí so với H2 là 20 nên lập được pt theo x và y
→ x và y
Bảo toàn khối lượng tính m
Lời giải chi tiết:
CO + oxit → kim loại + CO2
Trong hỗn hợp khí sau phản ứng đặt nCO = x mol và nCO2 =y mol
Bảo toàn C có x + y = 0,2 mol
Tỉ khối hỗn hợp khí so với H2 là 20 nên \(\frac{{28x + 44y}}{{x + y}} = 20.2\) =40
→ x = 0,05 mol và y =0,15 mol
Bảo toàn khối lượng có mCO + moxit = m + mkhí → 0,2.28 + 8 = m + 0,05.28 + 0,15.44 → m =5,6g
Đáp án D
Câu hỏi 20 :
Thổi từ từ V lít CO (đktc) đi qua ống sứ đựng 51,6 gam hỗn hợp X gồm CuO, Al2O3 và Fe3O4 (tỉ lệ mol lần lượt là 1:2:1). Các phản ứng xảy ra hoàn toàn, kết thúc phản ứng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 19. Cho toàn bộ lượng khí Y hấp thụ vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch Z. Cho dung dịch Z phản ứng với lượng dư dung dịch Ba(OH)2 dư thấy tạo thành m gam kết tủa. Giá trị của V và m lần lượt là:
- A 17,92 lít và 29,7 gam.
- B 17,92 lít và 20 gam.
- C 11,20 lít và 20 gam.
- D 11,20 lít và 29,7 gam.
Đáp án: A
Phương pháp giải:
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol)
Từ khối lượng của hh X => x = ?
nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = ?
Dùng quy tắc đường chéo tính được số mol của CO và CO2 trong hh khí Y
BTNT "C": nCO ban đầu = nCO2 + nCO dư = ? => VCO(đktc) = ?
Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => nCa(HCO3)2 = ? (mol)
Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O
=> m↓ = mCaCO3 + mBaCO3 = ?
Lời giải chi tiết:
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol)
=> 80x + 102.2x + 232.x = 51,6
=> x = 0,1 (mol)
=> nCuO = nFe3O4 = 0,1 (mol) ; nAl2O3 = 0,2 (mol)
\(V(l)CO + \left\{ \matrix{
CuO:0,1 \hfill \cr
A{l_2}{O_3}:0,2 \hfill \cr
F{e_3}{O_4}:0,1 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \underbrace {Y\left\{ \matrix{
C{O_2}:0,5 \hfill \cr
COdu: \hfill \cr} \right.}_{\overline M = 38}\buildrel { + Ca{{(OH)}_2}} \over
\longrightarrow \left\langle \matrix{
CaC{O_3}:0,3\,mol \hfill \cr
\underbrace {Ca{{(HC{O_3})}_2}}_{dd\,Z}\buildrel { + Ba{{(OH)}_2}} \over
\longrightarrow \underbrace {BaC{O_3},CaC{O_3} \downarrow }_{m = ?} \hfill \cr} \right.\)
nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = 0,1 + 4.0,1 = 0,5 (mol)
Hỗn hợp Y là 2 khí CO2 và CO dư có M= 19.2 = 38
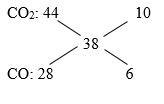
Ta có: \({{{n_{C{O_2}}}} \over {{n_{CO}}}} = {{10} \over 6} = {5 \over 3} \Rightarrow {{0,5} \over {{n_{CO}}}} = {5 \over 3} \Rightarrow {n_{CO}} = 0,3\,(mol)\)
BTNT "C": nCO ban đầu = nCO2 + nCO dư = 0,5 + 0,3 = 0,8 (mol)
=> VCO(đktc) = 0,8.22,4= 17,92 (l)
Hấp thụ hỗn hợp CO2 và CO vào dd Ca(OH)2 chỉ có CO2 tham gia phản ứng
Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2
=> 0,5 = 0,3 + 2nCa(HCO3)2
=> nCa(HCO3)2 = 0,1 (mol)
Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O
0,1 → 0,1 0,1 (mol)
=> m↓ = mCaCO3 + mBaCO3 = 0,1.100 + 0,1.197 = 29,7 (g)
Đáp án A
Câu hỏi 21 :
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
- A 7,12
- B 13,52
- C 6,8
- D 5,68
Đáp án: A
Phương pháp giải:
Quy hỗn hợp X chứa hai chất: FeO và Fe2O3
Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Áp dụng định luật bảo toàn electron cho phản ứng với CO và phản ứng với H2SO4 đặc để tìm số mol FeO.
Dùng bảo toàn nguyên tố Fe để tìm số mol Fe2O3.
Từ đó xác định được giá trị của m.
Lời giải chi tiết:
Quy hỗn hợp X chứa hai chất: FeO x mol và Fe2O3 y mol
Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2
CO2 + Ca(OH)2 dư → CaCO3 + H2O
Ta có: nCO2 = nCaCO3 = 0,04 mol
Cho Y + H2SO4 đặc nóng dư thu được nSO2 = 0,045 mol
- QT cho e:
FeO → Fe+3 + 1e
x → x mol
C +2 → C+4 + 2e
0,04 0,08 mol
- QT nhận e:
S +6 + 2e → SO2
0,09 ← 0,045 mol
Theo định luật bảo toàn electron: ne cho = ne nhận → x + 0,08 = 0,09 → x = 0,01 mol
Muối thu được sau phản ứng là Fe2(SO4)3 → nFe2(SO4)3 = 18/400 = 0,045 mol
Bảo toàn nguyên tố Fe ta có: nFeO + 2nFe2O3 = 2nFe2(SO4)3 => x + 2y = 0,045.2 → y = 0,04 mol
→ m = mFeO + mFe2O3 = 72x + 160y = 72.0,01 + 160.0,04 = 7,12 gam
Đáp án A
Câu hỏi 22 :
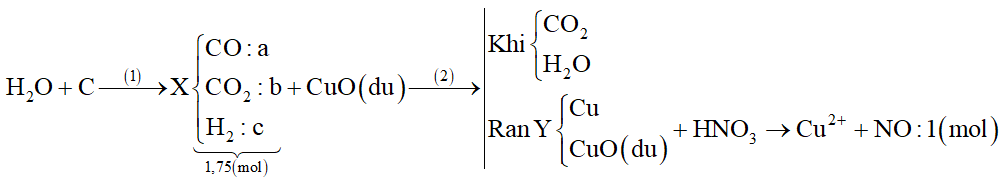
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,75a mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch Ca(OH)2 dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,75 gam kết tủa. Giá trị của a là
- A 0,045.
- B 0,030.
- C 0,010.
- D 0,015.
Đáp án: B
Phương pháp giải:
Sơ đồ
\(X\left\{ \matrix{
C{O_2} \hfill \cr
{H_2}O \hfill \cr} \right. + C\buildrel {} \over
\longrightarrow Y\left\{ \matrix{
\left\{ \matrix{
CO \hfill \cr
{H_2} \hfill \cr} \right. \hfill \cr
C{O_2} \hfill \cr} \right.\)
Cách 1: Viết PTHH, tính theo PTHH
Cách 2: Bảo toàn electron
Lời giải chi tiết:
Cách 1:
Đặt mol mỗi khí trong X là: nCO2 = x (mol); nH2O = y (mol) → a = x + y
nCaCO3 = 0,75 : 100 = 0,0075 (mol)
2H2O + C \(\buildrel {{t^o}} \over\longrightarrow \) 2H2 + CO2
y → y → 0,5y (mol)
CO2 + C \(\buildrel {{t^o}} \over\longrightarrow \) 2CO
(x + 0,5y – 0,0075) → 2(x + 0,5y – 0,0075) (mol)
Hỗn hợp khí Y chứa H2, CO và CO2. Cho hh này vào dung dịch Ca(OH)2 dư chỉ có CO2 phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O
0,0075 ← 0,0075 (mol)
→ Hỗn hợp Y có :
Có nY = 1,75a → y + 2(x+ 0,5y – 0,0075) + 0,0075 = 1,75(x+y)
→ x + y = a = 0,03
Cách 2:
nC phản ứng = nY - nX = 0,75a (BTC)
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2 => nCO + nH2 = 1,5a
=> nCO2(Y) = nY - (nCO + nH2) = 0,25a
Ca(OH)2 dư nên nCO2 (Y) = nCaCO3 = 0,0075
=> 0,25a = 0,0075 => a = 0,03
Đáp án B
Câu hỏi 23 :
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
- A 29,55.
- B 19,7.
- C 15,76.
- D 9,85.
Đáp án: D
Phương pháp giải:
\(0,55\,mol\,X\left\{ \matrix{
{H_2}O:x(mol) \hfill \cr
C{O_2}:\,y\,(mol) \hfill \cr} \right. + C\buildrel {{t^0}} \over
\longrightarrow 0,95\,mol\,Y\left\{ \matrix{
{H_2}:x(mol) \hfill \cr
CO:0,95 - x - z\,(mol) \hfill \cr
C{O_2}:z\,(mol) \hfill \cr} \right.\buildrel { + Ba{{(OH)}_2}:\,0,1\,(mol)} \over
\longrightarrow m \downarrow = ?\)
Lập hệ phương trình với số mol X và BTNT "O" sẽ tìm ra được số mol CO2 trong Y
Có mol CO2, mol Ba(OH)2. Lập tỉ lệ nOH-/nCO2 để tính được khối lượng kết tủa tạo thành.
Lời giải chi tiết:
\(0,55\,mol\,X\left\{ \matrix{
{H_2}O:x(mol) \hfill \cr
C{O_2}:\,y\,(mol) \hfill \cr} \right. + C\buildrel {{t^0}} \over
\longrightarrow 0,95\,mol\,Y\left\{ \matrix{
{H_2}:x(mol) \hfill \cr
CO:0,95 - x - z\,(mol) \hfill \cr
C{O_2}:z\,(mol) \hfill \cr} \right.\buildrel { + Ba{{(OH)}_2}:\,0,1\,(mol)} \over
\longrightarrow m \downarrow = ?\)
C(r) + H2O(h) → CO(k) + H2(k) (1)
C(r) + 2H2O(h) → CO2 (k) + 2H2(k) (2)
C(r) + CO2(k) → CO(k) (3)
Ta có hệ phương trình:
\(\left\{ \matrix{
{n_X} = x + y = 0,55\, \hfill \cr
\buildrel {BTNT\,:\,O} \over
\longrightarrow x + 2y = 0,95 - x - z + 2z \hfill \cr} \right. \Rightarrow \left\{ \matrix{
x + y = 0,55 \hfill \cr
z = 2(x + y) - 0,95 \hfill \cr} \right. \Rightarrow z = 2.0,55 - 0,95 = 0,15\,(mol)\)
→ nCO2(Y) = z = 0,15 (mol)
Xét Y phản ứng với 0,1 mol Ba(OH)2
Ta có: \(1 < {{{n_{O{H^ - }}}} \over {{n_{C{O_2}}}}} = {{0,2} \over {0,15}} = 1,33 < 2\) => Tạo cả 2 muối CO32- và HCO3-. Cả OH- và CO2 đều phản ứng hết.
CO2 + OH- → HCO3-
CO2 + 2OH- → CO32- + H2O
=> nCO32- = nOH- - nCO2 = 0,1.2 – 0,15 = 0,05 mol
=> số mol BaCO3= 0,05 mol=> mBaCO3↓= 0,05.197 = 9,85 gam.
Đáp án D
Câu hỏi 24 :
Khử hoàn toàn 4 gam hỗn hợp gồm CuO và PbO bằng khí CO dư ở nhiệt độ cao. Khí sinh ra được dẫn vào bình đựng nước vôi trong dư thu được 10 gam kết tủa. Khối lượng Cu và Pb thu được là:
- A 2,5 gam.
- B 2,4 gam.
- C 3,2 gam.
- D 2,3 gam.
Đáp án: B
Phương pháp giải:
Ta có: (1) CO + O → CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
nCaCO3 → nCO2 → nO
→ mkim loại = moxit - mO
Lời giải chi tiết:
Ta có: (1) CO + O → CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
Theo (2): nCO2 = nCaCO3 = 0,1 mol
Theo (1): nO = nCO2 = 0,1 mol
Bảo toàn khối lượng có: mkim loại = moxit - mO = 4 - 0,1.16 = 2,4 gam
Đáp án B
Câu hỏi 25 :
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm Al2O3 và CuO nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
- A 0,8 gam.
- B 8,3 gam.
- C 2,0 gam.
- D 4,0 gam.
Đáp án: A
Phương pháp giải:
CO chỉ khử được những oxit của KL đứng sau Al.
Như vậy CO chỉ khử được CuO, không khử được Al2O3
PTHH: CO + CuO \(\overset{t_{o}}{\rightarrow}\) Cu + CO2
Lời giải chi tiết:
CO chỉ khử được những oxit của KL đứng sau Al.
Như vậy CO chỉ khử được CuO, không khử được Al2O3
Đặt nCuO = x (mol)
PTHH: CO + CuO \(\overset{t_{o}}{\rightarrow}\) Cu + CO2
x ← x → x (mol)
Bảo toàn khối lượng: mCO + mhh ban đầu = mrắn + mCO2 → 28x + 9,1 = 8,3 + 44x → x = 0,05 mol
→ mCuO = 0,05.80 = 4 gam
Đáp án D
Câu hỏi 26 :
Dẫn khí CO qua ống sứ đựng 32 gam Fe2O3 nung nóng, sau một thời gian thu được 25,6 gam chất rắn. Thể tích khí CO (đktc) đã tham gia phản ứng là
- A 7,68 lít.
- B 2,24 lít.
- C 6,72 lít.
- D 8,96 lít.
Đáp án: D
Phương pháp giải:
- Khối lượng chất rắn giảm là khối lượng O bị lấy đi → mO phản ứng
- Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2
→ nCO phản ứng = nO phản ứng
Lời giải chi tiết:
Khối lượng chất rắn giảm là khối lượng O bị lấy đi → \({m_{O(pu)}} = 32 - 25,6 = 6,4(g)\)
Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2
\( \to {n_{CO(pu)}} = {n_{O(pu)}} = \frac{{6,4}}{{16}} = 0,4(mol) \to {V_{CO}} = 0,4.22,4 = 8,96(l)\)
Đáp án D
Câu hỏi 27 :
Cho hơi nước đi qua than nóng đỏ thu được 78,4 lít hỗn hợp khí X (đktc) gồm khí CO, CO2, H2. Khử hết 1/2 hỗn hợp X bằng CuO dư nung nóng được chất rắn Y. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng thu được 22,4 lít (đktc) khí NO (sản phẩm khử duy nhất của N+5). Phần trăm thể tích khí CO trong X là
- A 28,57%.
- B 57,15%.
- C 33,3%.
- D 18,42%.
Đáp án: A
Phương pháp giải:
Phương pháp bảo toàn electron
Lời giải chi tiết:
nX = 3,5 mol → n1/2 X = 1,75 mol
+) n1/2 X = a + b + c = 1,75 (1)
+) Áp dụng bảo toàn e cho quá trình (1): 2nCO + 4nCO2 = 2nH2 → 2a + 4b = 2c (2)
+) Áp dụng bảo toàn e cho quá trình (2): 2nCO + 2nH2 = 3nNO → 2a + 2c = 3.1 (3)
Giải (1) (2) (3) được a = 0,5; b = 0,25; c = 1
→ %VCO = (0,5/1,75).100% = 28,57%
Đáp án A
Câu hỏi 28 :
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
- A 9,85.
- B 19,7.
- C 29,55.
- D 15,76.
Đáp án: A
Phương pháp giải:
Tính được nC = nY - nX
Oxi hóa hoàn toàn hỗn hợp Y thì:
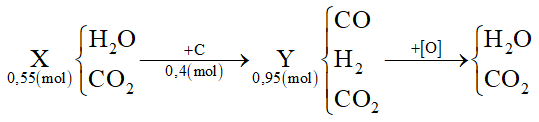
Áp dụng bảo toàn e cho toàn bộ quá trình sẽ tính được số mol O (cần dùng để oxi hóa hết Y)
Mà nO = ∑nCO(Y), H2(Y) ⟹ số mol CO2 trong Y
Sau đó giải tương tự như bài toán hấp thụ CO2 vào dung dịch kiềm
Lời giải chi tiết:
Ta thấy nC = nY - nX = 0,95 - 0,55 = 0,4 mol
Oxi hóa hoàn toàn hỗn hợp Y thì:

Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol
Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 - 0,8 = 0,15 mol
Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2:
Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3- (b)
Giải hệ: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + b = 0,15\\{n_{O{H^ - }}} = 2{\rm{a}} + b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}a = 0,05\\b = 0,1\end{array} \right.\)
Ba2+ + CO32- → BaCO3
0,05 ← 0,05 → 0,05
→ m ↓ = 0,05.197 = 9,85 gam
Đáp án A
Câu hỏi 29 :
Dẫn 0,09 mol hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,15 mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng CuO (dư, đun nóng) thu được chất rắn Z gồm 2 chất. Cho Z vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
- A 3,84.
- B 5,12.
- C 10,24.
- D 7,68.
Đáp án: D
Phương pháp giải:
Sơ đồ: \(hh\,X\,mol\left\{ \begin{array}{l}C{O_2}\\{H_2}O\end{array} \right. + C \to hh\,Y\,mol\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right.\)\(\xrightarrow{{ + \,CuO\,du}}\)\(Z\left\{ \begin{array}{l}Cu\\CuO\end{array} \right.\)\(\xrightarrow{{ + \,HCl\,du}}\)\(\left\{ \begin{array}{l}dd\,CuC{l_2},HCldu\\m\,(g)\,Cu \downarrow \end{array} \right.\)
PTHH: H2O + C \(\xrightarrow{{{t^0}}}\) CO + H2
(mol) x → x → x
CO2 + C \(\xrightarrow{{{t^0}}}\) 2CO
(mol) y → 2y
Đặt nH2O pư = x (mol); nCO2 pư = y (mol); nCO2 dư = z (mol)
Ta có hệ: \(\left\{ \begin{array}{l}{n_{hh\,X}} = {n_{{H_2}O\,pu}} + {n_{C{O_2}\,pu}} + {n_{C{O_2}\,du}}\\{n_{hh\,Y}} = {n_{CO}} + {n_{{H_2}}} + {n_{C{O_2}\,du}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x + y + z = {n_{hh\,X}}\\2x + 2y + z = {n_{hh\,Y}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{C{O_2}\,du}} = z = 2{n_{hh\,X}} - {n_{hh\,Y}}\\{n_{CO}} + {n_{{H_2}}} = {n_{hh\,Y}} - {n_{C{O_2}\,du}}\end{array} \right.\)
nO(trong oxi bị lấy đi) = nCO + nH2
Lời giải chi tiết:
Sơ đồ: \(0,09\,mol\left\{ \begin{array}{l}C{O_2}\\{H_2}O\end{array} \right. + C \to 0,15\,mol\,Y\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right.\)\(\xrightarrow{{ + \,CuO\,du}}\)\(Z\left\{ \begin{array}{l}Cu\\CuO\end{array} \right.\)\(\xrightarrow{{ + \,HCl\,du}}\)\(\left\{ \begin{array}{l}dd\,CuC{l_2},HCldu\\m\,(g)\,Cu \downarrow \end{array} \right.\)
PTHH: H2O + C \(\xrightarrow{{{t^0}}}\) CO + H2
(mol) x → x → x
CO2 + C \(\xrightarrow{{{t^0}}}\) 2CO
(mol) y → 2y
Đặt nH2O pư = x (mol); nCO2 pư = y (mol); nCO2 dư = z (mol)
Ta có hệ: \(\left\{ \begin{array}{l}{n_{hh\,dau}} = {n_{{H_2}O\,pu}} + {n_{C{O_2}\,pu}} + {n_{C{O_2}\,du}}\\{n_{hh\,Y}} = {n_{CO}} + {n_{{H_2}}} + {n_{C{O_2}\,du}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x + y + z = 0,09\\2x + 2y + z = 0,15\end{array} \right. \Rightarrow \left\{ \begin{array}{l}2x + 2y + 2z = 0,18\\2x + 2y + z = 0,15\end{array} \right. \Rightarrow z = 0,18 - 0,15 = 0,03\,(mol)\)
⟹ nCO2 dư = z = 0,03 (mol)
⟹ nCO + nH2 = nhh Y – nCO2 dư = 0,15 – 0,03 = 0,12 (mol)
Cho hh Y tác dụng với CuO có pư:
CO + CuO \(\xrightarrow{{{t^0}}}\) Cu + H2O (1)
H2 + CuO \(\xrightarrow{{{t^0}}}\) Cu + H2O (2)
Thep PTHH (1) và (2): ∑nCu = ∑nCO+H2 = 0,12 (mol)
hh Z thu được gồm Cu và CuO dư. Cho hh Z tác dụng với dd HCl thì CuO tan còn lại chất rắn không tan là Cu.
⟹ mCu = nCu×MCu = 0,12×64 = 7,68 (g)
Đáp án D
Câu hỏi 30 :
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
- A 57,25%.
- B 28,57%.
- C 18,47%.
- D 14,29%.
Đáp án: B
Phương pháp giải:
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
C + 2H2O → CO2 + 2H2
Hỗn hợp X chứa: CO; CO2 và H2
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
CO + CuO dư → Cu + CO2 (đun nóng)
H2 + CuO dư → Cu + H2O (đun nóng)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → (2)
Lời giải chi tiết:
Cách 1: Tính theo PTHH
Cho hơi nước đi qua than nóng đỏ:
C + H2O → CO + H2
a → a
C + 2H2O → CO2 + 2H2
b → 2b
Hỗn hợp X chứa: CO (a mol); CO2 (b mol) và H2 (a + 2b mol)
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
b → b = 0,1 mol
CO + CuO dư → Cu + CO2 (đun nóng)
a → a
H2 + CuO dư → Cu + H2O (đun nóng)
(a+2b) → (a+2b)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2a+2b) → 2/3.(2a+2b)
Vậy ta có: \(\left\{ \begin{array}{l}b = 0,1\\{n_{NO}} = \frac{2}{3}\left( {2{\rm{a}} + 2b} \right) = 0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\)
Hỗn hợp X chứa: CO (0,2 mol); CO2 (0,1 mol) và H2 (0,4 mol)
⟹ %VCO = 28,57%
Cách 2: Sử dụng bảo toàn electron
nCO2 = nCaCO3 = 0,1 mol
Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol)
- Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → 2y = 2x + 0,4 (1)
- Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol)
- Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → 2(x + y) = 3.0,4 (2)
Giải hệ trên được x = 0,2 và y = 0,4
Hỗn hợp X chứa: CO (0,2 mol); H2 (0,4 mol); CO2 (0,1 mol)
⟹ %VCO = 28,57%
Đáp án B
40 bài tập về muối cacbonat đầy đủ các dạng từ dễ đến khó, tự luận và trắc nghiệm có đáp án và lời giải chi tiết
40 bài tập về CO2 tác dụng với dung dịch kiềm từ dễ đến khó, đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết
40 câu hỏi lý thuyết về hợp chất của cacbon đầy đủ các dạng từ dễ đến khó, tự luận và trắc nghiệm có đáp án và lời giải chi tiết (phần 2)
40 bài tập lý thuyết về hợp chất của cacbon đầy đủ các dạng từ dễ đến khó, trắc nghiệm và tự luận có đáp án và lời giải chi tiết (phần 1)
20 câu hỏi lý thuyết về tính chất hóa học của cacbon đầy đủ các dạng từ dễ đến khó, tự luận và trắc nghiệm có đáp án và lời giải chi tiết (phần 2)
20 câu hỏi lý thuyết về tính chất của cacbon có đáp án và lời giải chi tiết (phần 1)
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









