20 bài tập vận dụng về tính pH có lời giải (phần 2)
Làm đề thiCâu hỏi 1 :
Dung dịch NaOH 0,001M có giá trị pH là:
- A 3.
- B 2.
- C 11.
- D 12.
Đáp án: C
Phương pháp giải:
Tính pOH = -log[OH-] => pH = 14 - pOH
Lời giải chi tiết:
NaOH là chất điện li mạnh => [OH-] = CM NaOH = 0,001M
=> pOH = -log[OH-] = -log(0,001) = 3
=> pH = 14 - pOH = 14 - 3 = 11
Đáp án C
Câu hỏi 2 :
Cho 100 ml dung dịch X chứa: 0,07 mol Na+; 0,02 mol SO42- và x mol OH-. 100 ml dung dịch Y có chứa y mol H+, Cl-, NO3- và 0,01 mol Na+ (tổng số mol Cl- và NO3- là 0,042). Trộn 100 ml dung dịch X với 100 ml dung dịch Y thu được dung dịch Z. Dung dịch Z có pH là
- A 13
- B 2
- C 12
- D 1
Đáp án: B
Phương pháp giải:
Bảo toàn điện tích.
Lời giải chi tiết:
- Bảo toàn điện tích cho dung dịch X:
nOH- = nNa+ - 2nSO42- = 0,07 - 2.0,02 = 0,03 mol
- Bảo toàn điện tích cho dung dịch Y:
nH+ = (nCl- + nNO3-) - nNa+ = 0,042 - 0,01 = 0,032 mol
Khi trộn 100 ml X với 100 ml Y có phản ứng: H+ + OH- → H2O
=> nH+ dư = nH+ - nOH- = 0,032 - 0,03 = 0,002 mol
=> [H+] = \(\frac{{{n_{{H^ + }}}}}{{{V_{{\rm{dd}}\,sau\,pu}}}}\) = \(\frac{{0,002}}{{0,1 + 0,1}}\) = 0,01M
=> pH = -log[H+] = 2
Đáp án B
Câu hỏi 3 :
Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
- A 2
- B 6
- C 10
- D 12
Đáp án: D
Phương pháp giải:
Tính toán theo phương trình ion rút gọn: H+ + OH- → H2O
Lời giải chi tiết:
nOH = 2nBa(OH)2 = 0,025 mol; nH = nHCl = 0,02 mol
H+ + OH- → H2O
Bđ: 0,02 0,025
Pư: 0,02 → 0,02
Sau: 0 0,005
=> nOH dư = 0,005 mol
Mặt khác, V dd sau pư = 0,1 + 0,4 = 0,5 lít
=> [OH-] = 0,005 : 0,5 = 0,01M
=> pOH = -log[OH-] = 2 => pH = 14 - pOH = 12
Đáp án D
Câu hỏi 4 :
Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH a mol/l được 500 ml dung dịch có pH = 12. Giá trị a là:
- A 0,2M.
- B 0,13M.
- C 0,12M.
- D 0,1M.
Đáp án: C
Phương pháp giải:
Tính toán theo PT ion rút gọn: H+ + OH- → H2O
Lời giải chi tiết:
nH+ = nHCl + 2nH2SO4 = 0,25.0,08 + 2.0,25.0,01 = 0,025 (mol)
nOH- = nNaOH = 0,25a (mol)
pH = 12 > 7 => OH- dư, H+ phản ứng hết
=> pOH = 14 - 12 = 2 => [OH-] = 10-2M
H+ + OH- → H2O
Bđ: 0,025 0,25a (mol)
Pư: 0,025 → 0,025 (mol)
Sau: 0 0,25a - 0,025 (mol)
Mặt khác, V dd sau pư = 0,25 + 0,25 = 0,5 lít
\( \Rightarrow {\rm{[}}O{H^ - }{\rm{]}} = \frac{{0,25a - 0,025}}{{0,5}} = {10^{ - 2}} \Rightarrow a = 0,12(M)\)
Đáp án C
Câu hỏi 5 :
Trộn 200 ml dung dịch H2SO4 0,05 M với 300 ml dung dịch NaOH 0,06 M. PH của dung dịch thu được là:
- A 2,4
- B 2,9
- C 4,2
- D 4,3
Đáp án: A
Lời giải chi tiết:
Đáp án: A
$${n_{{H_2}S{O_4}}} = 0,01{\rm{ ( mol ) ; }}{{\rm{n}}_{NaOH}}{\rm{ = 0,018 ( mol )}}$$
$${{\rm{n}}_{{H^ + }}}{\rm{ = 2}}{\rm{.0,01 = 0,02 ( mol )}}$$
H2SO4 + 2NaOH → Na2SO4 + H2O
Ban đầu 0,01 mol 0,018 mol
Phản ứng 0,009 mol 0,018 mol
Sau 0,001 mol −
$${n_{{H_2}S{O_4}d}}{\rm{ }} = {\rm{ }}0,001{\rm{ (mol) = > }}{{\rm{n}}_{{H^ + }}}{\rm{ = 2}}{n_{{H_2}S{O_4}d}}{\rm{ = 0,002 (mol) = > [}}{H^ + }{\rm{] = }}{{0,002} \over {(200 + 300){{.10}^{ - 3}}}}{\rm{ }} = {\rm{ }}{4.10^{ - 3}}{\rm{ }}(M)$$
=> pH = −log([H+ ]) = 2,4
Câu hỏi 6 :
Cho 40 ml dung dịch HCl 0,75 M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được là:
- A 10
- B 12
- C 3
- D 2
Đáp án: B
Lời giải chi tiết:
Đáp án: B
$${n_{HCl}} = 0,03{\rm{ ( mol ) ; }}{{\rm{n}}_{Ba{{(OH)}_2}}} = {\rm{ }}0,0128{\rm{ (mol) ; }}{{\rm{n}}_{KOH}}{\rm{ = 0,0064 ( mol )}}$$
$$\sum {{n_{O{H^ - }}}} {\rm{ = 2}}{\rm{.0,0128 + 0,0064 = 0,032 ( mol )}}$$
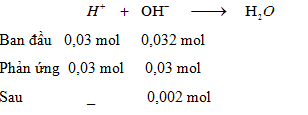
$${n_{O{H^ - }d}}{\rm{ }} = {\rm{ }}0,002{\rm{ (mol) = > }}{{\rm{C}}_M}{\rm{ = }}{{0,002} \over {(40 + 160){{.10}^{ - 3}}}}{\rm{ }} = {\rm{ }}0,01{\rm{ }}(M)$$
=> pH = 14 - log([OH−) = 14 - 2 = 12
Câu hỏi 7 :
Muốn pha chế 300ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là bao nhiêu (trong các số cho dưới đây ( Cho H =1 , O=16 , Na =23 , NaOH phân li hoàn toàn )
- A 1,2.10−3 gam
- B 2,1.10−3gam
- C 1,4.10−3gam
- D 1,3.10−3gam
Đáp án: A
Lời giải chi tiết:
Đáp án: A
PH=10 => [ H+ ] = 10−10 => [ OH− ] = 10−14: 10−10 = 10−4 M
=> nNaOH = 0,3. 10−4 = 3. 10−5 ( mol)
=> mNaOH = 3. 10−5 . 40 = 1,2.10−3 (g)
Câu hỏi 8 :
Cho V lít dung dịch NaOH có pH= 13 tác dụng với dung dịch chứa 0,1 mol AlCl3 thu được 3,9 gam kết tủa trắng keo. Giá trị của V là:
- A 1,5 lít.
- B 3,5 lít.
- C 1,5 lít hoặc 3,5 lít.
- D 1,5 lít hoặc 4,5 lít.
Đáp án: C
Lời giải chi tiết:
Đáp án: C
pH=13 => [ H+] = 10-13 => [ OH−] = 10−14: 10−13 = 0,1 M
\({n_{Al{{(OH)}_3}}} = {\rm{ }}3,9:78{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\)
\(\eqalign{ & 3NaOH{\rm{ }} + {\rm{ }}AlC{l_3}{\rm{ }}\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{}} {\rm{ }}Al{(OH)_3} \downarrow {\rm{ }} + {\rm{ 3}}NaCl{\rm{ (1)}} \cr & NaOH{\rm{ }} + {\rm{ }}Al{(OH)_3}{\rm{ }}\buildrel {} \over \longrightarrow {\rm{ }}NaAl{O_2}{\rm{ }} + {\rm{ 2 }}{H_2}O{\rm{ (2) }} \cr} \)
TH1: chỉ xảy ra phản ứng (1), AlCl3 dư
=> \({n_{NaOH}}{\rm{ }} = {\rm{ }}3{\rm{ }}{n_{Al{{(OH)}_3}}} = {\rm{ }}0,15{\rm{ }}({\rm{ }}mol{\rm{ }})\)
\( = > {V_{NaOH}}{\rm{ }} = {\rm{ }}n:{C_M}{\rm{ }} = {\rm{ }}0,15:0,1{\rm{ }} = {\rm{ 1,5 }}({\rm{ }}l{\rm{ }})\)
TH2: Xảy ra cả (1) và (2)
Theo (1): \({n_{Al{{(OH)}_3}}} = {\rm{ }}{n_{AlC{l_3}}}{\rm{ }} = {\rm{ }}0,1{\rm{ }}(mol){\rm{ }};{\rm{ }}{n_{NaOH(1)}}{\rm{ }} = {\rm{ }}3{\rm{ }}{n_{AlC{l_3}}} = {\rm{ }}0,3{\rm{ }}(mol)\)
\(= > {n_{Al{{(OH)}_3}(2)}} = {\rm{ }}0,1{\rm{ }} - {\rm{ }}0,05{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\)
Theo (2) : \({n_{NaOH(2)}}{\rm{ }} = {\rm{ }}{n_{Al{{(OH)}_3}(2)}}{\rm{ }} = {\rm{ }}0,05{\rm{ }}(mol)\)
\( = > \sum {NaO{H_{(1) + (2)}}{\rm{ }} = {\rm{ }}0,3 + 0,05{\rm{ }} = {\rm{ }}0,35{\rm{ }}(mol){\rm{ }} = > V = n:{C_M}} {\rm{ }} = {\rm{ }}0,35{\rm{ }}:{\rm{ }}0,1{\rm{ }} = {\rm{ }}3,5{\rm{ }}(l)\)
Câu hỏi 9 :
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
- A ${{{{\rm{V}}_1}} \over {{{\rm{V}}_2}}} = {1 \over 1}$
- B ${{{{\rm{V}}_1}} \over {{{\rm{V}}_2}}} = {{11} \over 9}$
- C ????
- D ????
Đáp án: B
Lời giải chi tiết:
Đáp án: B
+ V1 dung dịch axit có PH = 5
$${\rm{ = > [}}{{\rm{H}}^ + }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{{H^ + }}}{\rm{ }} = {\rm{ 1}}{{\rm{0}}^{ - 5}}.{V_1}{\rm{ }}(mol)$$
+ V2 dung dịch bazơ có PH = 9 => pOH = 14− 9 = 5
$${\rm{ = > [O}}{{\rm{H}}^ - }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{O{H^ - }}}{\rm{ }} = {\rm{ }}{10^{ - 5}}.{V_2}{\rm{ (mol)}}$$
+Dung dịch thu được có PH=6 môi trường axit. Vậy H+ dư sau phản ứng
H+ + OH− → H2O
Ban đầu (mol) 10−5V1 10−5V2
Phản ứng ( mol) 10−5V2 10−5V2
Sau (mol) 10−5 (V1 −V2) −
+ Ta có : PH =6 => [H+] dư = 10−6
$${{{{10}^{ - 5}}({V_1} - {\rm{ }}{V_2})} \over {{V_1} + {V_2}}} = {10^{ - 6}} = > {{{V_1}} \over {{V_2}}} = {{11} \over 9}{\rm{ = > B}}$$
Câu hỏi 10 :
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M ( =4,25%)
- A 3 ; 2,37
- B 3 ; 3,9
- C 5; 3,37
- D 4; 3,38
Đáp án: A
Lời giải chi tiết:
Đáp án: A
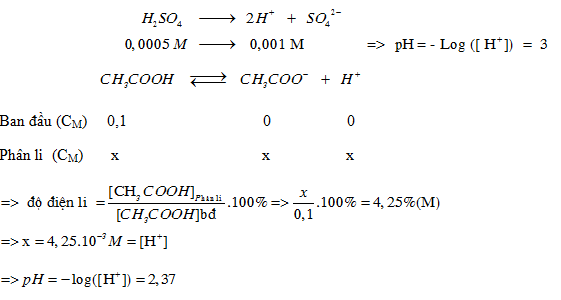
Câu hỏi 11 :
Trộn 50 ml dung dịch HCl 0,12M với 50 ml dung dịch NaOH 0,1M thu được dung dịch X. pH dung dịch X là?
- A 10
- B 2
- C 7
- D 1
Đáp án: B
Lời giải chi tiết:
nH+ = nHCl = 0,006
nOH- = nNaOH = 0,005
Khi pha trộn: H+ + OH- → H2O
=> nH+ dư = 0,001
=> [H+] = 0,001/0,1 = 0,01 => pH = 2
Đáp án B
Câu hỏi 12 :
Dung dịch Ba(OH)2 0,05M có pH là:
- A pH = 13.
- B pH = 2.
- C pH = 1.
- D pH = 12.
Đáp án: A
Phương pháp giải:
[OH-] = 2CM Ba(OH)2 => pOH = -log[OH-] => pH = 14 - pOH
Lời giải chi tiết:
[OH-] = 2CM Ba(OH)2 = 0,1M => pOH = -log(0,1) = 1 => pH = 14 - 1 = 13
Đáp án A
Câu hỏi 13 :
Cho dung dịch X gồm HNO3 và HCl có pH = 1. Trộn V ml dung dịch Ba(OH)2 0,025M với 100 ml dung dịch X thu được dung dịch Y có pH = 2. Giá trị V là:
- A 150.
- B 250.
- C 175.
- D 125.
Đáp án: A
Phương pháp giải:
Tính theo PT ion rút gọn: H+ + OH- → H2O
Lời giải chi tiết:
Dung dịch sau phản ứng có pH = 2 < 7 => H+ dư
nH+ bđ = 0,1.10-1 = 0,01 mol
nOH- bđ = 2nBa(OH)2 = 2.10-3V.0,025 = 5.10-5V (mol)
PT ion: H+ + OH- → H2O
Bđ: 0,01 5.10-5V (mol)
Pư: 5.10-5V ← 5.10-5V (mol)
Sau: 0,01-5.10-5V 0
Dung dịch sau có pH = 2 => \(\left[ {{H^ + }} \right] = \frac{{0,01 - {{5.10}^{ - 5}}V}}{{0,1 + {{10}^{ - 3}}V}} = {10^{ - 2}}\) => V = 150 ml
Đáp án A
Câu hỏi 14 :
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) thu được dung dịch có pH = 6. Tỉ lệ V1/V2 là bao nhiêu?
Phương pháp giải:
Dung dịch axit có pH = 5 => [H+] = 10-5M => nH+ = 10-5V1 (mol)
Dung dịch kiềm có pH = 9 => pOH = 5 => [OH-] = 10-5M => nOH- = 10-5V2 (mol)
Dung dịch sau phản ứng có pH = 6 < 7 => H+ dư, OH- hết
PT ion: H+ + OH- → H2O
Bđ: 10-5V1 10-5V2
Pư: 10-5V2 ← 10-5V2
Sau: 10-5(V1-V2) 0
Từ pH của dung dịch sau phản ứng ta lập được phương trình biểu diễn mối liên hệ giữa V1 và V2 => V1/V2
Lời giải chi tiết:
Dung dịch axit có pH = 5 => [H+] = 10-5M => nH+ = 10-5V1 (mol)
Dung dịch kiềm có pH = 9 => pOH = 5 => [OH-] = 10-5M => nOH- = 10-5V2 (mol)
Dung dịch sau phản ứng có pH = 6 < 7 => H+ dư, OH- hết
PT ion: H+ + OH- → H2O
Bđ: 10-5V1 10-5V2
Pư: 10-5V2 ← 10-5V2
Sau: 10-5(V1-V2) 0
=> \(\left[ {{H^ + }} \right] = \frac{{{{10}^{ - 5}}\left( {{V_1} - {V_2}} \right)}}{{{V_1} + {V_2}}} = {10^{ - 6}}\) => 10(V1 - V2) = V1 + V2 => 9V1 = 11V2
=> V1/V2 = 11/9
Câu hỏi 15 :
Dung dịch H2SO4 0,005M có giá trị pH là bao nhiêu ?
- A 2
- B 12
- C 3
- D 13
Đáp án: A
Phương pháp giải:
[H+] = 2.CM H2SO4 = ? => pH = -log[H+] = ?
Lời giải chi tiết:
[H+] = 2.CM H2SO4 = 0,01M => pH = -log[H+] = -log(0,01) = 2
Đáp án A
Câu hỏi 16 :
Một dung dịch có [OH-] = 0,1.10-6 M. Môi trường của dung dịch này là:
- A Axit.
- B Bazơ.
- C Trung tính.
- D Không xác định được.
Đáp án: C
Lời giải chi tiết:
pH = 14 - log[OH-] = 14 - log[0,1.10-6] = 7
Vậy dung dịch đó có MT trung tính.
Đáp án C
Câu hỏi 17 :
Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a mol/l thu được 200 ml dung dịch có pH = 12. Giá trị của a là
- A 0,03.
- B 0,30.
- C 0,15.
- D 0,12.
Đáp án: D
Phương pháp giải:
Tính số mol H+ có trong dd axit ban đầu theo pH
Lời giải chi tiết:
Hướng dẫn giải :
Dd axit ban đầu có [H+] =0,1 M → nH+=0,1.0,1 =0,01 mol
Dd sau phản ứng có pH = 12 → dư bazo và có pOH =14-12=2 → [OH-] =0,01M→ nOH = 0,002 mol
PTHH: H+ + OH- → H2O
Ta có nNaOH = nH+ + nOH dư = 0,01 + 0,002 = 0,012 mol → a = 0,12M
Đáp án D
Câu hỏi 18 :
Cho 10 ml dung dịch HCl có pH = 3. Cần thêm vào dung dịch này bao nhiêu ml nước để thu được dung dịch có pH = 4.
- A 1ml.
- B 90ml.
- C 10ml.
- D 100ml.
Đáp án: B
Lời giải chi tiết:
nHCl bđ = V. CM = 10.10-3. 10-pH = 10-5
pHsau = 4 => CM sau = 10-4 M
=> Vsau = n : CM = 0,1 lit = 100 ml
=> Vthêm = 100 – 10 = 90 ml
Đáp án B
Câu hỏi 19 :
Cần lấy bao nhiêu gam Ba(OH)2 rắn cho vào 100 ml nước để được dung dịch có pH = 12?
- A 1,71 gam.
- B 0,0855 gam.
- C 0,855 gam.
- D 8,55 gam.
Đáp án: B
Phương pháp giải:
Từ pH xác định được pOH => Nồng độ của OH- => Số mol OH-
Do Ba(OH)2 là chất điện li hoàn toàn nên ta có:
=> nBa(OH)2 = 0,5.nOH- = ?
=> mBa(OH)2 = ?
Lời giải chi tiết:
pH = 12 => pOH = 14 - 12 = 2
=> [OH-] = 10-pOH = 0,01M => nOH- = 0,01.0,1 = 0,001 mol
Do Ba(OH)2 là chất điện li hoàn toàn nên ta có:
=> nBa(OH)2 = 0,5.nOH- = 0,5.0,001 = 0,0005 mol
=> mBa(OH)2 = 0,0005.171 = 0,0855g
Đáp án B
Câu hỏi 20 :
Trộn dung dịch X chứa NaOH 0,1M, Ba(OH)2 0,2M với dung dịch Y chứa HCl 0,2M, H2SO4 0,1M theo tỉ lệ nào về thể tích để dung dịch thu được có pH = 13?
- A VX : VY = 5 : 4.
- B VX : VY = 4 : 5.
- C VX : VY = 5 : 3.
- D VX : VY = 3 : 5.
Đáp án: A
Phương pháp giải:
nOH- = nNaOH + 2nBa(OH)2 = 0,1VX + 2.0,2VX = 0,5VX (mol)
nH+ = nHCl + 2nH2SO4 = 0,2VY + 2.0,1VY = 0,4VY (mol)
Từ giá trị pH tính được nồng độ của OH-
H+ + OH- → H2O
Bđ: 0,4VY 0,5VX
Pư: 0,4VY → 0,4VY
Sau: 0 0,5VX - 0,4VY
=> \(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{{{V_X} + {V_Y}}} \Leftrightarrow \frac{{0,5{V_X} - 0,4{V_Y}}}{{{V_X} + {V_Y}}} = 0,1\)
=> VX : VY = ?
Lời giải chi tiết:
nOH- = nNaOH + 2nBa(OH)2 = 0,1VX + 2.0,2VX = 0,5VX (mol)
nH+ = nHCl + 2nH2SO4 = 0,2VY + 2.0,1VY = 0,4VY (mol)
Ta thấy: pH = 13 > 7 => OH- dư, H+ hết
=> pOH = 14 - 13 = 1 => [OH-] = 10-1 = 0,1M
H+ + OH- → H2O
Bđ: 0,4VY 0,5VX
Pư: 0,4VY → 0,4VY
Sau: 0 0,5VX - 0,4VY
=> \(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{{{V_X} + {V_Y}}} \Leftrightarrow \frac{{0,5{V_X} - 0,4{V_Y}}}{{{V_X} + {V_Y}}} = 0,1\)
=> 0,5VX - 0,4VY = 0,1VX + 0,1VY
=> 0,4VX = 0,5VY
=> VX : VY = 5 : 4
Đáp án A
20 bài tập vận dụng về tính pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
10 bài tập vận dụng cao về tính pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
40 bài tập lý thuyết về sự điện li của nước - pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









