10 bài tập vận dụng cao về tính pH có lời giải (phần 1)
Làm đề thiCâu hỏi 1 :
Tính pH của dung dịch thu được khi trộn 40 ml dung dịch HCl 2,5.10-2 M với 60 ml dung dịch CH3COOH 1,67.10-4 M.Biết CH3COOH có Ka=10-4,76.
- A 2
- B 2,87
- C 3,05
- D 5,04
Đáp án: A
Lời giải chi tiết:
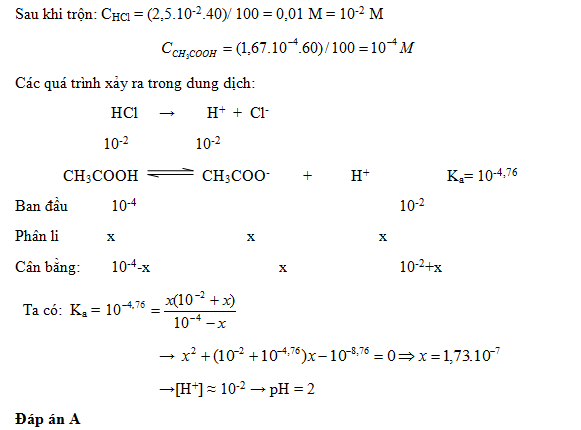
Câu hỏi 2 :
Tính pH của dung dịch gồmNaOH 10-3M và NH3 10-2M (NH3 có Kb = 1,8.10-5 )
- A 11,00
- B 12,87
- C 11,06
- D 12,04
Đáp án: C
Lời giải chi tiết:
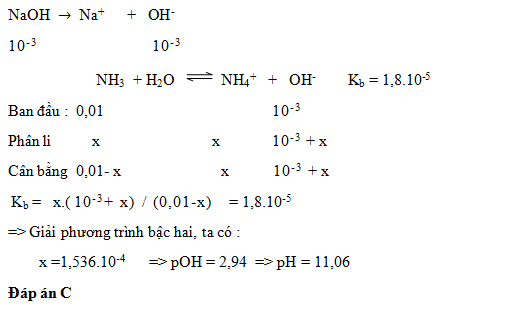
Câu hỏi 3 :
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
- A ${{{{\rm{V}}_1}} \over {{{\rm{V}}_2}}} = {1 \over 1}$
- B ${{{{\rm{V}}_1}} \over {{{\rm{V}}_2}}} = {{11} \over 9}$
- C ????
- D ????
Đáp án: B
Lời giải chi tiết:
Đáp án: B
+ V1 dung dịch axit có PH = 5
$${\rm{ = > [}}{{\rm{H}}^ + }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{{H^ + }}}{\rm{ }} = {\rm{ 1}}{{\rm{0}}^{ - 5}}.{V_1}{\rm{ }}(mol)$$
+ V2 dung dịch bazơ có PH = 9 => pOH = 14− 9 = 5
$${\rm{ = > [O}}{{\rm{H}}^ - }{\rm{] }} = {\rm{ }}{10^{ - 5}}M = > {\rm{ }}{n_{O{H^ - }}}{\rm{ }} = {\rm{ }}{10^{ - 5}}.{V_2}{\rm{ (mol)}}$$
+Dung dịch thu được có PH=6 môi trường axit. Vậy H+ dư sau phản ứng
H+ + OH− → H2O
Ban đầu (mol) 10−5V1 10−5V2
Phản ứng ( mol) 10−5V2 10−5V2
Sau (mol) 10−5 (V1 −V2) −
+ Ta có : PH =6 => [H+] dư = 10−6
$${{{{10}^{ - 5}}({V_1} - {\rm{ }}{V_2})} \over {{V_1} + {V_2}}} = {10^{ - 6}} = > {{{V_1}} \over {{V_2}}} = {{11} \over 9}{\rm{ = > B}}$$
Câu hỏi 4 :
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M ( =4,25%)
- A 3 ; 2,37
- B 3 ; 3,9
- C 5; 3,37
- D 4; 3,38
Đáp án: A
Lời giải chi tiết:
Đáp án: A
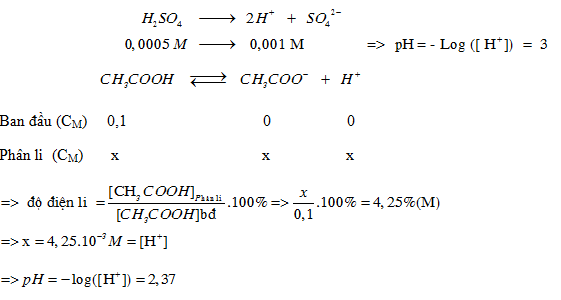
Câu hỏi 5 :
Trộn 300ml dung dịch có pH = 2 gồm HCl và HNO3với 300ml dung dịch NaOH nồng độ a (mol/l) thu được 600 ml dung dịch có pH = 11. Giá trị của a là:
- A 0,012
- B 0,021
- C 0,018
- D 0,024
Đáp án: A
Phương pháp giải:
+ Tính ∑nH+ ;
+ pH >7 => dư bazơ
+ pH = x => [H+] = 10-x
+ Viết phương trình ion rút gọn: H+ + OH- → H2O
+ Tính toán theo phương trình
Lời giải chi tiết:
pH = 11 => OH- dư sau phản ứng => pOH =3
\( = > {{\text{[O}}{{\text{H}}^{\text{ - }}}{\text{]}}_{{\text{sau}}}}{\text{ = 1}}{{\text{0}}^{{\text{ - 3}}}}{\text{ = }}\frac{{{n_{O{H^ - }sau}}}}{{{V_{sau}}}}\)
=> nOH- sau = Vsau . [OH-] = 10-3. 0,6= 0,0006 = 6.10-4 (mol)
pH = 2 => [H+]= 10-2 = 0,01M => nH+= 0,3 . 0,01= 0,003
nOH- = 0,3.a
H+ + OH- → H2O
Ban đầu: 0,003 0,3.a
Phản ứng: 0,003 0,003
Sau: 0 0,3.a-0,003
nOH- sau= 6.10-4 = 0,3a -0,003 => a=0,012M
Đáp án A
Câu hỏi 6 :
Trộn 150ml dung dịch có pH = 3 gồm HCl và HNO3với 150ml dung dịch NaOH nồng độ a (mol/l) thu được 300 ml dung dịch có pH = 5. Giá trị của a là:
- A 9,8.10-5
- B 9,8.10-4
- C 9,8.10-3
- D 9,8.10-6
Đáp án: B
Phương pháp giải:
+ Tính ∑nH+ ;
+ pH < 7 => dư axit
+ pH = x => [H+] = 10-x
+ Viết phương trình ion rút gọn: H+ + OH- → H2O
+ Tính toán theo phương trình
Lời giải chi tiết:
pHsau = 5 => H+ dư sau phản ứng
\({{\text{[}}{H^ + }{\text{]}}_{sau}} = {10^{ - 5}} = \frac{{{n_{{H^ + }sau}}}}{{{V_{sau}}}}\)
=> nH+ sau = Vsau . [H+] = 10-5. 0,3= 3.10-6 (mol)
pH = 3 => [H+]= 10-3 = 0,001M => nH+= 0,15 . 0,001= 1,5 . 10-4
nOH- = 0,15.a
\({H^ + } + O{H^ - } \to {H_2}O\)
Ban đầu: 1,5 .10-4 0,15.a
Phản ứng: 0,15a 0,15a
Sau: 1,5.10-4-0,15a 0
nH+ sau= 3.10-6 = 1,5.10-4 - 0,15a => a=9,8.10-4M
Đáp án B
Câu hỏi 7 :
Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1M và CH3COONa 0,1M, Biết ở 25oC, Ka của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25oC là:
- A 1,00
- B 4,24
- C 2,88
- D 4,757
Đáp án: D
Phương pháp giải:
Ka = [CH3COO-][H+]/[CH3COOH]
Lời giải chi tiết:
CH3COONa → CH3COO- + Na+
0,1 0,1
CH3COOH ↔ CH3COO- + H+ Ka = 1,75.10-5
Bđ: 0,1 0,1
Phân li:x x x
CB: 0,1-x 0,1+x x
Ka = [CH3COO-][H+]/[CH3COOH] => (0,1+x).x/(0,1-x)= 1,75.10-5 => x = 1,7493878.10-5
=> pH = -logx = 4,757
Đáp án D
Câu hỏi 8 :
Thêm nước vào 10,0ml axit axetic băng (axit 100%; D=1,05g/ml) đến thể tích 1,75 lít ở 25oC, dùng máy đo thì thấy pH=2,9. Độ điện li α và hằng số cân bằng Ka của axit axetic ở nhiệt độ đó là
- A 1,24% và 1,6.10-5
- B 1,24% và 2,5.10-5
- C 1,26% và 2,8.10-5
- D 1,26% và 3,2.10-4
Đáp án: C
Lời giải chi tiết:
mCH3COOH = D.V = 1,05.10 = 10,5 gam=>nCH3COOH = 10,5/60 = 0,175 mol
pH = 2,9 => [H+] = 10-2,9 => nH+ = 10-2,9.1,75 = 0,0022 mol
CH3COOH ↔ CH3COO- + H+
Bđ: 0,175
Pli: 0,175α 0,175α 0,175α =0,0022
CB: 0,175(1- α) 0,175α 0,175α
=> α = 1,26%
Ka = [CH3COO-][H+]/[CH3COOH] = 0,00222/(0,175-0,0022) = 2,8.10-5
Đáp án C
Câu hỏi 9 :
Có V lít dung dịch NaOH pH = 12. Khi pha loãng dung dịch này 10 lần ( thêm 9V H2O vào ) thì dung dịch thu được có pH bằng
- A 11
- B 10
- C 13
- D 12
Đáp án: A
Phương pháp giải:
Có pH +pOH = 14 → pOH = 2 → [NaOH]
Khi pha loãng dung dịch đi 10 lần thì [NaOH] mới = 1/10 .[NaOH]cũ → pOH =? → giá trị của pH
Lời giải chi tiết:
Có pH +pOH = 14 → pOH = 2 → [NaOH] = 10-2 = 0,01M
Khi pha loãng dung dịch đi 10 lần thì [NaOH] mới = 1/10 .[NaOH]cũ = 1/10.0,01 = 0,001 M
→ pOH = - log 0,001 = 3 → pH = 11
Đáp án A
Câu hỏi 10 :
Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dung dịch Ba(OH)2 a mol/l thu được m gam kết tủa và 500 ml dung dịch có pH = 12. Giá trị của m và a là
- A 0,5825 gam và 0,06M.
- B 1,97 gam và 0,01M.
- C 0,5875 gam và 0,04M.
- D 0,5626 gam và 0,05M.
Đáp án:
Phương pháp giải:
- Dựa vào số mol các chất ban đầu tính được số mol các ion: H+, OH- (theo a), SO42-, Ba2+ (theo a).
- Dung dịch sau phản ứng có pH = 12 > 7 → OH- dư, H+ phản ứng hết
Tính được nồng độ của OH- sau phản ứng.
- Tính toán theo PT ion rút gọn tìm được giá trị của a.
- Xét phản ứng của ion Ba2+ và SO42- tính được khối lượng kết tủa BaSO4.
Lời giải chi tiết:
Tính được:
\({n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}} = 0,025(mol)\)
\({n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} = 0,5{\rm{a}}(mol)\)
\({n_{S{O_4}^{2 - }}} = {n_{{H_2}S{O_4}}} = 0,0025(mol)\)
\({n_{B{a^{2 + }}}} = {n_{Ba{{(OH)}_2}}} = 0,25{\rm{a}}(mol)\)
Dung dịch sau phản ứng có pH = 12 > 7 → OH- dư, H+ phản ứng hết
→ pOH = 14 - pH = 2 → [OH-] = 10-2 = 0,01M
PT ion: H+ + OH- → H2O
Bđ: 0,025 0,5a (mol)
Pư: 0,025 → 0,025 (mol)
Sau: 0 0,5a-0,025 (mol)
Ta có: \({\rm{[}}O{H^ - }{\rm{]}} = \frac{{0,5{\rm{a}} - 0,025}}{{0,5}} = 0,01 \to a = 0,06\)
\( \to {n_{B{a^{2 + }}}} = 0,25{\rm{a}} = 0,015(mol);{n_{S{O_4}^{2 - }}} = 0,0025(mol)\)
PT ion: Ba2+ + SO42- → BaSO4 ↓
Bđ: 0,015 0,0025 (mol)
Pư: 0,0025 ← 0,0025 → 0,0025 (mol)
→ m = 0,0025.233 = 0,5825 gam
Đáp án A
20 bài tập vận dụng về tính pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
20 bài tập vận dụng về tính pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
40 bài tập lý thuyết về sự điện li của nước - pH có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









