Đề số 13 - Đề kiểm tra học kì 1 - Hóa học 10
Đáp án và lời giải chi tiết Đề số 13 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 10
Đề bài
Câu 1. Cho sơ đồ: \(Fe \to F{e^{3 + }} + 3e.\) Sơ đồ trên biểu diễn
A.quá trình khử.
B.quá trình oxi hóa.
C.quá trình nhận e.
D.quá trình trao đổi.
Câu 2. Trong một nhóm A của bảng tuần hoàn, khi đi từ trên xuống dưới thì điều khẳng định đúng là
A.bán kính nguyên tử giảm dần.
B.độ âm điện tăng dần.
C.bán kính nguyên tử tăng dần.
D.tính kim loại giảm dần.
Câu 3. Sắt là nguyên tố quan trọng cấu tạo nên Helmoglobin, một dạng protein- thành phần chính tạo nên hồng cầu. Chính sắt có trong helmoglobin làm nên màu đỏ của máu, một thành phần quan trọng của cơ thể. Cấu hình của electron 26Fe là
A. 1s22s22p63s23p64s23d6.
B. 1s22s22p63s23p63d84s2.
C. 1s22s22p63s23p63d10.
D. 1s22s22p63s23p63d64s2.
Câu 4. Cation R+ có cấu tạo như hình vẽ. Vị trí của R trong bảng tuần hoàn là
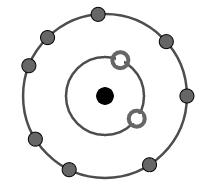
A.chu kì 3, nhóm VIIA.
B.chu kì 3, nhóm IA.
C.chu kì 4, nhóm IA.
D.chu kì 3, nhóm VIA.
Câu 5. Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành y tế - dược phẩm. Thành phần chính của nước đá khô là CO2, hãy chỉ ra nhận định sai trong các câu sau:
A.Liên kết giữa các nguyên tử oxi và cacbon thuộc loại liên kết cộng hóa trị phân cực.
B.Trong phân tử có hai liên kết đôi.
C.Phân tử CO2 không phân cực.
D.Phân tử có cấu tạo góc.
Câu 6. Độ âm điện của một nguyên tử
A.là khả năng hai chất phản ứng với nhau mạnh hay yếu.
B.là khả năng nhường electron ở lớp ngoài cùng cho nguyên tử khác.
C.đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
D.là khả năng nhận electron để trở thành anion.
Câu 7. Cho các phát biểu sau:
1.Số proton trong hạt nhân nguyên tử bằng số electron ở vỏ nguyên tử.
2.Trong hạt nhân nguyên tử, số proton bằng số nơtron.
3.Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử.
4.Chỉ có hạt nhân nguyên tử lưu huỳnh mới có 16 nơtron.
Các phát biểu đúng là
A.1, 2. B.1, 3.
C.2, 4. D.3, 4.
Câu 8. Nitơ chiếm khoảng 78% khí quyển Trái Đất và là thành phần của mọi cơ thể sống. Nito có trong mọi sinh vật dưới dạng hợp chất hữu cơ phức tạp như protein, axit nuleic và kích thích tố, chất màu của máu... Trong cơ thể người ta chứa khoảng 3% nitơ theo trọng lượng, là nguyên tố phổ biến thứ tư trong cơ thể sau oxi, cacbon và hiđro. Nitơ trong tự nhiên là hỗn hợp của hai đồng vị \({}_7^{15}N,{}_7^{14}N\) với tỉ lệ là 1:272. Nguyên tử khối trung bình của nitơ là
A.14,002. B.14,003.
C.14,004. D.14,005.
Câu 9. Nguyên tố hóa hcoj A có số hiệu nguyên tử là 20, chu kì 4, nhóm IIA. Điều nhận xét nào sau đây là sai?
A.Số electron ở lớp vỏ của nguyên tử nguyên tố A là 20.
B.Lớp vỏ của nguyên tử nguyên tố A có 4 lớp electron và lớp ngoài cùng có 2 electron.
C.Hạt nhân nguyên tử của nguyên tố A có 20 proton.
D.Nguyên tố hóa học này là một phi kim.
Câu 10. Lưu huỳnh là một phi kim phổ biến, không mùi, không vị, nhiều hóa trị. Lưu huỳnh, trong dạng gốc của nó là chất rắn kết tinh màu vàng chanh. Trong tự nhiên, nó có thể tìm thấy ở dạng đơn chất hoặc dạng hợp chất như các muối sunfua và sunfat... Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp như điều chế H2SO4, lưu hóa cao su, chế thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm... Trong phản ứng hóa học, 1 nguyên tử luu huỳnh (S) chuyển thành ion sunfua (S2-) bằng cách
A.nhường đi hai electron.
B.nhận thêm hai electron.
C.nhường đi một electron.
D.nhận thêm một electron.
Câu 11. Tính chất nào dưới đây là tính chất của hợp chất ion?
A.Hợp chất ion có nhiệt độ nóng chảy thấp.
B.Hợp chất ion có nhiệt độ nóng chảy cao.
C.Hợp chất ion dễ hóa lỏng.
D.Hợp chất ion có nhiệt độ sôi không xác định.
Câu 12. Trong phản ứng nào HCl đóng vai trò là chất oxi hóa?
\(\eqalign{ & A.Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O. \cr & B.Fe{\left( {OH} \right)_3} + 3HCl \to FeC{l_3} + 3{H_2}O. \cr & C.AgN{O_3} + HCl \to AgCl \downarrow + HN{O_3}. \cr & D.Zn + 2HCl \to ZnC{l_2} + {H_2}. \cr} \)
Câu 13. Dãy chất nào sau đây được sắp xếp theo chiều tăng dần về độ phân cực liên kết?
A. H2O, H2Te, H2Se, H2S.
B. H2O, H2S, H2Se, H2Te.
C. H2Te, H2Se, H2S, H2O.
D. H2Se, H2S, H2O, H2Te.
Câu 14. Khẳng nào sau đây là đúng khi nói về nhóm IA?
A.Dễ dàng nhường đi 2 electron ở lớp ngoài cùng để đạt cấu hình bền của khí hiếm.
B.Được gọi là nhóm kim loại kiềm thổ.
C. Dễ dàng nhường đi 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm.
D.Dễ dàng nhận thêm 1 electron nên có điện hóa trị -1 trong các hợp chất.
Câu 15. Trong hợp chất Na2SO4, điện tích hóa trị của Na là
A.1. B.+1.
C.2+. D.1+.
Câu 16. Cho X, Y, R, T là nguyên tố khác nhau tron số bốn nguyên tố: 12Mg, 13Al, 19K, 20Ca và các chất được ghi trong bảng sau:
|
Nguyên tố |
X |
Y |
R |
T |
|
Bán kính nguyên tử (nm) |
0,174 |
0,125 |
0,203 |
0,136 |
Nhận xét nào sau đây đúng?
A.X là Al. B.T là Mg.
C. R là Ca. D.Y là Ca.
Câu 17. Cho số hiệu nguyên tử của các nguyên tố: Mg (Z=12), Al (Z=13), K (Z=19), Ca (Z=20). Tính bazo của các hiđroxit nào sau đây lớn nhất?
A.KOH. B.Ca(OH)2.
C.Mg(OH)2. D.Al(OH)3.
Câu 18. Phát biểu nào dưới đây là đúng?
A.Electron ở phân lớp 4p có mức năng lượng thấp hơn phân lớp 4s.
B.Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C.Các electron trong cùng một lớp có năng lượng bằng nhau.
D.Những electron ở lớp K có mức năng lượng thấp nhất.
Câu 19. Cho các ion sua: Mg2+, SO42-, Al3+, S2-, Na+, Fe3+, NH4+, CO32-, Cl-. Số cation đơn nguyên tử là
A.4. B.5.
C.3. D.2.
Câu 20. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là
A.N. B.P.
C.Cl. D.F.
Câu 21. Cho số hiệu nguyên tử của các nguyên tố O, K, Ca, Fe lần lượt là 8, 19, 20, 26. Cấu hình electron của ion nào sau đây không giống cấu hình của khí hiếm?
A.O2-. B.Ca2+.
C.Fe2+. D.K+.
Câu 22. Cho 8,3 gam Al và Fe tác dụng với HNO3 thu được 13,44 lít khí NO2 (đktc). Thành phần phần trăm về khối lượng của Al trong hỗn hợp là
A.35,5%. B.32,53%. C.67,17%. D.56,15%.
Câu 23. Cho các phương trình phản ứng
\(\eqalign{ & \left( a \right)2Fe + 3C{l_2} \to 2FeC{l_3}; \cr & \left( b \right)NaOH + HCl \to NaCl + {H_2}O; \cr & \left( c \right)2Na + 2{H_2}O \to 2NaOH + {H_2}; \cr & \left( d \right)AgN{O_3} + NaCl \to AgCl + NaN{O_3} \cr} \)
Trong các phản ứng trên, số phản ứng oxi hóa – khử là
A.2. B.4.
C.1. D.3.
Câu 24. Cho 2 gam một kim loại nhóm IIA tác dụng với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là
A.Be. B.Ba.
C.Ca. D.Mg.
Câu 25. Cho phản ứng hóa học sau:
\(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl.\)
Nhận xét đúng về vai trò của các chất tham gia phản ứng trên là:
A.SO2 là chất oxi hóa, Cl2 là chất khử.
B.SO2 là chất khử, H2O là chất oxi hóa.
C.Cl2 là chất oxi hóa, H2O là chất khử.
D.Cl2 là chất oxi hóa, SO2 là chất khử.
Câu 26. Biết X là kim loại nhóm IA. Hòa tan m gam kim loại X vào 30 gam nước thì thoát ra 2,8 lít khí (đktc) và dung dịch sau phản ứng có C% = 35,44%. X là?
Câu 27. Trong tự nhiên clo có hai đồng vị bền \({}_{17}^{37}Cl,{}_{17}^{35}Cl\) . Nguyên tử khối trung bình của clo là 35,5. Thành phần trăm về khối lượng của 35Cl trong muối kali clorat KClO3 là
A.7,25%. B.21,74%.
C.28,98%. D.9,24%.
Câu 28. Dãy gồm các hợp chất chứa liên kết ion là
A. NaCl, CaF2, H2, HCl.
B.KCl, CaO, CaF2, NaBr.
C.NaCl, CaF2, NaBr, HCl.
D.NaCl, CaF2, CO2, NaBr.
Câu 29. Cho biết \({\chi _{Si}} = 1,9;{\chi _H} = 2,2.\) Loại liên kết được hình thành trong phân tử SiH4 là
A.liên kết cộng hóa trị không phân cực.
B.liên kết ion.
C.liên kết cộng hóa trị có phân cực.
D.liên kết đơn.
Câu 30. Phân tử nào sau đây có liên kết cộng hóa trị phân cực mạnh nhất?
A.CH4. B.N2.
C.H2. D.HCl.
Lời giải chi tiết
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
B |
C |
D |
B |
D |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
C |
B |
C |
D |
B |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
B |
D |
C |
C |
D |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
B |
A |
D |
A |
A |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
C |
B |
A |
C |
D |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
A |
B |
B |
A |
D |
Câu 4:
Từ hình ảnh về sự sắp xếp các electron của ion R+ ta thấy:
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
Do vậy cấu hình electron của ion R+ là: 1s22s22p6.
\(\eqalign{ & {\rm{ R}} \to {\rm{1e + }}{{\rm{R}}^ + } \cr & 1{s^2}2{s^2}2{p^6}3{s^1}{\rm{ }} \leftarrow {\rm{ }}1{s^2}2{s^2}2{p^6} \cr} \)
Vị trí của R: chu kì 3 (do có 3 lớp electron); nhóm IA (do có 1 electron ở lớp ngoài cùng và là nguyên tố s)
Đáp án B
Câu 5:
Công thức electron của phân tử CO2 O : : C : : O
Công thức cấu tạo O = C = O
Vậy: + Trong phân tử có hai liên kết đôi
+ \({\chi _O} > {\chi _C}\) nên liên kết giữa nguyên tử O và C là liên kết cộng hóa trị phân cực.
Tuy nhiên phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O)
Triệt tiêu nhau kết quả là toàn bộ phân tử không bị phân cực.
Đáp án D
Câu 7:
1.Số proton trong hạt nhân nguyên tử bằng số electron ở vỏ nguyên tử: Đúng.
2.Trong hạt nhân nguyên tử, số proton bằng số nơtron: Sai, vì khong tất cả các nguyên tử của các nguyên tố đều có số proton bằng nơtron.
3.Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử: Đúng.
4.Chỉ có hạt nhân nguyên tử lưu huỳnh mới có 16 nơtron: Sai, vì một nguyên tử khác cũng có 16 nơtron như photpho...
Đáp án B
Câu 9:
Số hiệu nguyên tử là 20\( \Rightarrow \) có 20 electron.
Chu kì 4 \( \Rightarrow \) có 4 lớp electron.
Nhóm IIA \( \Rightarrow \) có 2 electron ở lớp ngoài cùng.
Vậy cấu hình electron của A là: 1s22s22p63s23p64s2
Các nhận xét
A.Số electron ở lớp vỏ của nguyên tử nguyên tố A là 20: Đúng.
B.Lớp vỏ của nguyên tử nguyên tố A có 4 lớp electron và lớp ngoài cùng có 2 electron: Đúng.
C.Hạt nhân nguyên tử của nguyên tố A có 20 proton: Đúng.
D.Nguyên tố hóa học này là một phi kim: Sai, vì có 2 electron lớp ngoài cùng nên A là nguyên tố kim loại>
Đáp án D
Câu 16.
+ Mg, Al cùng thuộc chu kì 3 của bảng tuần hoàn \( \Rightarrow \) bán kính nguyên tử Mg > Al. (1)
+ K, Ca cùng thuộc chu kì 4 của bảng toàn hoàn\( \Rightarrow \) bán kính nguyên tử K > Ca. (2)
+ Mg, Ca cùng thuộc nhóm IIA của bảng tuần hoàn\( \Rightarrow \) bán kính nguyên tử của Mg < Ca. (3)
Từ (1), (2), (3) \( \Rightarrow \) bán kính nguyên tử sắp xếp theo độ tăng dần là: Al < Mg < Ca < K
Đáp án B
Câu 17:
+ Mg, Al cùng thuộc chu kì 3\( \Rightarrow \) tính kim loại của Mg > Al. (1)
+ K, Ca cùng thuộc chu kì 4\( \Rightarrow \) tính kim loại của K > Ca. (2)
+ Mg, Ca cùng thuộc nhóm IIA\( \Rightarrow \) tính kim loại của Mg < Ca. (3)
Từ (1), (2), (3) \( \Rightarrow \) tính kim loại sắp xếp theo thứ tự tăng dần là: Al < Mg < Ca < K.
Do vậy tính bazơ của hiđroxit cũng tăng theo thứ tự
\(Al{\left( {OH} \right)_3} + Mg{\left( {OH} \right)_2} < Ca{\left( {OH} \right)_2} < KOH\)
Đáp án A
Câu 18:
A.Electron ở phân lớp 4p có mức năng lượng thấp hơn phân lớp 4s: Sai, vì mức năng lượng của phân lớp 4p cao hơn phân lớp 4s.
B.Những electron ở gần hạt nhân có mức năng lượng cao nhất: Sai, vì electron càng ở gần hạt nhân thì mức năng lượng càng thấp.
C.Các electron trong cùng một lớp có năng lượng bằng nhau: Sai, vì các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
D.Những electron ở lớp K có mức năng lượng thấp nhất: Đúng.
Đáp án D
Câu 20:
Công thức hợp chất khí tạo bởi R và hiđro là RH3 nên công thức oxit cao nhất của R là R2O5.
\(\% O = \dfrac{{5.16}}{{2.{M_R} + 5.16}}.100 \Rightarrow {M_R} = 4\)
Đáp án A
Câu 22:
\({n_{N{O_2}}} = \dfrac{V}{{22,4}} = \dfrac{{13,44}}{{22,4}} = 0,6\left( {mol} \right)\)
Gọi x, y lần lượt là số mol của Al và Fe trong hỗn hợp.
Các quá trình xảy ra:
\(\eqalign{ & Al \to A{l^{3 + }} + 3e{\rm{ }}\;\;\;\;\;\;\;{{\rm{N}}^{ + 5}} + 1e \to {N^{ + 4}} \cr & x{\rm{ }} \to\;\;\;\;\;\;\;\;\;\; {\rm{ 3x mol }} \;\;\;\;\;\;\;\;\;\;\;\;\;0,6\leftarrow {\rm{0,6 mol}} \cr & {\rm{Fe}} \to {\rm{F}}{{\rm{e}}^{3 + }} + 3e \cr & y{\rm{ }} \to \;\;\;\;\;\;\;\;\;\;{\rm{ 3y mol}} \cr} \)
Áp dụng định luật bảo toàn electron ta có: 3x + 3y = 0,6 (1)
Mặt khác \({m_{hh}} = {m_{Al}} + {m_{Fe}} \)
\(\Rightarrow 27x + 56y = 8,3\left( 2 \right)\)
Từ (1) và (2) ta có:
\(\eqalign{ & \left\{ \matrix{ 3x + 3y = 0,6 \hfill \cr 27x + 56y = 8,3 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ x = 0,1 \hfill \cr y = 0,1 \hfill \cr} \right. \cr & \Rightarrow \left\{ \matrix{ {m_{Al}} = 0,1.27 = 2,7\left( {gam} \right) \hfill \cr {m_{Fe}} = 0,1.56 = 5,6\left( {gam} \right) \hfill \cr} \right. \cr & \to \% {m_{Al}} = {{2,7} \over {8,3}}.100 = 32,53\% \cr} \)
Đáp án B
Câu 24:
Gọi kim loại cần tìm là M. Vì M thuộc nhóm IIA nên M có hóa trị II.
Phương trình hóa học:
\(M + 2HCl \to MC{l_2} + {H_2}\)
1mol M phản ứng tạo thành 1 mol muối MCl2 có khối lượng tăng là: \(\Delta m = 71\left( {gam} \right)\)
X mol M phản ứng tạo thành x mol MCl2 có khối lượng tăng lên là: 5,55 – 2 = 3,55(gam)
Vậy
\(\eqalign{ & x = {{3,55} \over {71}} = 0,05\left( {mol} \right) \cr & \Rightarrow M = {m \over n} = {2 \over {0,05}} = 40\left( {g/mol} \right) \cr} \)
Nguyên tố cần tìm là Ca
Đáp án C
Câu 25:
\(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl\)
Trong phản ứng trên:
+ số oxi hóa của S tăng lên từ +4 (trong SO2) \( \to \) +6 (trong H2SO4) nên SO2 đóng vai trò là chất khử.
+ số oxi hóa của clo giảm từ 0 (trong Cl2) \( \to \) -1 (trong HCl) nên Cl2 đóng vai trò là chất oxi hóa.
Đáp án D
Câu 26:
\({n_{{H_2}}} = {V \over {22,4}} = {{2,8} \over {22,4}} = 0,125\left( {mol} \right)\)
Phương trình hóa học
\(\eqalign{ & X + {H_2}O \to XOH + {1 \over 2}{H_2} \cr & 0,25{\rm{ }} \leftarrow {\rm{ 0,25}} \leftarrow {\rm{0,125 mol}} \cr} \)
Khối lượng dung dịch sau phản ứng là
\(\eqalign{ & {m_{{\rm{dd}}}} = {m_{kl}} + {m_{{H_2}O}} - {m_{{H_2}}} \cr & {\rm{ }}\;\;\;\;\;\; = 0,25.{M_X} + 30 - 0,125.2 \cr & {\rm{ }}\;\;\;\;\;\; = 0,25.{M_X} + 29,75. \cr & C{\% _{KOH}} = {{0,25.\left( {{M_X} + 17} \right)} \over {0,25.{M_X} + 29,75}}.100 = 35,44\cr& \Rightarrow {M_X} = 39\left( {g/mol} \right) \cr} \)
Đáp án A
Câu 27:
Gọi x, y lần lượt là thành phần phần trăm của các đồng vị 37Cl và 35Cl \( \Rightarrow x + y = 100\left( 1 \right)\)
Ta có: \(\overline {{M_{Cl}}} = \dfrac{{37.x + 35.y}}{{x + y}}\)
\(\Rightarrow 35,5.100 = 37x + 35y\left( 2 \right)\)
Từ (1) và (2) \( \Rightarrow x = 25,y = 75\)
Thành phần phần trăm của clo trong hợp chất KClO3 là
\(\% Cl = \dfrac{{35,5}}{{39 + 35,5 + 16.3}}.100 = 28,98\% {\text{ }}\)
Vậy thành phần phần trăm của 35Cl trong muối KClO3 là
\({\% ^{35}}Cl = \dfrac{{75.28,9}}{{100}} = 21,74\)
Đáp án B.
Loigiaihay.com
Các bài khác cùng chuyên mục













Danh sách bình luận