 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Đề số 1 - Hóa học 10
Đáp án và lời giải chi tiết Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Đề số 1 - Hóa học 10
Đề bài
Câu 1. Số oxi hóa của nitơ trong NH4+, NO2, HNO3 lần lượt là
A.+5, -3, +3. B.+3, -3, +5.
C.+3, +5, -3. D.-3, +4, +5.
Câu 2. Điện hóa trị các nguyên tố nhóm VIA, VIIA trong các hợp chất với natri có giá trị
A.6+ và 7+. B.-2 và -1.
C.2- và 1-. D.+6 và +7.
Câu 3. Trong phản ứng oxi hóa khử sau:
\({H_2}S + KMn{O_4} + {H_2}S{O_4} \to \)\(\,S + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Hệ số của các chất tham gia phản ứng lần lượt là
A.5, 2, 4. B.5, 2, 3.
C.2, 2, 5. D.3, 2, 5.
Câu 4. Trong hóa học vô cơ, phản ứng hóa học nào có số oxi hóa của các nguyên tố luôn không đổi?
A. Phản ứng trao đổi.
B. Phản ứng hóa hợp.
C. Phản ứng phân hủy.
D. Phản ứng thế.
Câu 5. Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi phản ứng kết thúc các phản ứng lọc bỏ phần dung dịch, thu được m gam bột rắn. Thành phần phần trăm theo khối lượng của Zn trong hỗn hợp ban đầu là
A.12,67% B.85,30%.
C.90,27%. D.82,20%.
Câu 6. Cho các phản ứng:
\(\eqalign{ & 2Fe + 3C{l_2} \to 2FeC{l_3}{\rm{ }}\left( 1 \right) \cr & 2Al{\left( {OH} \right)_3} \to A{l_2}{O_3} + 3{H_2}O{\rm{ }}\left( 2 \right) \cr & CaS{O_3} + {H_2}S{O_4} \to CaS{O_4} + {H_2}O + S{O_2} \uparrow {\rm{ }}\left( 3 \right) \cr & Cu + 2AgN{O_3} \to 2Ag \downarrow + Cu{\left( {N{O_3}} \right)_2}{\rm{ }}\left( 4 \right) \cr & S{O_3} + {H_2}O \to {H_2}S{O_4}{\rm{ }}\left( 5 \right) \cr} \)
Các phản ứng oxi hóa khử là
A.(1) và (4). B.(4) và (5).
C.(1) và (3). D.(2) và (4).
Câu 7. Phản ứng \(F{e_x}{O_y} + {H_2}S{O_4}{\rm{ }}d/n \to F{e_2}{\left( {S{O_4}} \right)_3} + ....\) không phải là phản ứng oxi hóa khử khi?
A.x =1; y = 1. B.x = 2; y = 3.
C.x =3; y = 4. D.x = 1; y = 0.
Câu 8. Thực hiện các thí nghiệm sau:
a) Hòa tan SO3 vào dung dịch H2SO4.
b) Sục khí Cl2 vào dung dịch FeSO4.
c) Nhỏ vài giọt quỳ tím ( dung môi nước) lên mẫu bạc clorua rồi đưa ra ánh sáng.
d) Sục khí SO2 vào nước brom.
e) Sục khí SO2 vào dung dịch KOH.
f) Sục khi NO2 vào dung dịch Ba(OH)2.
Số thí nghiệm xảy ra phản ứng oxi hóa khử là
A.5. B.6.
C.3. D.4.
Câu 9. Trong phản ứng:
\(Zn + CuS{O_4} \to ZnS{O_4} + Cu.\)
Vai trò của ion Cu2+ là:
A.vừa là chất oxi hóa, vừa là chất khử.
B.chất khử.
C.không bị oxi hóa khử.
D.chất oxi hóa.
Câu 10. Cho 8.7g MnO2 tác dụng với dung dịch HCl đặc, nóng thu được MnCl2, V ( lít) khí Cl2 và H2O. Giá trị của V là
A.1,12. B.2,24.
C.3,36. D.22,4.
Câu 11. Phản ứng oxi hóa – khử xảy ra theo chiều tạo thành
A. chất oxi hóa yếu hơn so với ban đầu.
B. chất khử yếu hơn so với chất đầu.
C. chất oxi hóa ( hoặc khử ) mới yếu hơn.
D. chất oxi hóa ( mới ) và chất khử ( mới ) yếu hơn.
Câu 12. Cho quá trình
\(N{O_3}^ - + 3e + 4{H^ + } \to NO + 2{H_2}O.\)
Đây là quá trình
A. oxi hóa.
B. khử.
C. nhận proton.
D. tự oxi hóa – khử.
Câu 13. Cho các dãy chất và ion: Cl2, F2, SO2, Na+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hóa và tính khử là
A.3. B.4.
C.6. D.5.
Câu 14. Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít ( đktc) hỗn hợp khí NO và NO2 có tỉ khối so với H2 là 19. Giá trị của m là
A.25,6 gam. B.16 gam.
C.2,56 gam. D. 8 gam.
Câu 15. Phản ứng nhiệt phân muối thuộc phản ứng
A. oxi hóa – khử.
B. không oxi hóa – khử.
C. oxi hóa – khử hoặc không.
D. thuận nghịch.
Câu 16. Phản ứng nào dưới đây không xảy ra?
\(\eqalign{ & A.KMn{O_4} + S{O_2} + {H_2}O \to \cr & B.Cu + HCl + NaN{O_3} \to \cr & C.Ag + HCl + N{a_2}S{O_4} \to \cr & D.FeC{l_2} + B{r_2} \to \cr} \)
Câu 17. Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
A. tạo ra chất kết tủa.
B. có sự thay đổi màu sắc của các chất.
C. tạo ra chất khí.
D. có sự thay đổi số oxi hóa của một số nguyên tố.
Câu 18. Oxi hóa chậm gam Fe ngoài không khí sau một thời gian thu được 12 gam hỗn hợp X ( Fe, FeO, Fe2O3, Fe3O4 ). Để hòa tan hết X, cần vừa đủ 300 ml dung dịch HCl 1M, đồng thời giải phóng 0,672 lít khí (đktc). Giá trị của m là
A. 10,08. B.8,96.
C.9,84. D.10,64.
Dữ kiện sau dùng cho các câu hỏi 19 và 20
Cho các phản ứng oxi hóa – khử sau:
\(\eqalign{ & 3{I_2} + 3{H_2}O \to HI{O_3} + 5HI{\rm{ }}\left( 1 \right) \cr & 2HgO \to 2Hg + {O_2}{\rm{ }}\left( 2 \right) \cr & 4{K_2}S{O_3} \to 3{K_2}S{O_4} + {K_2}S{\rm{ }}\left( 3 \right) \cr & N{H_4}N{O_3} \to {N_2}O + 2{H_2}{\rm{ }}\left( 4 \right) \cr & 2KCl{O_3} \to 2KCl + 3{O_2}{\rm{ }}\left( 5 \right) \cr & 3N{O_2} + {H_2}O \to 2HN{O_3} + NO{\rm{ }}\left( 6 \right) \cr & 4HCl{O_4} \to 2C{l_2} + 7{O_2} + 2{H_2}O{\rm{ }}\left( 7 \right) \cr & 2{H_2}{O_2} \to 2{H_2}O + {O_2}{\rm{ }}\left( 8 \right) \cr & C{l_2} + Ca{\left( {OH} \right)_2} \to CaOC{l_2} + {H_2}O{\rm{ }}\left( 9 \right) \cr & 2KMn{O_4} \to {K_2}Mn{O_4} + Mn{O_2} + {O_{2{\rm{ }}\left( {10} \right)}} \cr} \)
Câu 19. Trong số các phản ứng trên, số phản ứng oxi hóa khử nội phân tử là
A.2. B.3.
C.4. D.5.
Câu 20. Trong số các phản ứng trên, số phản ứng tự oxi hóa – khử là
A.6. B.7.
C.4. D.5.
Câu 21. Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M . Sau khi các phản ứng xảy ra hoàn toàn thì thu được m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (ở đktc). Giá trị của m1 và m2 lần lượt là.
A.0,54 và 5,16. B.1,08 và 5,16.
C.1,08 và 5,43. D.8,10 và 5,43.
Câu 22. Tìm định nghĩa sai
A. Chất oxi hóa là chất có khả năng nhận electron.
B. Chất khử là chất có khr năng nhận electron.
C. Chất khử là chất có khả năng nhường electron.
D. Sự oxi hóa là quá trình nhường electron.
Câu 23. Đồ vật bằng bạc ( Ag ) tiếp xúc với không khí có khí H2S bị biến thành màu đen do phản ứng: \(4Ag + 2{H_2}S + {O_2} \to 2A{g_2}{S_{\left( {đen} \right)}} + 2{H_2}O\) .Câu nào sau đây biểu diễn đúng tính chất của các chất?
A. Ag là chất bị oxi hóa, O2 là chất bị khử.
B. H2S là chất khử, O2 là chất oxi hóa.
C. H2S là chất oxi hóa, Ag là chất khử.
D. Ag là chất bị khử, O2 là chất bị oxi hóa.
Câu 24. Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A.nhường 12e. B.nhận 13e.
C.nhận 12e. D.nhường 13e.
Câu 25. Cho phương trình hóa học :
\({H_2}S{O_4} + 8HI \to 4{I_2} + {H_2}S + 4{H_2}O.\)
Câu nào sau đây diễn tả không đúng tính chất các chất?
A.I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI.
B.HI bị oxi hóa thành I2, H2SO4 bị khử thành H2S.
C.H2SO4 oxi hóa HI thành I2 và nó bị khử thành H2S.
D.H2SO4 là chất oxi hóa, HI là chất khử.
Câu 26. Các vật bằng đồng bị oxi hóa thường biến thành màu đen làm mất giá trị thẩm mĩ. Để làm sạch các đồ vật bằng đồng có thể sử dụng
A. dung dịch HCl.
B. dung dịch HNO3.
C. dung dịch NH3.
D. Cả A, B và C.
Câu 27. Cho các phản ứng sau:
\(2FeB{r_2} + B{r_2} \to 2FeB{r_3};\)
\({\rm{ 2NaBr + C}}{{\rm{l}}_2} \to 2NaCl + B{r_2}.\)
Phát biểu đúng là
A. Tính khử của Br - > Fe2+.
B. Tính khử của Cl- > Br-.
C. Tính oxi hóa của Cl2 > Fe3+.
D. Tính oxi hóa của Br2 < Cl2.
Câu 28. Cho sơ đồ của phản ứng hóa học sau:
\(CO\left( k \right) + F{e_2}{O_3} \to Fe + C{O_2}\)
Chất oxi hóa và chất khử trong các phản ứng trên là trường hợp nào sau đây?
|
|
A. |
B. |
C. |
D. |
|
Chất oxi hóa |
CO |
Fe2O3 |
Fe2O3, CO |
CO2 |
|
Chất khử |
Fe2O3 |
CO |
Fe |
Fe2O3, CO |
Câu 29. Cho các phát biểu sau:
1. Số oxi hóa là điện tích của nguyên tử trong phân tử nếu giả giả định rằng phân tử đó chỉ có liên kết ion.
2. Một chất có thể vừa là chất khử, vừa là chất oxi hóa.
3. Phản ứng phân hủy luôn là phản ứng oxi hóa – khử.
4. Quá trình khử là quá trình nhận electron của chất oxi hóa.
5. Các quá trình điện phân, sự cháy của than, củi... đều là quá trình oxi hóa – khử.
6. Trong các phản ứng oxi hóa – khử, chỉ có một quá trình khử và một quá trình oxi hóa.
Số phát biểu đúng là
A.3. B.4.
C.5. D.6.
Câu 30. Phương pháp thăng bằng electron dựa trên nguyên tắc
A. tổng số electron do chất oxi hóa cho bằng tổng số electron do chất khử nhận.
B. tổng số electron do chất oxi hóa cho bằng tổng số electron do chất bị khử nhận.
C. tổng số electron do chất khử cho bằng tổng số electron do chất oxi hóa nhận.
D. tổng số electron do chất khử cho bằng tổng số electron do chất bị oxi hóa nhận.
Lời giải chi tiết
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
D |
C |
B |
A |
C |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
A |
B |
D |
D |
B |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
D |
B |
B |
A |
C |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
C |
D |
A |
C |
A |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
C |
B |
A |
D |
B |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
D |
D |
B |
B |
C |
Câu 1
Cách xác định số OXH
+ Trong hợp chất, số OXH của O thường là -2, H thường là +1
+ Tổng số OXH các nguyên tử các nguyên tố trong hợp chất trong phân tử =0, và trong ion bằng điện tích ion
=> Số oxi hóa của nitơ trong NH4+, NO2, HNO3 lần lượt là -3, +4, +5
Đán án D
Câu 2
Điện hóa trị các nguyên tố nhóm VIA, VIIA trong các hợp chất với natri có giá trị 2- và 1-
Đáp án C
Câu 3
\(\begin{array}{l}5{H_2}S + 2KMn{O_4} + 3{H_2}S{O_4} \to 5S + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O\\2x\left| {M{n^{ + 7}} + 5e \to M{n^{ + 2}}} \right.\\5x\left| {{S^{ - 2}} \to {S^0} + 2e} \right.\end{array}\)
Đáp án B
Câu 4
Trong hóa học vô cơ, phản ứng trao đổi có số oxi hóa của các nguyên tố luôn không đổi.
Đáp án A
Câu 5:
Phương trình hóa học
\(\eqalign{ & {\rm{Zn + C}}{{\rm{u}}^{2 + }} \to Z{n^{2 + }} + Cu \cr & {\rm{Fe + C}}{{\rm{u}}^{2 + }} \to F{e^{2 + }} + Cu \cr} \)
Mkim loại = mchất rắn
\(\eqalign{ & \Leftrightarrow 65x + 56y = 64\left( {x + y} \right) \cr&\to x = 8y \cr & \% Zn = {{65x} \over {65x + 56y}}.100\% \cr&\;\;\;\;\;\;\;\;\;= {{65x} \over {65x + 56.\dfrac{x }{ 8}}}.100 = 90,27\% \cr} \)
Đáp án C.
Câu 6
Phản ứng OXH Khử là phản ứng có sự thay đổi số OXH của chất tham gia phản ứng.
Đáp án A
Câu 7
Phản ứng không phải là phản ứng OXH Khử khi không có sự thay đổi số OXH của chất tham gia phản ứng
Đáp án B
Câu 8
Xét từng phương trình phản ứng ta có:
a. SO2 + H2O → H2SO4
b. 3/2 Cl2 + 3FeSO4 → FeCl3 + Fe2(SO4)3
c. AgCl → Ag + ½ Cl2
d. SO2 + Br2 + H2O → 2HBr + H2SO4
e. SO2 + 2NaOH → Na2SO3 + H2O
f. 4NO2 + 2Ba(OH)2 → Ba(NO3)2 + Ba(NO2)2 + 2H2O
=> Số thí nghiệm xảy ra phản ứng OXH Khử là 4
Đáp án D
Câu 9
Cu2+ là chất nhận e => chất OXH
Đáp án D
Câu 10:
Số mol MnO2 là: \({n_{Mn{O_2}}} = \dfrac{m}{M} = \dfrac{{8,7}}{{87}} = 0,1\left( {mol} \right)\)
Phương trình hóa học
\(\eqalign{ & Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O \cr & 0,1{\rm{ }} \to {\rm{ 0,1}}\left( {mol} \right) \cr} \)
Thể tích khí clo thu được là:
\({V_{C{l_2}}} = 0,1.22,4 = 2,24\) (lít)
Đáp án B.
Câu 11
Phản ứng oxi hóa – khử xảy ra theo chiều tạo thành chất oxi hóa ( mới ) và chất khử ( mới ) yếu hơn.
Đáp án D
Câu 12
Đây là quá trình nhận e của chất oxi hóa
=> Qúa trình khử
Đáp án B
Câu 13
Chất vừa có tính OXH và khử là chất có khả năng tăng hoặc giảm số OXH (sở hữu số OXH trung gian)
Chất và ion trong dãy đều có tính oxi hóa và tính khử là: Cl2, SO2, Fe2+,Mn2+
Đáp án B
Câu 14:
nkhí = 0,4 mol, \(\overline M = 38g/mol\) .
Gọi x, y lần lượt là số mol của NO và NO2 \( \to x + y = 0,4\left( 1 \right)\)
Áp dụng quy tắc đường chéo
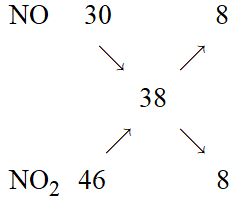
Từ (1) và (2) ta có: \({n_{N{O_2}}} = {n_{NO}} = 0,2\left( {mol} \right)\)
Quá trình cho nhận electron
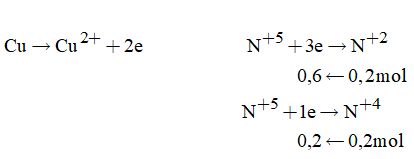
Áp dụng định luật bảo toàn electron ta có
\({n_{Cu}} = \dfrac{{0,6 + 0,2}}{2} = 0,4\left( {mol} \right)\)
\(\Rightarrow {m_{Cu}} = 0,4.64 = 25,6\left( {gam} \right)\)
Đáp án A.
Câu 15
Phản ứng nhiệt phân muối thuộc phản ứng oxi hóa – khử hoặc không.
Đáp án C
Câu 16
2KMnO4 + 5SO2 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
3Cu + 8HCl + 8NaNO3 → 3Cu(NO3)2 + 8NaCl + 2NO + 4H2O
Ag + HCl + Na2SO4 → (không phản ứng)
3FeCl2 + 3/2 Br2 → 2FeCl3 + FeBr3
Đáp án C
Câu 17
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của một số nguyên tố.
Đáp án D
Câu 18:
\({n_{{H_2}}} = \dfrac{V}{{22,4}} = \dfrac{{0,672}}{{22,4}} = 0,3\left( {mol} \right)\)
Ta có: \({n_{{H^ + }/HCl}} = {n_{{H^ + }}}\)hòa tan oxit +\({n_{{H^ + }}}\)trong khí
\( \to {n_{{H^ + }}}\) hòa tan trong oxit = 0,24 mol
Bảo toàn nguyên tố oxi ta có:
\({n_{O({\rm{ox}}it)}} = {1 \over 2}{n_{{H^ + }}}\)hòa tan oxit = 0,12 mol
Áp dụng định luật bảo toàn khối lượng ta có:
\(m = {m_X} - {m_O} = 12 - 0,12.16 \)\(\,= 10,08\left( {gam} \right)\)
Đáp án A.
Câu 19
Phản ứng OXH nội phân tử là có từ 2 nguyên tố hóa học trở lên trong 1 phân tử có sự thay đổi số OXH
Các phản ứng oxh nội phân tử là: (2), (5), (7), (10)
Đáp án C
Câu 20:
Phản ứng tự oxi hóa khử là phản ứng oxi hóa – khử mà trong đó một chất vừa là chất khử vừa là chất oxi hóa (chất khử và chất oxi hóa thuộc về cùng một nguyên tố trong một phân tử chất).
Vậy các phản ứng tự oxi hóa – khử là (1), (3), (4), (6), (8), (9)
Đáp án A.
Câu 21:
Cách 1: \(X + HCl \to {H_2}\) . Trong X có Al dư.
Bảo toàn electron:
nAl dư = \(\dfrac{2}{3}{n_{{H_2}}} = 0,01mol\)
\( \Rightarrow \dfrac{{{m_1}}}{{27}}.3 = 0,03.2 + 0,03.1 + 0,015.2\)
\(\Rightarrow {m_1} = 1,08gam\)
\( \to \) m2 = mAl dư + mCu + mAg = 0,01.27 + 0,03.64 + 0,03.108 = 5,43 gam
Cách 2: Phương trình ion
\(\eqalign{ & 3A{g^ + } + Al \to A{l^{3 + }} + 3Ag \cr & 0,03 \leftarrow 0,01{\rm{ }} \to\;\;\;\;\;\; {\rm{ 0,03mol}} \cr & {\rm{3C}}{{\rm{u}}^{2 + }} + 2Al \to 2A{l^{3 + }} + 3Cu \cr & 0,03 \leftarrow {\rm{ 0,02 }} \to\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ 0,03mol}} \cr & {\rm{Al + 3}}{{\rm{H}}^ + } \to A{l^{3 + }} + {3 \over 2}{H_2} \cr & 0,01{\rm{ }} \leftarrow\;\;\;\;\;\;\;\;\;\;\;\;\;\; {\rm{ 0,015mol}} \cr & \to {{\rm{m}}_1} = \left( {0,01 + 0,02 + 0,01} \right).27 = 1,08\left( {gam} \right) \cr & \to {m_2} = 0,03.64 + 0,03.108 + 0,01.27 = 5,43\left( {gam} \right) \cr} \)
Đáp án C.
Câu 22
A. Chất oxi hóa là chất có khả năng nhận electron. (đúng)
B. Chất khử là chất có khả năng nhận electron. (sai, chất khử là chất có khả năng nhường e)
C. Chất khử là chất có khả năng nhường electron. (đúng)
D. Sự oxi hóa là quá trình nhường electron. (đúng)
Đáp án B
Câu 23
Trong phản ứng trên Ag là chất bị OXH, O2 là chất bị khử
Đáp án A
Câu 24:
\(\eqalign{ & 13 \times |2CuFe{S_2} \to 2C{u^{ + 2}} + F{e_2}^{ + 3} + 4{S^{ + 4}} + 26e \cr & 2 \times {\rm{ |}}{{\rm{O}}_2} + 4e \to 2{O^{ - 2}} \cr} \)
Vậy 1 phân tử CuFeS2 sẽ nhường 13 electron
Đáp án D.
Câu 25
Trong phương trình trên: HI là chất khử, H2SO4 là chất OXH
=> HI bị oxi hóa thành I2, H2SO4 bị khử thành H2S.
Đáp án B
Câu 26
Ta có thể dùng cả HCl, HNO3 (Oxit đồng tác dụng được với dung dịch axit)
NH3 có khả năng hòa tan được CuO tạo thành dung dịch phức màu xanh lam.
Đáp án D
Câu 27
Chất OXH mạnh + chất khử mạnh Chất OXH yếu hơn + chất Khử yếu hơn
Đáp án D
Câu 28
Trong phương trình trên, CO là chất khử Fe2O3 là chất OXH
Đáp án B
Câu 29:
1. Số oxi hóa là điện tích của nguyên tử trong phân tử nếu giả giả định rằng phân tử đó chỉ có liên kết ion: Đúng.
2. Một chất có thể vừa là chất khử, vừa là chất oxi hóa: Đúng.
3. Phản ứng phân hủy luôn là phản ứng oxi hóa – khử: Sai, phản ứng phân hủy có thể là phản ứng oxi hóa – khư hoặc không.
4. Quá trình khử là quá trình nhận electron của chất oxi hóa: Đúng.
5. Các quá trình điện phân, sự cháy của than, củi... đều là quá trình oxi hóa – khử: Đúng.
6. Trong các phản ứng oxi hóa – khử, chỉ có một quá trình khử và một quá trình oxi hóa: Sai, vì trong một phản ứng oxi hóa – khử, có thể có nhiều quá trình khử hoặc nhiều quá trình oxi hóa.
Các phát biểu đúng là: 1, 2, 3, 5.
Đáp án B.
Câu 30
Phương pháp thăng bằng electron dựa trên nguyên tắc tổng số electron do chất khử cho bằng tổng số electron do chất oxi hóa nhận.
Đáp án C
Loigiaihay.com
Các bài khác cùng chuyên mục











