 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Đề số 2 - Hóa học 10
Đáp án và lời giải chi tiết Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Đề số 2 - Hóa học 10
Đề bài
Câu 1: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa khử?
A. NaOH + HBr → NaBr + H2O.
B. 3NO2 + H2O → 2HNO3 + NO.
C. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4.
D. O3 → O2 + O.
Câu 2: Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
B. 2HCl + Mg → MgCl2 + H2
C. HCl + AgNO3 → AgCl + HNO3
D. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
Câu 3: Cho sơ đồ phản ứng :
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của các chất trong phản ứng là
A. 53
B. 55
C. 57
D. 59
Câu 4: Cho dãy các chất và ion sau: HCl, SO2, F2, Fe2+, Al, Cl2. Số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
A. 3
B. 4
C. 5
D. 6
Câu 5: Ở phản ứng oxi hóa – khử nào sau đây chỉ có sự thay đổi số oxi hóa của một nguyên tố ?
A. 3I2 + 3H2O → HIO3 + 5HI
B. 2HgO → 2Hg + O2
C. 2KClO3 → 2KCl + 3O2
D. 4HClO4 → 2Cl2 + 7O2 + 2H2O
Câu 6: Cho ba phản ứng hóa học dưới đây
1) 2Na + 2H2O → 2NaOH + H2↑
2) CO2 + Ca(OH)2 → CaCO3↓ + H2O
3) 2KClO3 \(xrightarrow{{{t}^{o}}}\) 2KCl + 3O2
Các phản ứng oxi hóa khử là
A. 1
B. 2
C. 1 và 2
D. 1 và 3
Câu 7: Trong phản ứng sau:
Cl2 + 2H2O + SO2 → H2SO4 + 2HCl, thì :
A. Cl2 là chất oxi hóa, H2O là chất khử.
B. Cl2 là chất oxi hóa, SO2 là chất khử.
C. Cl2 là chất khử, SO2 là chất oxi hóa.
D. SO2 là chất khử, H2O là chất oxi hóa.
Câu 8: Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, dư thu được 1,344 lít khí N2 (đktc) và dung dịch X. Thêm NaOH dư vào dung dịch X và đun sôi thì thu được 1,344 lít khí NH3. Gía trị của m là:
A. 0,54
B. 1,62
C. 10,08
D. 9,72
Câu 9: Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 dư, thoát ra 0,56 lít (đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là
A. 2,22.
B. 2,62.
C. 2,52.
D. 2,32.
Câu 10: Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hoà tan hoàn toàn 18 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1 : 1 là (biết phản ứng tạo chất khử duy nhất là NO):
A. 1,0 lít
B. 0,6 lít
C. 0,8 lít
D. 1,2 lít
Câu 12: Thực hiện các thí nghiệm sau
a. Nung nóng KNO3
b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư
c. Sục khí Cl2 vào dung dịch FeCl2
d. Cho dung dịch KHSO4 vào dung dịch FeCl2
e. Cho Si vào dung dịch NaOH
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
A. 3
B. 2
C. 4
D. 5
Câu 13: Cho sơ đồ phản ứng sau:
\(N{H_3}\xrightarrow[{{t^0},xt}]{{ + {O_2}}}NO\xrightarrow{{ + {O_2}}}N{O_2}\xrightarrow{{ + {O_2} + {H_2}O}}HN{O_3}\xrightarrow{{ + CuO}}Cu{(N{O_3})_2}\xrightarrow{{{t^0}}}N{O_2}\)
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng oxi hóa - khử trong chuỗi trên là
A. 3
B. 4
C. 5
D. 2
Câu 14: Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O
Với a, b, c, d, e là những số nguyên tối giản. Tổng (a+b) bằng?
A. 5
B. 8
C. 11
D. 12
Câu 16: Trong phản ứng đốt cháy CuFeS2 tạo ra các sản phẩm CuO, Fe2O3 và SO2 thì 1 phân tử CuFeS2 sẽ
A. nhường 13e.
B. nhận 12e.
C. nhận 13e.
D. nhường 12e.
Câu 17: Chia 22,0 g hỗn hợp X gồm Mg, Na và Ca thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với O2 thu được 15,8 g hỗn hợp 3 oxit. Phần 2 cho tác dụng với dung dịch HCl dư thu được V (lít) khí H2 (đktc). Giá trị của V là:
A. 6,72.
B. 13,44.
C. 8,96.
D. 3,36.
Câu 18: Hoà tan 15,4 gam hỗn hợp Zn, Mg bằng một lượng vừa đủ dd HCl thu được 6,72 lít khí H2 (đktc) và dung dịch C. Tính khối lượng muối có trong dung dịch C: (Zn=65; Mg=24; Cl=35,5; H=1)
A. 36,7g
B. 37,3g
C. 26,35g
D. 26,05g
Câu 19: Cho 15,2 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 8,96 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 39,7 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 15,2 gam X là
A. 4,8 gam.
B. 7,2 gam.
C. 9,2 gam.
D. 3,6 gam.
Câu 20: Nhúng một thanh sắt vào dung dịch Cu(NO3)2 một thời gian thấy khối lượng sắt tăng 0,8 gam. Khối lượng sắt đã tham gia phản ứng là
A. 11,2 gam
B. 5,6 gam
C. 0,7 gam
D. 6,4 gam
Câu 21: Phản ứng nào sau đây thuộc loại phản ứng tự oxi hoá, tự khử (hay tự oxi hoá - khử)?
A. 2KClO3 \(\xrightarrow{{{t}^{o}}}\) 2KCl + 3O2
B. S + 2H2SO4 → 3SO2 + 2H2O
C. 4NO2 + O2 + 2H2O → 4HNO3
D. Cl2 + 2KOH → KClO + KCl + H2O
Câu 22: Trong các phản ứng hóa học, SO2 có thể là chất oxi hoá hoặc chất khử vì
A. lưu huỳnh trong SO2 đã đạt số oxi hóa cao nhất.
B. SO2 là oxit axit.
C. lưu huỳnh trong SO2 có số oxi hóa trung gian.
D. SO2 tan được trong nước.
Câu 23: Chất nào dưới đây thể hiện tính khử khi cho tác dụng với dung dịch H2SO4 loãng?
A. Fe.
B. Fe(OH)2.
C. FeO.
D. FeCl3.
Câu 24: Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm Cu(NO3)2, H2SO4, NO và H2O thì số electron mà 1 mol Cu2S đã nhường là
A. 9 electron
B. 6 electron
C. 2 electron
D. 10 electron
Câu 25: Đốt 13 gam bột kim loại R hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam (giả sử hiệu suất phản ứng là 100%). Kim loại R là
A. Zn.
B. Cu.
C. Al.
D. Ca.
Lời giải chi tiết
Câu 1:
\(3\mathop N\limits^{ + 4} {O_2} + {H_2}O \to 2H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\)
Đáp án B
Câu 2:
Ở phản ứng: HCl + Mg → MgCl2 + H2 ta thấy HCl nhận e nên là chất oxi hóa:
2H+ + 2e → H2
Đáp án B
Câu 3:
\({\mathop {Fe}\limits^{ + 8/3} _3}{O_4} + {\rm{ }}H\mathop N\limits^{ + 5} {O_3} \to {\rm{ }}\mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + {\rm{ }}\mathop N\limits^{ + 2} O{\rm{ }} + {\rm{ }}{H_2}O\)
\(\begin{array}{*{20}{c}}{{\rm{3x}}}\\{}\\{{\rm{1x}}}\end{array}\left| \begin{array}{l}3\mathop {F{\rm{e}}}\limits^{ + 8/3} \,\, \to \,\,3\mathop {F{\rm{e}}}\limits^{ + 3} \,\, + \,\,1{\rm{e}}\\\mathop N\limits^{ + 5} \,\, + \,\,3{\rm{e}}\,\, \to \,\,\mathop N\limits^{ + 2} \end{array} \right.\)
=> cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
=> Tổng hệ số cân bằng của các chất trong phản ứng là = 3 + 28 + 9 + 1 + 14 = 55
Đáp án B
Câu 4:
Có 4 chất và ion vừa có tính oxi hóa, vừa có tính khử là: HCl, SO2, Fe2+, Cl2.
Đáp án B
Câu 5:
Phản ứng chỉ có sự thay đổi số oxi hoá của một nguyên tố là :
\(3\mathop {{I_2}}\limits^0 + 3{H_2}O \to H\mathop I\limits^{ + 5} {O_3} + 5H\mathop I\limits^{ - 1} \)
Đáp án A
Câu 6:
Phản ứng oxi hóa – khử làm thay đổi số oxi hóa của các chất
=> có 2 phản ứng oxi hóa khử là
\(\begin{align} & 1)~2\overset{0}{\mathop{Na}}\,~+~2{{\overset{+1}{\mathop{H}}\,}_{2}}{{O}_{{}}}\to \text{}2\overset{+1}{\mathop{Na}}\,OH~+{{\overset{0}{\mathop{~H}}\,}_{2}} \\ & 3)\text{ }2K\overset{+5}{\mathop{Cl}}\,{{\overset{-2}{\mathop{O}}\,}_{3}}~\to 2K\overset{1}{\mathop{Cl}}\,~+\text{ }3{{\overset{0}{\mathop{O}}\,}_{2}} \\ \end{align}\)
Đáp án D
Câu 7:
\({\mathop {Cl_2}\limits^0 } + 2e \to 2\mathop {Cl}\limits^{ - 1} \) => Cl2 là chất oxi hóa
\(\mathop S\limits^{ + 4} - 2e \to \mathop S\limits^{ + 6} \) => SO2 là chất khử
Đáp án B
Câu 8:
Vì khi cho NaOH vào dd X thì tạo ra khí NH3 nên pư tạo muối NH4NO3
Al → Al+3 + 3e 2N+5 +10e→ N2 N+5 + 8e→ N-3
Số mol khí N2 là 0,06 mol
Số mol khí NH3 là 0,06 mol
Ta có NH4NO3 + NaOH → NaNO3 + NH3 +H2O
Số mol NH4NO3 là 0,06 mol
Áp dụng đinh luật bảo toàn e thì
3nAl = 10.0,06 + 8.0,06 nên nAl=0,36 mol
Khối lượng của Al là 0,36 .27=9,72 g
Đáp án D
Câu 9:
Sơ đồ: \(F{\rm{e}} + {O_2} \to X\left\{ {F{\rm{e}}O,F{{\rm{e}}_2}{O_3},F{e_3}{O_4},F{\rm{e}}} \right\} + HN{O_3} \to F{\rm{e}}{\left( {N{O_3}} \right)_3} + NO + {H_2}O\)
Fe0 → Fe+3 + 3e O2 + 4e → 2O-2
x → 3x (mol) y → 4y (mol)
N+5 + 3e → N+2 (NO)
0,075 ← 0,025 (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}56{\rm{x}} + 32y = 3\\3x = 4y + 0,075\end{array} \right. \to \left\{ \begin{array}{l}x = 0,045\\y = 0,015\end{array} \right.\)
⟹ m = mFe = 56.0,045 = 2,52 gam
Đáp án C
Câu 10:
Gọi nFe = nCu = a mol => 56a + 64a = 18 => a = 0,15 mol
Do thể tích dung dịch HNO3 cần dùng ít nhất, nên sắt sẽ bị hòa tan hết bởi HNO3 vừa đủ tạo muối Fe3+, Cu tác dụng vừa đủ với Fe3+ tạo muối Cu2+ và Fe2+ => sau phản ứng chỉ thu được hai muối Cu(NO3)2 và Fe(NO3)2
\(Fe~\,\,\to ~~~\overset{+2}{\mathop{Fe}}\,\,\,\text{+ }2e~~~\)
0,15 → 0,3
\(Cu~~\to \,\,\overset{+2}{\mathop{Cu}}\,\,\,+\,\,2e\)
0,15 → 0,3
=> ∑ne cho = 2.(0,15 + 0,15) = 0,6 mol
=> ne nhận = 3.nNO = 0,6 => nNO = 0,2 mol
Ta có:\({{n}_{NO_{3}^{-}}}\) = ne cho = 0,6 mol
Bảo toàn nguyên tố N: \({{n}_{HN{{O}_{3}}}}={{n}_{NO_{3}^{-}}}+{{n}_{NO}}=0,6+0,2=0,8\,\,mol\)
=> [HNO3] = \(\frac{0,8}{1}\)= 0,8 lít
Đáp án C
Câu 11: Phát biểu nào dưới đây không đúng?
A. Sự oxi hóa là sự mất (nhường) electron
B. Sự khử là sự mất electron hay cho electron
C. Chất khử là chất nhường (cho) electron
D. Chất oxi hóa là chất thu electron
Câu 11:
B sai vì sự khử là sự nhận e
Đáp án B
Câu 12:
(a) KNO3 KNO2 + ½ O2 → phản ứng oxh khử
(b) 2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O → phản ứng oxh khử
(c) Cl2 + 2FeCl2 → 2FeCl3 → phản ứng oxh khử
(d) KHSO4 + FeCl2 → không phản ứng
(e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 → Phản ứng oxh khử
Số thí nghiệm xảy ra phản ứng oxi hóa khử là 4
Đáp án C
Câu 13:
=> các phương trình (1), (2), (3) , (5) đều là phản ứng oxi hóa khử => có 4 phản ứng oxh - khử
Đáp án B
Câu 14:
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tổng a + b = 3 + 8 = 11
Đáp án C
Câu 15: Ở phản ứng nào sau đây NH3 đóng vai trò là chất khử :
A. NH3 + HNO3 → NH4NO3
B. NH3 + CO2 + H2O → NH4HCO3
C. NH3 + HCl → NH4Cl
D. 2NH3 +3CuO → N2 +3Cu + 3H2O
Câu 15:
\(2\mathop N\limits^{ - 3} {H_3} + 3CuO{\text{ }} \to {\text{ }}\mathop {{N_2}}\limits^0 + 3Cu{\text{ }} + {\text{ }}3{H_2}O\)
Đáp án D
Câu 16:
Xét quá trình cho e:
\(CuF\text{e}{{\text{S}}_{2}}\,\,\to \,\,\overset{+2}{\mathop{Cu}}\,O+{{\overset{+3}{\mathop{F\text{e}}}\,}_{2}}{{O}_{3}}+\overset{+4}{\mathop{S}}\,{{O}_{2}}+12\text{e}\)
Ta có bán phản ứng: CuFeS2 → Cu2+ + Fe3+ + 2S4+ + 13e
Vậy 1 phân tử CuFeS2 nhường 13e
Đáp án A
Câu 17:
Phần 1 và phần 2 như nhau nên số mol e cho và nhận là như nhau.
Phần 1: BTKL ta có: mO = mOxit – mKL = 15,8 – 11 = 4,8 gam
=> nO = 4,8 : 16 = 0,3 mol
=> ne cho = ne nhận = 2nO = 0,3.2 = 0,6 mol
Phần 2: n e cho = n e nhận = 2nH2 => 2nH2 = 0,6 => nH2 = 0,3 mol
=> VH2 = 0,3.22,4 = 6,72 lít
Đáp án A
Câu 18:
nH2 = 6,72 : 22,4 = 0,3 mol
Đặt số mol của Zn và Mg lần lượt là x và y (mol).
PTHH:
Zn + 2HCl → ZnCl2 + H2
x x x (mol)
Mg + 2HCl → MgCl2 + H2
y y y (mol)
- Khối lượng hỗn hợp kim loại: 65x + 24y = 15,4 (1)
- Số mol H2: x + y = 0,3 (2)
Giải (1) và (2) được x = 0,2 và y = 0,1
Dung dịch C chứa các muối: ZnCl2 (0,2 mol) và MgCl2 (0,1 mol)
=> m muối = 0,2.136 + 0,1.95 = 36,7 gam
Đáp án A
Câu 19:
Đặt nCl2 = x; nO2 = y (mol)
BTKL: mY= mZ – mX = 39,7 – 15,2 = 24,5 (g)
Ta có hệ:
\(\left\{ \begin{gathered}
x + y = 0,4 \hfill \\
71x + 32y = 24,5 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,3 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right.\)
Đặt nMg = a; nCa = b (mol)
Ta có hệ:
\(\left\{ \begin{gathered}
{m_{Mg}} + {m_{Ca}} = {m_X} \hfill \\
\xrightarrow{{BT:e}}2{n_{Mg}} + 2{n_{Ca}} = 2{n_{C{l_2}}} + 4{n_{{O_2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
24a + 40b = 15,2 \hfill \\
2a + 2b = 2.0,3 + 4.0,1 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
a = 0,3 \hfill \\
b = 0,2 \hfill \\
\end{gathered} \right.\)
=> mMg = 0,3.24 = 7,2 (g)
Đáp án B
Câu 20:
Xét quá trình phản ứng có Fe cho e và Cu2+ nhận e
\(Fe\,\,\, \to \mathop {Fe}\limits^{ + 2} \,\,\, + \,\,\,\,2{\rm{e}}\)
x → 2x
\(\mathop {Cu}\limits^{ + 2} \,\,\,\, + \,\,\,\,2{\rm{e}}\,\,\,\,\, \to \,\,\,\,Cu\)
2x → x
∆mthanh Fe = mCu sinh ra – mFe phản ứng = 64x – 56x = 8x = 0,8 (g) => x = 0,1 (mol)
=> mFe = 0,1.56 = 5,6 gam
Đáp án B
Câu 21:
Phản ứng thuộc loại phản ứng tự oxi hoá, tự khử là chất khử đồng thời cũng là chất oxi hóa (thuộc cùng 1 nguyên tố) => Cl2 + 2KOH → KClO + KCl + H2O
Đáp án D
Câu 22:
SO2 có thể là chất oxi hoá hoặc chất khử vì lưu huỳnh trong SO2 có số oxi hóa trung gian.
Đáp án C
Câu 23:
Chất khử là chất nhường e để lên mức oxi hóa cao hơn.
Fe + H2SO4 → FeSO4 + H2 => Fe thể hiện tính khử
Đáp án A
Câu 24:
Xét quá trình cho e:
\(Cu{{\rm{S}}_2}\,\, \to \,\,\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + 2{H_2}\mathop S\limits^{ + 4} {O_4} + 10{\rm{e}}\)
=> 1 mol CuS2 nhường 10e
Đáp án D
Câu 25:
Bảo toàn khối lượng: \({{m}_{R}}+{{m}_{{{O}_{2}}}}={{m}_{oxit}}\,\,=>{{m}_{{{O}_{2}}}}=16,2-13=3,2\,\,gam\,\,=>\,\,{{n}_{{{O}_{2}}}}=0,1\,\,mol\)
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
\(\begin{align} & R\to \overset{+2}{\mathop{R}}\,+2\text{e}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{O}_{2}}\,\,\,+\,\,\,4\text{e}\to2\overset{-2}{\mathop{O}}\, \\ & 0,2\,\,\,\,\leftarrow \,\,\,\,0,4\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\to \,\,0,4 \\ \end{align}\)
\(=>\text{ }{{n}_{R}}=0,2\text{ }mol=>{{M}_{R}}=\frac{13}{0,2}=65\)
=> R là kim loại Zn
Đáp án A
Loigiaihay.com
Các bài khác cùng chuyên mục




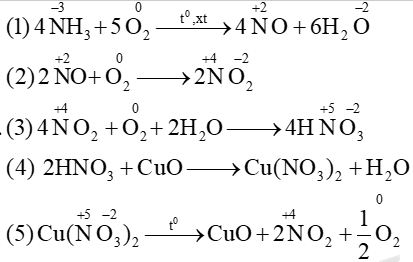








Danh sách bình luận