 Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
Giải bài tập hóa học 9, Hóa 9 - Để học tốt hóa học 9
 Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 9
Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 9
Đề kiểm tra 45 phút (1 tiết) – Đề số 2 – Chương 4 – Hóa học 9
Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút (1 tiết) – Đề số 2 – Chương 4 – Hóa học 9
Đề bài
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: Tính chất hóa học đặc trưng của
A.metan là phản ứng thế và etilen là phản ứng cộng.
B.metan và etilen là phản ứng thế.
C.metan và etilen là phản ứng cộng.
D.metan và etilen là phản ứng cháy.
Câu 2: Metan và etilen có sự khác nhau về tính chất hóa học vì phân tử metan
A.chỉ có liên kết đơn còn với etilen ngoài liên kết đơn còn có liên kết đôi.
B.và etilen chỉ chứa 2 nguyên tố C và H.
C.chỉ có 1 nghuyên tử C còn phân tử etilen có 2 nguyên tử C.
D.chỉ có liên kết đơn còn với etilen chỉ có liên kết đôi.
Câu 3: Có thể dùng dung dịch Ca (OH)2, khí O2 để nhận biết các chất nào trong các chất sau: CH4, CO2, N2, H2 ?
A.CH4, N2, H2.
B. CH4, CO2, N2.
C. CO2, N2, H2.
D. CH4, CO2, H2.
Câu 4: Khi chi khí metan tác dụng với khí clo theo tỉ lệ 1:1 về thể tích, sản phẩm phản ứng là:
A.CCl4. B.CHCl3
C.CH2Cl2 D.CH3Cl.
Câu 5: Số công thức cấu tạo của C2H7N, C3H6 m(mạch hở) lần lượt là:
A.2, 1 B.1, 2
C.3, 1 D.3, 2.
Câu 6: Đốt cháy hoàn toàn 784ml khí ( đktc) một hidrocacbon X thu được 3,08 gam CO2 và 0,63 gam nước. Công thức phân tử của X là:
A.C2H4 B.C2H2
C.CH4 D.C6H6.
Câu 7: Dung dịch brom có thể phản ứng với tất cả các chất trong dãy nào sau đây?
\(\eqalign{ & A.C{H_3} - C{H_3},C{H_3} - CH = C{H_2},C{H_3} - C \equiv CH. \cr & B.C{H_3} - C{H_3},C{H_3} - CH = C{H_2},{C_6}{H_6}. \cr & C.C{H_3} - C{H_3},C{H_3} - C \equiv CH,{C_6}{H_6}. \cr & D.C{H_3} - CH = C{H_2},C{H_3} - C \equiv CH. \cr} \)
Câu 8: Đốt cháy 0,3 lít một chất hữu cơ Y (chỉ chứa 2 nguyên tố C, H) người ta thu được 0,6 lít CO2, 0,9 lít hơi H2O (các thể tích đo ở đktc). Công thức phân tử của Y là:
A.C2H6 B.C3H6
C.C3H4 D.C6H6.
II.Tự luận (6 điểm)
Câu 9 (2 điểm): Viết các công thức cấu tạo có thể có của C3H9N (biết C có hóa trị 4, H có hóa trị 1, N có hóa trị 3).
Câu 10 (2 điểm): Một hỗn hợp gồm metan và axetilen có thể tích 4,48 lít (đktc) sục vào dung dịch br2 dư. Dung dịch nặng thêm 3,9 gam.
Tìm thể tích khí O2 (đktc) cần để đốt cháy hết hỗn hợp trên (H = 1, C = 12).
Câu 11 (2 điểm): Một chất hữu cơ Z (chứa các nguyên tố C, H, Cl) trong đó thành phần % theo khối lượng của Cl là: 70,3%, của H là 5,94%.
Biết 0,1 mol chất này có khối lượng 5,05 gam.
Xác định công thức phân tử, công thức cấu tạo của Z (cho H = 1, C = 12, Cl = 35,5).
Lời giải chi tiết
1.Đáp án
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
A |
B |
D |
A |
B |
D |
A |
2.Lời giải
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A)
Do phân tử metan chỉ có liên kết đơn, còn phân tử etilen ngoài liên kết đơn còn có liên kết đôi kém bền nên dễ tham gia phản ứng cộng.
Câu 2: (A)
Số lượng nguyên tử của các nguyên tố ít ảnh hưởng đến tính chất hóa học (đều là các hidrocacbon)
Câu 3: (B)
Dùng dung dịch Ca(OH)2 nhận biết được CO2, nhưng với O2 không phân biệt được CH4, H2.
Câu 4: (D)
Với tỉ lệ 1:1 về thể tích ta có phương trình:
CH4 + Cl2 \(\to\) CH3Cl + HCl (ánh sáng)
Câu 5: (A)
Hai công thức cấu tạo của C2H7N là CH3 – CH2 – NH2 và CH3 – NH – CH3
C3H6 chỉ có 1 công thức cấu tạo mạch hở: CH2 = CH – CH3.
Câu 6: (B)
\(\eqalign{ & {m_C} = {{3,08.12} \over {44}} = 0,84gam,\cr&{m_H} = {{0,63.2} \over {18}} = 0,07gam \cr & \Rightarrow {m_X} = 0,91gam \cr & {n_X} = 0,035mol. \cr} \)
Vậy khối lượng phân tử MX = 26. Đó là C2H2.
Câu 7: (D)
Dung dịch brom không phản ứng với các chất trong ohaan tử chỉ có liên kết đơn, mạch hở, hay benzen C6H6.
Câu 8: (A)
\({C_x}{H_y} + (x + {y \over 4}){O_2} \to xC{O_2} + {y \over 2}{H_2}O\)
Ta có: \(\dfrac{1}{{0,3}} = \dfrac{x}{{0,6}} = \dfrac{y}{{2.0,9}}\Rightarrow x = 2,y = 6.\)
Công thức phân tử của Y là C2H6.
II.Tự luận (6 điểm)
Câu 9:
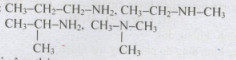
Viết đúng mỗi công thức 0,5 điểm
Câu 10:
\(\eqalign{ & {C_2}{H_2} + 2B{r_2} \to {C_2}{H_2}B{r_4} \cr & {m_{{C_2}{H_2}}} = 3,9 \cr& \Rightarrow {n_{{C_2}{H_2}}} = {{3,9} \over {26}} = 0,15mol \cr & {n_{C{H_4}}} = {{4,48} \over {22,4}} \cr & 2{C_2}{H_2} + 5{O_2} \to 4C{O_2} + 2{H_2}O \cr & C{H_4} + 2{O_2} \to C{O_2} + 2{H_2}O \cr & {n_{{O_2}}} = 0,15.2,5 + 0,05.2 \cr&\;\;\;\;\;\;\,= 0,375 + 0,1 = 0,475 \cr & {V_{{O_2}}} = 0,475.22,4 = 10,64\,l\,(đktc). \cr} \)
Câu 11:
Thành phần % theo khối lượng của C là:
\(\eqalign{ & 100 - (70,3 + 5,94) = 23,76 \cr & {n_C}:{n_H}:{n_{Cl}} = 1,98:5,94:1,98 = 1:3:1 \cr} \)
Công thức đơn giản nhất: CH3Cl
Công thức phân tử (CH3Cl)n
Mặt khác: \(M = 5,05:0,1 = 50,5\)
Mà M = (12+3+35,5)n
\( \Rightarrow n = 1 \Rightarrow \) Z là CH3Cl
Công thức cấu tạo của Z: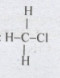
Loigiaihay.com
Các bài khác cùng chuyên mục
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu
- Đề số 9 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 8 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 7 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Đề số 6 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
- Phương pháp giải bài tập về độ rượu












Danh sách bình luận