Bài 5 trang 101 SGK Hóa học 10
Cân bằng phương trình hóa học
Đề bài
Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau bằng các phương pháp thăng bằng electron :
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
b) HNO3 + HCl → NO + Cl2 + H2O
c) HClO3 + HCl → Cl2 + H2O
d) PbO2 + HCl → PbCl2 + Cl2 + H2O
Video hướng dẫn giải
Phương pháp giải - Xem chi tiết
Bước 1: Xác định số oxi hóa của các nguyên tố trước và sau phản ứng để xác định được chất khử và chất oxi hóa
- Bước 2: viết các quá trình nhường e, nhận e
- Bước 3: tìm hệ số thích hợp cho chất khử và chất oxi hóa
- Bước 4: đặt các hệ số chất khử và chất oxi hóa vào sơ đồ phản ứng. hoàn thành phương trình hóa học.
Lời giải chi tiết
Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau bằng các phương pháp thăng bằng electron:
a) 2\(\overset{+7}{KMnO_{4}}\)+ 16\(\overset{-1}{HCl}\)→ 2KCl + 2\(\overset{+2}{MnCl_{2}}\) + 5\(\overset{0}{Cl_{2}}\) + 8H2O
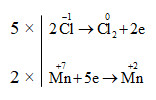
b) \(6\overset{-1}{HCl}\) + \(2\overset{+5}{HNO_{3}}\) → \(2\overset{+2}{NO}\) + 3\(\overset{0}{Cl_{2}}\) +4 H2O
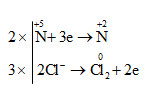
c) 5\(\overset{-1}{HCl}\) + \(\overset{+5}{HClO_{3}}\) → 3\(\overset{0}{Cl_{2}}\)+ 3H2O
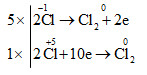
d) \(\overset{+4}{PbO_{2}}\) + 4\(\overset{-1}{HCl}\) → \(\overset{+2}{PbCl_{2}}\)+\(\overset{0}{Cl_{2}}\) + 2H2O
Loigiaihay.com
Các bài khác cùng chuyên mục





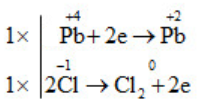








Danh sách bình luận