Bài 25: Flo - Brom - Iot
Flo là halogen có tính OXH mạnh nhất.
I. FLO
1. Tính chất vật lý và trạng thái tự nhiên
- Là chất khí màu lục nhạt, rất độc
- Trong tự nhiên tồn tại ở dạng hợp chất, chủ yếu có trong các chất khoáng dạng muối florua CaF2,…, trong men răng người, động vật và một số loài cây
2. Tính chất hóa học
Flo là phi kim có tính OXH mạnh nhất
a) Tác dụng với tất cả các KL
F2 + Ca \(\to \) CaF2
F2 + 2Ag \(\to \) 2AgF
b) Tác dụng với hiđro
Phản ứng xảy ra mạnh hơn các halogen khác, hỗn hợp H2 và F2 nổ mạnh ngay trong bóng tối ở nhiệt độ –252oC.
F2 + H2 \(\to \) 2HF
c) Tác dụng với nước
Khí flo qua nước nóng sẽ làm nước bốc cháy
2F2 + 2H2O \(\to \) 4HF + O2
=> F2 không đẩy Cl2, Br2, I2 ra khỏi dung dịch muối hoặc axit trong khi flo có tính oxi hóa mạnh hơn.
3. Ứng dụng
- Điều chế dẫn xuất hidro cacbon. (floroten, teflon, ...)
- Dùng trong công nghiệp hạt nhân, làm thuốc chống sâu răng.
4. Sản xuất flo trong công nghiệp
Điện phân hỗn hợp KF và HF (hỗn hợp ở thể lỏng)
II. BROM VÀ IOT
|
|
BROM |
IOT |
|
Trạng thái tự nhiên và tính chất vật lý |
- Là chất lỏng màu nâu, dễ bay hơi, độc. - Tan trong nước, nhưng tan nhiều hơn trong dung môi hữu cơ - Trong tự nhiên brom chủ yếu tồn tại ở dạng hợp chất (nước biển có chứa lượng nhỏ NaBr) |
- Là chất rắn, dạng tinh thể màu đen tím. Khi đun nóng, iot sẽ thăng hoa. - Tan rất ít trong nước, nhưng tan nhiều trong dung môi hữu cơ - Tồn tại chủ yếu ở dạng hợp chất (có trong rong biển) |
|
Tính chất hóa học |
a. Tác dụng với kim loại Br2 + 2Na \(\xrightarrow{{{t}^{o}}}\) 2NaBr 3Br2 + 2Fe \(\xrightarrow{{{t}^{o}}}\) 2FeBr3 b. Tác dụng với hidro H2 + Br2 \(\xrightarrow{{{t}^{o}}}\) 2HBr c. Tác dụng với nước Br2 + H2O \(\rightleftarrows \) HBr + HBrO d. Tác dụng với các hợp chất có tính khử Br2 + 2FeBr2 \(\xrightarrow{{{t}^{o}}}\) 2FeBr3 Br2 + H2S \(\xrightarrow{{{t}^{o}}}\) 2HBr + S 4Br2 + H2S + 4H2O \(\to \) 8HBr + H2SO4 |
a. Tác dụng với kim loại I2 + 2Na \(\xrightarrow{{{t}^{o}}}\) 2NaI I2 + Fe \(\xrightarrow{{{t}^{o}}}\) FeI2 b. Tác dụng với hidro H2 + I2 \(\xrightarrow{{{t}^{o}}}\) 2HI c. Tác dụng với nước Iot hầu như không tác dụng với nước d. Iot tạo phức với hồ tinh bột tạo thành hợp chất có màu xanh.
|
|
Điều chế |
Người ta điều chế brom từ nước biển Cl2 + NaBr →NaCl + Br2 |
Người ta điều chế iot từ rong biển |
|
Ứng dụng |
- Sản xuất dẫn xuất hidro cacbon, AgBr, dùng cho công nghiệp dầu mỏ, hóa chất cho nông nghiệp, phẩm nhuộm. |
- Sản xuất dược phẩm, phòng bệnh bướu cổ do thiếu iot. |
Video mô phỏng - Ứng dụng halogen và hợp chất halogen
Sơ đồ tư duy: Flo - Brom - Iot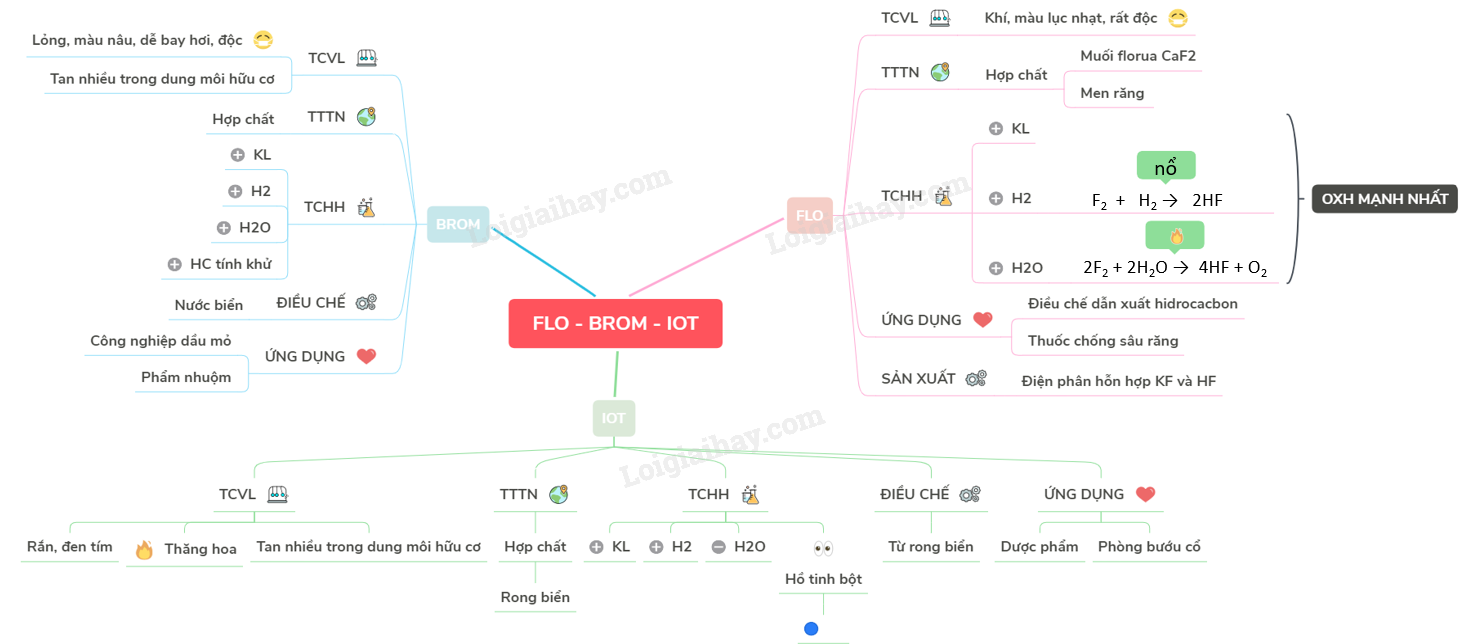
Loigiaihay.com
Các bài khác cùng chuyên mục












