Trắc nghiệm Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học Khoa học tự nhiên 8 Kết nối tri thức có đáp án
Đề bài
Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxygen (đkc) đã dùng.
-
A.
51g và 18,6 lít
-
B.
51g và 33,6 lít
-
C.
51g và 22,4 lít
-
D.
102g và 16,8 lít
Magie tác dụng với axit clohiđric:
Mg + 2HCl → MgCl2 + H2↑
Nếu có 12g Mg tham gia phản ứng, em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
-
A.
a) VH2(đktc) = 22,4 (lít) ; b) mHCl = 36,5 (g)
-
B.
a) VH2(đktc) = 11,2 (lít) ; b) mHCl = 18,25 (g)
-
C.
a) VH2(đktc) = 22,4 (lít) ; b) mHCl = 73 (g)
-
D.
a) VH2(đktc) = 11,2 (lít) ; b) mHCl = 36,5 (g)
Hòa tan hoàn toàn 11,2 gam sắt (Fe) trong axit clohiđric (HCl) thu được muối sắt clorua (FeCl2) và khí hiđro (H2).
a. Viết phương trình hóa học xảy ra.
b. Tính thể tích khí hiđro (H2) thu được ở điều kiện tiêu chuẩn.
c. Tính khối lượng axit clohiđric (HCl) đã tham gia phản ứng.
-
A.
a) Fe + HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 7,3 (g)
-
B.
a) Fe + 2HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 2,24 (l) ; c) mHCl = 14,6 (g)
-
C.
a) Fe + HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 14,6 (g)
-
D.
a) Fe + 2HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 14,6 (g)
Cho phương trình hóa học sau: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 gam CaO ?
-
A.
0,1 mol.
-
B.
0,3 mol.
-
C.
0,2 mol.
-
D.
0,4 mol.
Muốn điều chế được 7 gam CaO cần dùng bao nhiêu gam CaCO3?
-
A.
1,25 gam.
-
B.
125 gam.
-
C.
0,125 gam.
-
D.
12,5 gam
Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
-
A.
7,84 lít.
-
B.
78,4 lít.
-
C.
15,68 lít.
-
D.
156,8 lít.
Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
-
A.
mchất rắn tham gia = 60 gam và mchất rắn tạo thành = 40 gam.
-
B.
mchất rắn tham gia = 60 gam và mchất rắn tạo thành = 33,6 gam.
-
C.
mchất rắn tham gia = 33,6 gam và mchất rắn tạo thành = 60 gam.
-
D.
mchất rắn tham gia = 40 gam và mchất rắn tạo thành = 60 gam.
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
-
A.
11,2 lít.
-
B.
3,36 lít.
-
C.
2,24 lít.
-
D.
4,48 lít.
Tính thể tích của oxygen (đkc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
-
A.
1,4 lít.
-
B.
2,24 lít.
-
C.
3,1 lít.
-
D.
2,8 lít.
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
-
A.
1,6 gam.
-
B.
3,2 gam.
-
C.
4,8 gam.
-
D.
6,4 gam.
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Cho 112 gam Fe tác dụng hết với dung dịch axit clohiđric HCl tạo ra muối sắt (II) clorua FeCl2 và 4 gam khí hiđro H2. Khối lượng axit HCl đã tham gia phản ứng là:
-
A.
146 gam
-
B.
156 gam
-
C.
78 gam
-
D.
200 gam
Đốt cháy hoàn toàn 0,2 mol Al trong khí Cl2 thu được 16,02 gam AlCl3. Số mol khí Cl2 đã phản ứng là
-
A.
0,18 mol
-
B.
0,12 mol
-
C.
0,3 mol
-
D.
0,2 mol
Cho 0,2 mol NaOH phản ứng với 0,2 mol H2SO4 thu được dung dịch A. Biết sơ đồ phản ứng: $NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}O$. Tổng khối lượng chất tan trong A là
-
A.
14,2 gam.
-
B.
9,8 gam.
-
C.
24 gam.
-
D.
28 gam.
Theo sơ đồ: Cu + O2 → CuO. Nếu cho 3,2 gam Cu tác dụng với 0,8 gam O2. Khối lượng CuO thu được là
-
A.
2 gam.
-
B.
1,6 gam.
-
C.
3,2 gam.
-
D.
4 gam.
Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloride acid(HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở dkc là
-
A.
2,2400 lít.
-
B.
2,4790 lít.
-
C.
1,2395 lít.
-
D.
4,5980 lít.
Nhiệt phân potassium chlorate (KClO3) thu được potassium chloride (KCl) và khí oxygen theo sơ đồ phản ứng: KClO3 🡪KCl + O2. Biết khối lượng potassium chlorate đem nung là 36,75 gam, thể tích khí oxygen thu được là 6,69 lít (ở dkc). Hiệu suất của phản ứng là
-
A.
54,73%
-
B.
60,00%
-
C.
90,00%
-
D.
70,00%
Đốt cháy than đá (thành phần chính của carbon) sinh ra khí carbon dioxide theo phương trình hóa học sau: C + O2 🡪 CO2 Biết khối lượng than đá đem đốt là 30 gam, thể tích khí CO2 đo được (ở dkc) là 49,58 lít. Thành phần phần trăm về khối lượng của carbon trong than đá là
-
A.
40,0%.
-
B.
66,9%.
-
C.
80,0%.
-
D.
6,7%.
Một lá sắt (iron) nặng 28g để ngoài không khí, xảy ra phản ứng với oxygen tạo ra gỉ sắt. Sau một thời gian, cân lại lá sắt, thấy khối lượng thu được là 31,2g. Khối lượng khí oxygen đã phản ứng là
-
A.
3,2 g
-
B.
1,6g
-
C.
6,4 g
-
D.
24,8g
Nhúng một thành Zn vào dung dịch CuSO4, Zn phản ứng tạo muối ZnSO4 và kim loại Cu bám vào thanh Zn. Phản ứng xảy ra như sau:
Zn + CuSO4 🡪 ZnSO4 + Cu
Vậy nếu 13g Zn phản ứng thì khối lượng thanh kim loại:
-
A.
giảm 13g
-
B.
tăng 12,8g
-
C.
tăng 0,2g
-
D.
giảm 0,2g
Nung một lượng đá vôi CaCO3 có khối lượng 12g, thu được hỗn hợp rắn có khối lượng 8,4g. Khối lượng của khí CO2 thoát ra là
-
A.
3,6g
-
B.
2,8g
-
C.
1,2g
-
D.
2,4g
Nếu đốt 12 gam carbon trong oxygen dư thu được 39,6 gam CO2 thì hiệu suất phản ứng là:
-
A.
90%
-
B.
85%
-
C.
100%
-
D.
95%
Lời giải và đáp án
Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxygen (đkc) đã dùng.
-
A.
51g và 18,6 lít
-
B.
51g và 33,6 lít
-
C.
51g và 22,4 lít
-
D.
102g và 16,8 lít
Đáp án : A
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học.
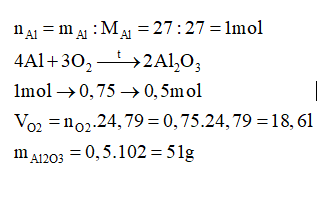
Magie tác dụng với axit clohiđric:
Mg + 2HCl → MgCl2 + H2↑
Nếu có 12g Mg tham gia phản ứng, em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
-
A.
a) VH2(đktc) = 22,4 (lít) ; b) mHCl = 36,5 (g)
-
B.
a) VH2(đktc) = 11,2 (lít) ; b) mHCl = 18,25 (g)
-
C.
a) VH2(đktc) = 22,4 (lít) ; b) mHCl = 73 (g)
-
D.
a) VH2(đktc) = 11,2 (lít) ; b) mHCl = 36,5 (g)
Đáp án : D
Số mol của 12 g Mg là: \({n_{Mg}} = {{{m_{Mg}}} \over {{M_{Mg}}}} = {{12} \over {24}} = 0,5\,(mol)\)
PTPƯ: Mg + 2HCl → MgCl2 + H2↑
Theo PTP Ư: 1 2 1 (mol)
Theo đề bài: 0,5 x=? y = ? (mol)
Tìm x, y từ đó tính được VH2(đktc) và mHCl = ?
Số mol của 12 g Mg là: \({n_{Mg}} = {{{m_{Mg}}} \over {{M_{Mg}}}} = {{12} \over {24}} = 0,5\,(mol)\)
PTPƯ: Mg + 2HCl → MgCl2 + H2↑
Theo PTP Ư: 1 2 1 (mol)
Theo đề bài: 0,5 x=? y = ? (mol)
a) số mol H2 sinh ra là: y = nH2 = \({{0,5 \times 1} \over 1} = 0,5\,(mol)\)
=> Thể tích của H2 thu được ở đktc là: VH2(ĐKTC) =nH2×22,4 = 0,5×22,4 = 11,2 (lít)
b) Số mol HCl phản ứng là: x = nHCl = \({{0,5 \times 2} \over 1} = 1\,(mol)\)
Khối lượng HCl tham gia phản ứng là: mHCl = nHCl×MHCl = 1. 36,5 = 36,5 (g)
Hòa tan hoàn toàn 11,2 gam sắt (Fe) trong axit clohiđric (HCl) thu được muối sắt clorua (FeCl2) và khí hiđro (H2).
a. Viết phương trình hóa học xảy ra.
b. Tính thể tích khí hiđro (H2) thu được ở điều kiện tiêu chuẩn.
c. Tính khối lượng axit clohiđric (HCl) đã tham gia phản ứng.
-
A.
a) Fe + HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 7,3 (g)
-
B.
a) Fe + 2HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 2,24 (l) ; c) mHCl = 14,6 (g)
-
C.
a) Fe + HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 14,6 (g)
-
D.
a) Fe + 2HCl →FeCl2 + H2↑ ; b) VH2(ĐKTC) = 4,48 (l) ; c) mHCl = 14,6 (g)
Đáp án : D
\({n_{Fe}} = {{{m_{Fe}}} \over {{M_{Fe}}}} = {{11,2} \over {56}} = 0,2\,(mol)\)
a. Fe + 2 HCl →FeCl2 + H2↑
Theo PT: 1 2 1 (mol)
Theo ĐB: 0,2 x = ? y = ? (mol)
b. Tìm ra \(y = {{0,2 \times 1} \over 1} = ? \Rightarrow {V_{{H_2}(dktc)}} = 22,4 \times y = ?\,(l)\)
c. Tìm ra \(x = {{0,2 \times 2} \over 1} = ? \Rightarrow {m_{HCl}} = {n_{HCl}} \times {M_{HCl}} = 36,5 \times x = ?\,(g)\)
a. Fe + 2 HCl →FeCl2 + H2↑
b. \({n_{Fe}} = {{{m_{Fe}}} \over {{M_{Fe}}}} = {{11,2} \over {56}} = 0,2\,(mol)\)
Theo phương trình hóa học: \({n_{{H_2}}} = {n_{Fe}} = 0,2\,(mol)\)
\({V_{{H_2}(dktc)}} = {n_{{H_2}}} \times 22,4 = 0,2 \times 22,4 = 4,48\,(l)\)
c. Theo phương trình hóa học: \({n_{HCl}} = 2{n_{Fe}} = 2 \times 0,2 = 0,4\,(mol)\)
mHCl = nHCl × MHCl = 0,4 × 36,5 = 14,6 (g)
Cho phương trình hóa học sau: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 gam CaO ?
-
A.
0,1 mol.
-
B.
0,3 mol.
-
C.
0,2 mol.
-
D.
0,4 mol.
Đáp án: C
Tính số mol CaO
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}}$
Số mol CaO là : ${n_{Ca{\text{O}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}} = 0,2{\text{ }}mol$
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
Muốn điều chế được 7 gam CaO cần dùng bao nhiêu gam CaCO3?
-
A.
1,25 gam.
-
B.
125 gam.
-
C.
0,125 gam.
-
D.
12,5 gam
Đáp án: D
Tính số mol CaO
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}}$ => khối lượng CaCO3
Số mol CaO là : ${n_{Ca{\text{O}}}} = \dfrac{7}{{56}} = 0,125\,mol$
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol
?mol 0,2mol
Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}} = 0,125{\text{ }}mol$
=> khối lượng CaCO3 cần dùng là: ${m_{CaC{O_3}}} = n.M = 0,125.100 = 12,5\,gam$
Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
-
A.
7,84 lít.
-
B.
78,4 lít.
-
C.
15,68 lít.
-
D.
156,8 lít.
Đáp án: B
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol 1mol
? mol 3,5 mol
Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}}$ => Thể tích khí CO2 là: ${V_{C{O_2}}} = 22,4.n$
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol 1mol
? mol 3,5 mol
Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 3,5\,mol$
=> Thể tích khí CO2 là: ${V_{C{O_2}}} = 22,4.n = 22,4.3,5 = 78,4{\text{ }}lít$
Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
-
A.
mchất rắn tham gia = 60 gam và mchất rắn tạo thành = 40 gam.
-
B.
mchất rắn tham gia = 60 gam và mchất rắn tạo thành = 33,6 gam.
-
C.
mchất rắn tham gia = 33,6 gam và mchất rắn tạo thành = 60 gam.
-
D.
mchất rắn tham gia = 40 gam và mchất rắn tạo thành = 60 gam.
Đáp án: B
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol 1mol
? mol ? mol 0,6 mol
Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaO}} = {n_{CaC{{\text{O}}_3}}}$
Khối lượng CaCO3 phản ứng là: ${m_{CaC{{\text{O}}_3}}} = n.M$
Khối lượng CaO tạo thành là: mCaO = n.M
Số mol khí CO2 thu được là: ${n_{C{O_2}}} = \dfrac{{13,44}}{{22,4}} = 0,6\,mol$
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
Tỉ lệ theo PT: 1mol 1mol 1mol
? mol ? mol 0,6 mol
Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaO}} = {n_{CaC{{\text{O}}_3}}} = 0,6\,mol$
Khối lượng CaCO3 phản ứng là: ${m_{CaC{{\text{O}}_3}}} = n.M = 0,6.100 = 60\,gam$
Khối lượng CaO tạo thành là: mCaO = n.M = 0,6.56 = 33,6 gam
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
-
A.
11,2 lít.
-
B.
3,36 lít.
-
C.
2,24 lít.
-
D.
4,48 lít.
Đáp án : C
+) Tính số mol Zn : ${n_{Zn}} = \dfrac{{13}}{{65}}$
PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2}$ => Thể tích O2 là: V = n.22,4
Số mol Zn là: ${n_{Zn}} = \dfrac{{13}}{{65}} = 0,2\,mol$
PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2} = 0,1\,mol$
=> Thể tích O2 là: V = n.22,4 = 0,1.22,4 = 2,24 lít
Tính thể tích của oxygen (đkc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
-
A.
1,4 lít.
-
B.
2,24 lít.
-
C.
3,1 lít.
-
D.
2,8 lít.
Đáp án : C
+) Tính số mol P phản ứng
PTHH: 4P + 5O2 $\xrightarrow{{{t^o}}}$ 2P2O5
Tỉ lệ theo PT: 4mol 5mol 2mol
1mol ?mol
Từ PTHH, ta có: ${n_{{O_2}}} = \dfrac{{0,1.5}}{4}$ => Thể tích oxi cần dùng là: V = 24,79.n
Số mol P phản ứng là: ${n_P} = \dfrac{{3,1}}{{31}} = 0,1\,mol$
PTHH: 4P + 5O2 $\xrightarrow{{{t^o}}}$ 2P2O5
Tỉ lệ theo PT: 4mol 5mol
1mol ? mol
Nhân chéo chia ngang ta được: ${n_{{O_2}}} = \dfrac{{0,1.5}}{4}$ $ = 0,125\,mol$
=> Thể tích oxi cần dùng là: V = 22,4.n = 24,79.0,125 = 3,1 lít
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
-
A.
1,6 gam.
-
B.
3,2 gam.
-
C.
4,8 gam.
-
D.
6,4 gam.
Đáp án : B
+) Tính số mol của S tham gia phản ứng
+) Viết PTHH và tính theo tỉ lệ mol
S + O2 $\xrightarrow{{{t^o}}}$ SO2
Tỉ lệ theo PT: 1mol 1mol
0,05mol ?mol
Theo phương trình hóa học, ta có: ${n_{S{O_2}}} = {n_S}$ => khối lượng
Số mol của S tham gia phản ứng: ${n_S} = \frac{{16}}{{32}} = 0,05{\text{ }}mol$
Phương trình hóa học của S cháy trong không khí:
S + O2 $\xrightarrow{{{t^o}}}$ SO2
Tỉ lệ theo PT: 1mol 1mol
0,05mol ?mol
Theo phương trình hóa học, ta có: ${n_{S{O_2}}} = {n_S}$ $ = 0,05{\text{ }}mol$
=> khối lượng khí lưu huỳnh đioxit sinh ra là
${m_{S{O_2}}} = n.M = 0,05.64 = 3,2\,gam$
Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
-
A.
Fe là chất hết.
-
B.
HCl là chất hết.
-
C.
Cả 2 chất cùng hết.
-
D.
Cả 2 chất cùng dư.
Đáp án : B
Tính số mol Fe : nFe = mFe : MFe = ? (mol)
Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết.
nFe = 5,6 : 56 = 0,1 (mol)
Fe + 2HCl \( \to\) FeCl2 + H2
Theo phương trình 1 2 (mol)
Theo đề bài: 0,1 0,15 (mol)
Ta thấy : \(\dfrac{{0,1}}{1} > \dfrac{{0,15}}{2}\). Do vậy HCl là chất phản ứng hết, Fe là chất còn dư.
Cho 112 gam Fe tác dụng hết với dung dịch axit clohiđric HCl tạo ra muối sắt (II) clorua FeCl2 và 4 gam khí hiđro H2. Khối lượng axit HCl đã tham gia phản ứng là:
-
A.
146 gam
-
B.
156 gam
-
C.
78 gam
-
D.
200 gam
Đáp án : A
Đầu bài cho số mol của chất tham gia và số mol của sản phẩm => lập PTHH và tính theo sản phẩm
Vì đầu bài cho số mol của chất tham gia và số mol của sản phẩm => tính toán theo số mol sản phẩm
Số mol khí H2 là: ${n_{{H_2}}} = \frac{4}{2} = 2\,mol$
PTHH: Fe + 2HCl → FeCl2 + H2
Tỉ lệ PT: 2mol 1mol
Phản ứng: 4mol ← 2mol
=> Khối lượng HCl đã phản ứng là: mHCl = 4.36,5 = 146 gam
Đốt cháy hoàn toàn 0,2 mol Al trong khí Cl2 thu được 16,02 gam AlCl3. Số mol khí Cl2 đã phản ứng là
-
A.
0,18 mol
-
B.
0,12 mol
-
C.
0,3 mol
-
D.
0,2 mol
Đáp án : A
Đầu bài cho số mol của chất tham gia và số mol của sản phẩm => lập PTHH và tính theo sản phẩm
Số mol AlCl3 là: ${n_{AlC{l_3}}} = \frac{{16,02}}{{133,5}} = 0,12\,mol$
Vì đầu bài cho số mol của chất tham gia và số mol của sản phẩm => tính toán theo số mol sản phẩm
PTHH: 2Al + 3Cl2 $\xrightarrow{{{t^o}}}$ 2AlCl3
Tỉ lệ PT: 3 mol 2 mol
Phản ứng: 0,18 mol ← 0,12 mol
=> số mol khí Cl2 phản ứng là 0,18 mol
Cho 0,2 mol NaOH phản ứng với 0,2 mol H2SO4 thu được dung dịch A. Biết sơ đồ phản ứng: $NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}O$. Tổng khối lượng chất tan trong A là
-
A.
14,2 gam.
-
B.
9,8 gam.
-
C.
24 gam.
-
D.
28 gam.
Đáp án : C
+) Viết PTHH
+) Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2}$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1}$ => chất phản ứng hết, chất dư
=> tính sản phẩm theo chất hết
+) khối lượng chất tan trong A = khối lượng chất dư + khối lượng Na2SO4
PTHH: $2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O$
Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2} = \frac{{0,2}}{2} = 0,1$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1} = \frac{{0,2}}{1} = 0,2$
Vì 0,1 < 0,2 => NaOH phản ứng hết, H2SO4 còn dư
=> phản ứng tính theo NaOH
PTHH: $2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O$
Tỉ lệ PT: 2 1 1
Ban đầu: 0,2 0,2 0 (mol)
Phản ứng 0,2 0,1 0,1 (mol)
Sau pư: 0 0,1 0,1 (mol)
dung dich A có: $\left\{ \begin{gathered}N{a_2}S{O_4}:0,1(mol) \hfill \\{H_2}S{O_4}du:0,1(mol) \hfill \\ \end{gathered} \right.$
=> tổng khối lượng chất tan trong A là: 14,2 + 9,8 = 24 gam
Theo sơ đồ: Cu + O2 → CuO. Nếu cho 3,2 gam Cu tác dụng với 0,8 gam O2. Khối lượng CuO thu được là
-
A.
2 gam.
-
B.
1,6 gam.
-
C.
3,2 gam.
-
D.
4 gam.
Đáp án : D
+) Tính số mol Cu và số mol O2
+) Xét tỉ lệ: $\dfrac{{{n_{Cu}}}}{2}$ và $\dfrac{{{n_{{O_2}}}}}{1}$ => chất dư thừa hoặc vừa đủ, phản ứng tính theo chất phản ứng hết
Số mol Cu là: ${n_{Cu}} = \dfrac{{3,2}}{{64}} = 0,05\,mol$
Số mol O2 là: ${n_{{O_2}}} = \dfrac{{0,8}}{{32}} = 0,025\,mol$
PTHH: 2Cu + O2 → 2CuO
Xét tỉ lệ: $\dfrac{{{n_{Cu}}}}{2} = \dfrac{{0,05}}{2} = 0,025$ và $\dfrac{{{n_{{O_2}}}}}{1} = \dfrac{{0,025}}{1} = 0,025$
Vì tỉ lệ $\dfrac{{{n_{Cu}}}}{2} = \dfrac{{{n_{{O_2}}}}}{1}$ => phản ứng vừa đủ => tính theo Cu hoặc O2 đều được
PTHH: 2Cu + O2 → 2CuO
2mol 2mol
0,05mol → 0,05mol
=> khối lượng CuO thu được là: mCuO = 0,05.80 = 4 gam
Cách 2: Vì các chất đều phản ứng vừa đủ => áp dụng định luật bảo toàn khối lượng ta có:
${m_{CuO}} = {m_{Cu}} + {m_{{O_2}}} = 3,2 + 0,8 = 4\,gam$
Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloride acid(HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở dkc là
-
A.
2,2400 lít.
-
B.
2,4790 lít.
-
C.
1,2395 lít.
-
D.
4,5980 lít.
Đáp án : C
Dựa vào số mol và phương trình hóa học
Phương trình hóa học : Mg + 2HCl -> MgCl2 + H2
Theo đề bài nMg = 4,824 =0,2 (mol) nHCl =3,65 : 36,5= 0,1 mol
Theo phương trình hóa học:
Cứ 1 mol Mg phản ứng với 2 mol HCl, do đó số mol của Mg còn dư, tính theo HCl
nH2 = \(\frac{1}{2}\)x n HCl=\(\frac{1}{2}\)x 0,1=0,05
- V H2 = 0,05 x 24,79 = 1,2395 lít
Nhiệt phân potassium chlorate (KClO3) thu được potassium chloride (KCl) và khí oxygen theo sơ đồ phản ứng: KClO3 🡪KCl + O2. Biết khối lượng potassium chlorate đem nung là 36,75 gam, thể tích khí oxygen thu được là 6,69 lít (ở dkc). Hiệu suất của phản ứng là
-
A.
54,73%
-
B.
60,00%
-
C.
90,00%
-
D.
70,00%
Đáp án : B
Dựa vào số mol và phương trình hóa học
Phương trình hóa học : 2KClO3 🡪2 KCl + 3O2
Theo đề bài n KClO3= mKClO3 :MKClO3 =36,75 : 122,5=0,3 (mol)
Theo phương trình hóa học : n O2 = \(\frac{3}{2}\)x nKClO3=\(\frac{3}{2}\)x 0,3=0,45
-> V O2 = 0,45 x 24,79 = 11,16
Hiệu suất của phản ứng là : H% = 6,6911,16x 100%=60%
Đáp án: B
Đốt cháy than đá (thành phần chính của carbon) sinh ra khí carbon dioxide theo phương trình hóa học sau: C + O2 🡪 CO2 Biết khối lượng than đá đem đốt là 30 gam, thể tích khí CO2 đo được (ở dkc) là 49,58 lít. Thành phần phần trăm về khối lượng của carbon trong than đá là
-
A.
40,0%.
-
B.
66,9%.
-
C.
80,0%.
-
D.
6,7%.
Đáp án : C
Dựa vào số mol và phương trình hóa học
Phương trình hóa học : C + O2 🡪 CO2
Theo đề bài n CO2= VCO2:24,79 =49,58 : 24,79=2 mol
Theo phương trình hóa học: nC = nCO2 = 2 mol 🡪 mC = 2 x 12= 24 gam
Thành phần phần trăm về khối lượng của carbon trong than đá là:
24 : 30x 100%=80%
Một lá sắt (iron) nặng 28g để ngoài không khí, xảy ra phản ứng với oxygen tạo ra gỉ sắt. Sau một thời gian, cân lại lá sắt, thấy khối lượng thu được là 31,2g. Khối lượng khí oxygen đã phản ứng là
-
A.
3,2 g
-
B.
1,6g
-
C.
6,4 g
-
D.
24,8g
Đáp án : A
Áp dụng định luật bảo toàn khối lượng
mo2 = mgỉ sắt – mFe = 31,2 – 28 = 3,2g
Nhúng một thành Zn vào dung dịch CuSO4, Zn phản ứng tạo muối ZnSO4 và kim loại Cu bám vào thanh Zn. Phản ứng xảy ra như sau:
Zn + CuSO4 🡪 ZnSO4 + Cu
Vậy nếu 13g Zn phản ứng thì khối lượng thanh kim loại:
-
A.
giảm 13g
-
B.
tăng 12,8g
-
C.
tăng 0,2g
-
D.
giảm 0,2g
Đáp án : D
Tính số mol Zn phản ứng, mol Cu tạo ra. Lấy khối lượng thanh Zn phản ứng – khối lượng Cu bám vào.
nZn = 13 : 65 = 0,2 mol
nCu = nZn = 0,2 mol
Khối lượng thanh kim loai giảm: mZn – mCu = 13 – 0,2.64 = 0,2g
Nung một lượng đá vôi CaCO3 có khối lượng 12g, thu được hỗn hợp rắn có khối lượng 8,4g. Khối lượng của khí CO2 thoát ra là
-
A.
3,6g
-
B.
2,8g
-
C.
1,2g
-
D.
2,4g
Đáp án : A
Áp dụng định luật bảo toàn khối lượng
mCaCO3 = mChất rắn + mCO2 -> mCO2 = 12 – 8,4 = 3,6g
Nếu đốt 12 gam carbon trong oxygen dư thu được 39,6 gam CO2 thì hiệu suất phản ứng là:
-
A.
90%
-
B.
85%
-
C.
100%
-
D.
95%
Đáp án : A
\(H = \frac{{36,9}}{{44}}.100 = 90\% \)
Đáp án A
Luyện tập và củng cố kiến thức Bài 6: Tính theo phương trình hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7: Tốc độ phản ứng và chất xúc tác với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4: Dung dịch và nồng độ với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 3: Mol và tỉ khối chất khí với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 2: Phản ứng hóa học với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 47: Bảo vệ môi trường Khoa học tự nhiên 8 Kết nối tri thức
- Trắc nghiệm Bài 46: Cân bằng tự nhiên Khoa học tự nhiên 8 Kết nối tri thức
- Trắc nghiệm Bài 45: Sinh quyển Khoa học tự nhiên 8 Kết nối tri thức
- Trắc nghiệm Bài 44: Hệ sinh thái Khoa học tự nhiên 8 Kết nối tri thức
- Trắc nghiệm Bài 43: Quần xã sinh vật Khoa học tự nhiên 8 Kết nối tri thức










Danh sách bình luận