Trắc nghiệm Bài 3: Ôn tập chương 1 Hóa 11 Kết nối tri thức
Đề bài
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng như sau:
(H2) = (I2) = 0,22M; (HI)=0,71M
Tính hằng số cân bằng KC của phản ứng.
-
A.
14,67.
-
B.
3,23.
-
C.
10,42.
-
D.
2, 29.
Cho cân bằng sau ∆H < 0.
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng Fe2O3; (3) giảm một lượng CO; (4) thêm chất xúc tác. Số lượng các yếu tố làm cân bằng chuyển dịch theo chiều thuận là
-
A.
1.
-
B.
4.
-
C.
3.
-
D.
2.
Cho phản ứng hóa học sau: \(C{O_{(k)}} + C{l_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} COC{l_2}_{(k)}\) có KC = 8,3
Biết rằng ở toC nồng độ cân bằng của CO là 0,20 mol/L và của Cl2 là 0,25 mol/L. Nồng độ cân bằng của COCl2 ở toC là
-
A.
0,644 mol/L.
-
B.
0,415 mol/L.
-
C.
0,615 mol/L.
-
D.
0,700 mol/L.
Dung dịch H2SO4 0,015M có
-
A.
pH = 1,82.
-
B.
pH =1,52.
-
C.
pH =12,48.
-
D.
(H+) = 0,015M
Dãy các chất điện li mạnh là
-
A.
Dung dịch CuCl2, dung dịch NaOH, dung dịch HNO3.
-
B.
Dung dịch HCl, dung dịch ethanol, glycerol.
-
C.
Dung dịch Al(NO3)3, dung dịch NaCl, dung dịch HF.
-
D.
Khí HCl, khí NO, khí O3.
(1)Cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) chuyển dịch theo chiều thuận khi tăng áp suất của hệ phản ứng.
(2) Cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0 không bị chuyển dịch khi tăng nhiệt độ của hệ.
(3) Cân bằng hóa học:\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H<0 không bị chuyển dịch khi thay đổi áp suất của hệ.
(4) Hằng số cân bằng của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
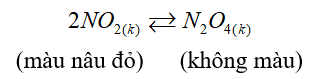
Số nhận định đúng là:
-
A.
1.
-
B.
3.
-
C.
2.
-
D.
4.
pH của dung dịch nào sau đây có giá trị nhỏ nhất?
-
A.
Dung dịch CH3COOH 0,1M.
-
B.
Dung dịch NaNO3 0,1M.
-
C.
Dung dịch KOH 0,1M
-
D.
Dung dịch H2SO4 0,1M
Phương trình ion rút gọn: H+ + OH-→ H2O
Tương ứng với PTHH dạng phân tử nào sau đây?
(1) 2HCl + Mg(OH)2→ MgCl2 + 2H2O
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O
(3) Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
(4) 2HCl + Ca(OH)2→ CaCl2 + 2H2O
-
A.
(1), (2).
-
B.
(2), (3).
-
C.
(2), (4).
-
D.
(1), (3).
Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch H2SO4 có pH = 1 là
-
A.
12mL.
-
B.
10mL.
-
C.
100mL.
-
D.
1mL.
Tiến hành chuẩn độ 10mL dung dịch HCl chưa biết nồng độ bằng dung dịch NaOH 0,1M. Tại điểm tương đương, thể tích NaOH đã dùng là 10mL. Vậy nồng độ của dịch HCl là:
-
A.
0,1M.
-
B.
0,2M.
-
C.
0,3M.
-
D.
0,5M.
Nhận định nào sau đây KHÔNG đúng?
-
A.
Dung dịch CH3COOH 0,01M có pH = 2.
-
B.
Dung dịch NH4NO3 có môi trường acid.
-
C.
Dung dịch Na2CO3 có môi trường base.
-
D.
Dung dịch H2SO4 0,01M có pH = 1,69 .
Hòa tan 4,9 g H2SO4 vào nước thu được 1lít dung dịch. pH của dd thu được là:
-
A.
1.
-
B.
3.
-
C.
2.
-
D.
4.
Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một acid (theo Bronsted – Lowry)
-
A.
H2O +HCl → H3O+ + Cl-
-
B.
Ca(HCO3)2 → CaCO3 + CO2 + H2O
-
C.
CO32- + H2O HCO3- + OH-
-
D.
CuSO4 + 5H2O → CuSO4.5H2O
Dung dịch NaOH 0,01M có pH là
-
A.
2.
-
B.
12.
-
C.
10.
-
D.
9.
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Hai biện pháp làm cân bằng chuyển dịch theo chiều thuận là:
-
A.
Giảm áp suất và giảm nhiệt độ.
-
B.
Tăng nhiệt độ và giảm áp suất.
-
C.
Tăng nhiệt độ và tăng áp suất.
-
D.
Giảm nhiệt độ và tăng áp suất.
Theo thuyết Bronsted – Lowry, H2O được là acid khi nó:
-
A.
Cho một electron.
-
B.
Nhận một electron.
-
C.
Cho một proton.
-
D.
Nhận một proton.
Cho 2 phương trình: S2- + H2O 🡪 HS- + OH- ; NH4+ + H2O 🡪 NH3 + H3O+
Theo thuyết acid – base của Bronsted – Lowry thì:
-
A.
S2- là acid, NH4+ là base.
-
B.
S2- là base, NH4+ là acid.
-
C.
S2- và NH4+ đều là base.
-
D.
S2- và NH4+ đều là acid.
Những người đau dạ dày thường có pH lớn hơn 2 trong dịch vị dạ dày. Để chữa dạ dày ta nên dùng?
-
A.
Nước nho và thuốc giảm đau dạ dày có chứa NaHCO3.
-
B.
Nước đun sôi để nguội và thuốc giảm đau dạ dày có chứa NaHCO3.
-
C.
Nước cam và thuốc giảm đau dạ dày có chứa NaHCO3.
-
D.
Vitamin C và thuốc giảm đau dạ dày có chứa NaHCO3.
Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch HCl có pH = 1 là
-
A.
12mL.
-
B.
10mL.
-
C.
100mL.
-
D.
1mL.
Đo pH của cốc giấm ăn được giá trị pH = 2,8. Nhận định nào sau đây KHÔNG đúng?
-
A.
Giấm ăn có môi trường acid.
-
B.
Nồng độ ion (H+) của giấm ăn là 10-2,8 ml/L.
-
C.
Nồng độ ion (H+) của giấm ăn là 0,28 mol/L.
-
D.
Nồng độ của ion (OH-) của giấm ăn nhỏ hơn 10-7 mol/L.
Lời giải và đáp án
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng như sau:
(H2) = (I2) = 0,22M; (HI)=0,71M
Tính hằng số cân bằng KC của phản ứng.
-
A.
14,67.
-
B.
3,23.
-
C.
10,42.
-
D.
2, 29.
Đáp án : C
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng KC của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({K_C} = \frac{{{{{\rm{(HI)}}}^2}}}{{{\rm{(}}{H_2})({I_2}{\rm{)}}}}\)
Thay các giá trị (HI) = 0,71M; (H2) = (I2) = 0,22M
Vậy \({K_C} = \frac{{{{{\rm{(0,71)}}}^2}}}{{{{{\rm{(0,22}})}^2}}}\)= 10,42
Cho cân bằng sau ∆H < 0.
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng Fe2O3; (3) giảm một lượng CO; (4) thêm chất xúc tác. Số lượng các yếu tố làm cân bằng chuyển dịch theo chiều thuận là
-
A.
1.
-
B.
4.
-
C.
3.
-
D.
2.
Đáp án : A
Dựa vào kiến thức về các yếu tố ảnh hưởng đến chuyển dịch cân bằng.
Các yếu tố ảnh hưởng đến chuyển dịch cân bằng: nhiệt độ, nồng độ và áp suất.
-Phản ứng trên tỏa nhiệt => Tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều thu nhiệt (chiều nghịch).
-Tăng nồng độ chất tham gia => Cân bằng sẽ chuyển dịch theo chiều thuận.
=> Các yếu tố làm cân bằng chuyển dịch theo chiều thuận là (2).
(3) giảm nồng độ CO cân bằng chuyển dịch theo chiều nghịch
(4) thêm chất xúc tác cân bằng không dịch chuyển
Cho phản ứng hóa học sau: \(C{O_{(k)}} + C{l_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} COC{l_2}_{(k)}\) có KC = 8,3
Biết rằng ở toC nồng độ cân bằng của CO là 0,20 mol/L và của Cl2 là 0,25 mol/L. Nồng độ cân bằng của COCl2 ở toC là
-
A.
0,644 mol/L.
-
B.
0,415 mol/L.
-
C.
0,615 mol/L.
-
D.
0,700 mol/L.
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng KC của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({K_C} = \frac{{{\rm{(}}COC{l_2}{\rm{)}}}}{{{\rm{(CO}})(C{l_2}{\rm{)}}}} = \frac{{{\rm{(}}COCl2)}}{{0,2.0,25}} = 8,3\)
=> (COCl2) = 8,3 x 0,2 x 0,25 = 0,415 mol/L
Dung dịch H2SO4 0,015M có
-
A.
pH = 1,82.
-
B.
pH =1,52.
-
C.
pH =12,48.
-
D.
(H+) = 0,015M
Đáp án : B
Dựa vào kiến thức về pH
H2SO4 → 2H+ + SO42-
0,015M → 0,03M
pH = -lg(H+) = -lg(0,03) ≈ 1,52 => Chọn B
Dãy các chất điện li mạnh là
-
A.
Dung dịch CuCl2, dung dịch NaOH, dung dịch HNO3.
-
B.
Dung dịch HCl, dung dịch ethanol, glycerol.
-
C.
Dung dịch Al(NO3)3, dung dịch NaCl, dung dịch HF.
-
D.
Khí HCl, khí NO, khí O3.
Đáp án : A
Dựa vào kiến thức về chất điện ly.
Các chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Các chất điện li mạnh thường gặp là: các acid mạnh (HCl, H2SO4, HNO3,…), các base mạnh (KOH, NaOH, Ca(OH)2, Ba(OH)2) và hầu hết các muối
(1)Cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) chuyển dịch theo chiều thuận khi tăng áp suất của hệ phản ứng.
(2) Cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0 không bị chuyển dịch khi tăng nhiệt độ của hệ.
(3) Cân bằng hóa học:\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H<0 không bị chuyển dịch khi thay đổi áp suất của hệ.
(4) Hằng số cân bằng của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
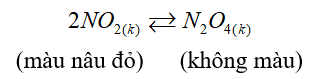
Số nhận định đúng là:
-
A.
1.
-
B.
3.
-
C.
2.
-
D.
4.
Đáp án : C
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Nhận định đúng: (1), (4).
pH của dung dịch nào sau đây có giá trị nhỏ nhất?
-
A.
Dung dịch CH3COOH 0,1M.
-
B.
Dung dịch NaNO3 0,1M.
-
C.
Dung dịch KOH 0,1M
-
D.
Dung dịch H2SO4 0,1M
Đáp án : D
Dựa vào kiến thức về pH
Môi trường acid sẽ có pH nhỏ hơn môi trường base và trung tính. => Chọn D
Phương trình ion rút gọn: H+ + OH-→ H2O
Tương ứng với PTHH dạng phân tử nào sau đây?
(1) 2HCl + Mg(OH)2→ MgCl2 + 2H2O
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O
(3) Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
(4) 2HCl + Ca(OH)2→ CaCl2 + 2H2O
-
A.
(1), (2).
-
B.
(2), (3).
-
C.
(2), (4).
-
D.
(1), (3).
Đáp án : C
Dựa vào kiến thức về phương trình ion rút gọn.
Chọn đáp án C
Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch H2SO4 có pH = 1 là
-
A.
12mL.
-
B.
10mL.
-
C.
100mL.
-
D.
1mL.
Đáp án : C
Dựa vào kiến thức về pH
pH = 1 => (H+) = 0,1
nNaOH = nH+ = 10-3 mol => VNaOH = 10-3/10-2 = 10-1 (lít) = 100 ml
Tiến hành chuẩn độ 10mL dung dịch HCl chưa biết nồng độ bằng dung dịch NaOH 0,1M. Tại điểm tương đương, thể tích NaOH đã dùng là 10mL. Vậy nồng độ của dịch HCl là:
-
A.
0,1M.
-
B.
0,2M.
-
C.
0,3M.
-
D.
0,5M.
Đáp án : A
Dựa vào kiến thức về chuẩn độ acid – base.
NaOH + HCl -> NaCl + H2O
Ta có: VHCl.CHCl = VNaOH.CNaOH => 10. CHCl =10.0,1 => CHCl = \(\frac{{10.0,1}}{{10}}\)= 0,1M
Nhận định nào sau đây KHÔNG đúng?
-
A.
Dung dịch CH3COOH 0,01M có pH = 2.
-
B.
Dung dịch NH4NO3 có môi trường acid.
-
C.
Dung dịch Na2CO3 có môi trường base.
-
D.
Dung dịch H2SO4 0,01M có pH = 1,69 .
Đáp án : A
Dựa vào kiến thức về pH, sự thủy phân ion.
Do dung dịch CH3COOH điện li không hoàn toàn => (H+) < 0,01 => pH dung dịch lớn hơn 2.
Hòa tan 4,9 g H2SO4 vào nước thu được 1lít dung dịch. pH của dd thu được là:
-
A.
1.
-
B.
3.
-
C.
2.
-
D.
4.
Đáp án : A
Dựa vào kiến thức về pH
nH2SO4 = 4,9/98 = 0,05 mol => CM(H2SO4) = 0,05/1 = 0,05 M
=>(H+) = 0,1 M => pH = -lg(0,1) = 1
Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một acid (theo Bronsted – Lowry)
-
A.
H2O +HCl → H3O+ + Cl-
-
B.
Ca(HCO3)2 → CaCO3 + CO2 + H2O
-
C.
CO32- + H2O HCO3- + OH-
-
D.
CuSO4 + 5H2O → CuSO4.5H2O
Đáp án : C
Dựa vào kiến thức về Thuyết acid – base của Bronsted – Lowry
Theo thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
Ở phương trình (B) H2O cho proton => H2O là acid
Dung dịch NaOH 0,01M có pH là
-
A.
2.
-
B.
12.
-
C.
10.
-
D.
9.
Đáp án : B
Dựa vào kiến thức về pH
NaOH -> Na+ + OH-
0,01M -> 0,01M
(OH-) = 0,01M => (H+)=\(\frac{{Kw}}{{{\rm{(O}}{{\rm{H}}^{\rm{ - }}}{\rm{)}}}} = \frac{{{{10}^{ - 14}}}}{{0,01}} = {10^{ - 12}}\)
pH = -lg(H+) = 12
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Hai biện pháp làm cân bằng chuyển dịch theo chiều thuận là:
-
A.
Giảm áp suất và giảm nhiệt độ.
-
B.
Tăng nhiệt độ và giảm áp suất.
-
C.
Tăng nhiệt độ và tăng áp suất.
-
D.
Giảm nhiệt độ và tăng áp suất.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
-Theo cân bằng trên: theo chiều thuận số mol khí giảm =>Cân bằng chuyển dịch theo chiều thuận nếu tăng áp suất.
-Phản ứng tỏa nhiệt => Cân bằng chuyển dịch theo chiều thuận nếu giảm nhiệt độ.
Theo thuyết Bronsted – Lowry, H2O được là acid khi nó:
-
A.
Cho một electron.
-
B.
Nhận một electron.
-
C.
Cho một proton.
-
D.
Nhận một proton.
Đáp án : C
Dựa vào kiến thức về Thuyết acid – base của Bronsted – Lowry.
Theo thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+).
Cho 2 phương trình: S2- + H2O 🡪 HS- + OH- ; NH4+ + H2O 🡪 NH3 + H3O+
Theo thuyết acid – base của Bronsted – Lowry thì:
-
A.
S2- là acid, NH4+ là base.
-
B.
S2- là base, NH4+ là acid.
-
C.
S2- và NH4+ đều là base.
-
D.
S2- và NH4+ đều là acid.
Đáp án : B
Dựa vào kiến thức về Thuyết acid – base của Bronsted – Lowry.
Theo thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
Theo 2 phương trình ta thấy: S2- nhận proton => base
NH4+ cho proton => acid
Những người đau dạ dày thường có pH lớn hơn 2 trong dịch vị dạ dày. Để chữa dạ dày ta nên dùng?
-
A.
Nước nho và thuốc giảm đau dạ dày có chứa NaHCO3.
-
B.
Nước đun sôi để nguội và thuốc giảm đau dạ dày có chứa NaHCO3.
-
C.
Nước cam và thuốc giảm đau dạ dày có chứa NaHCO3.
-
D.
Vitamin C và thuốc giảm đau dạ dày có chứa NaHCO3.
Đáp án : B
Dựa vào kiến thức về ý nghĩa của pH trong thực tiễn.
Vì pH lớn hơn 2 trong dịch vị dạ dày nên cần bổ sung nước đun sôi để nguội và thuốc giảm đau dạ dày có chứa NaHCO3 có môi trường base => Trung hòa bớt acid.
Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch HCl có pH = 1 là
-
A.
12mL.
-
B.
10mL.
-
C.
100mL.
-
D.
1mL.
Đáp án : C
Dựa vào kiến thức về pH
pH = 1 => (H+) = 0,1 = (HCl)
nNaOH = nHCl = 10-3 mol => VNaOH = 10-3/10-2 = 10-1 (lít) = 100 ml
Đo pH của cốc giấm ăn được giá trị pH = 2,8. Nhận định nào sau đây KHÔNG đúng?
-
A.
Giấm ăn có môi trường acid.
-
B.
Nồng độ ion (H+) của giấm ăn là 10-2,8 ml/L.
-
C.
Nồng độ ion (H+) của giấm ăn là 0,28 mol/L.
-
D.
Nồng độ của ion (OH-) của giấm ăn nhỏ hơn 10-7 mol/L.
Đáp án : C
Dựa vào kiến thức về pH
pH = 2,8 => (H+) = 10-2,8 mok/L => Đáp án C KHÔNG đúng
Luyện tập và củng cố kiến thức Bài 2: Cân bằng trong dung dịch nước Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 1: Khái niệm về cân bằng hóa học Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết










Danh sách bình luận