 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Bài 10. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 10. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết về ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
ý nghĩa của bảng tuần hoàn hóa học....
1. Quan hệ giữa vị trí nguyên tố và cấu tạo của nguyên tố đó
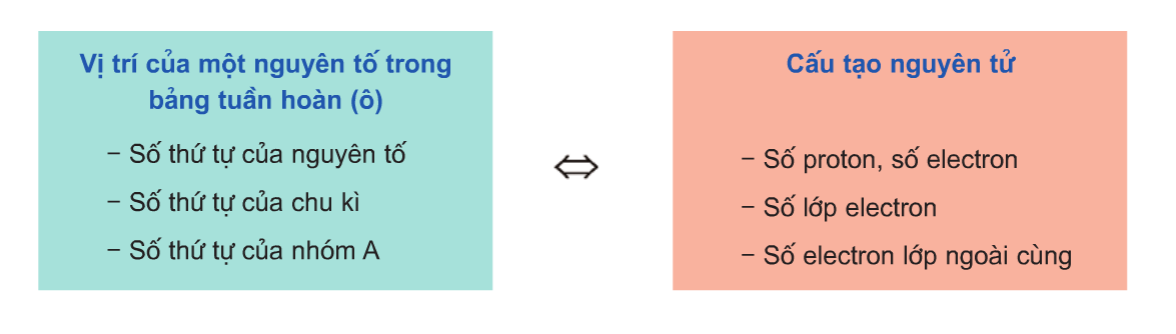
Vị trí nguyên tố cho biết:
- Các nguyên tố thuộc nhóm (IA, IIA, IIIA) trừ B và H có tính kim loại. Các nguyên tố thuộc nhóm VA, VIA, VIIA có tính phi kim (trừ Antimon, bitmut, poloni).
- Hoá trị cao nhất của nguyên tố với oxi, hóa trị với hiđro.
- Công thức của oxit cao nhất và hidroxit tương ứng.
- Công thức của hợp chất khí với H (nếu có)
- Oxit và hidroxit có tính axit hay bazo.
- S ở nhóm VI, CK3, PK
- Hoá trị cao nhất với oxi 6, với hiđro là 2.
- CT oxit cao nhất SO3, h/c với hiđro là H2S.
- SO3 là ôxit axit và H2SO4 là axit mạnh.
3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
a) Trong chu kì theo chiều tăng của điện tích hạt nhân:
- Tính kim loại yếu dần, tính phi kim mạnh dần.
- Tính bazơ, của oxit và hiđroxit yêú dần, tính axit mạnh dần.
b) Trong nhóm A theo chiều tăng của điện tích hạt nhân:
- Tính kim loại mạnh dần, tính phi kim yếu dần.
* Lưu ý: khi xác định vị trí các nguyên tố nhóm B .
- Nguyên tố họ d : (n-1)dansb với a = 1 → 10 ; b = 1 → 2
+ Nếu a + b < 8 ⇒ a + b là số thứ tự của nhóm .
+ Nếu a + b > 10 ⇒ (a + b) – 10 là số thự tự của nhóm.
+ Nếu 8 ≤ a + b ≤ 10 ⇒ nguyên tố thuộc nhóm VIII B
- Nguyên tố họ f : (n-2)fansb với a = 1 → 14 ; b = 1 → 2
+ Nếu n = 6 ⇒ Nguyên tố thuộc họ lantan.
+ Nếu n = 7 ⇒ Nguyên tố thuộc họ acti
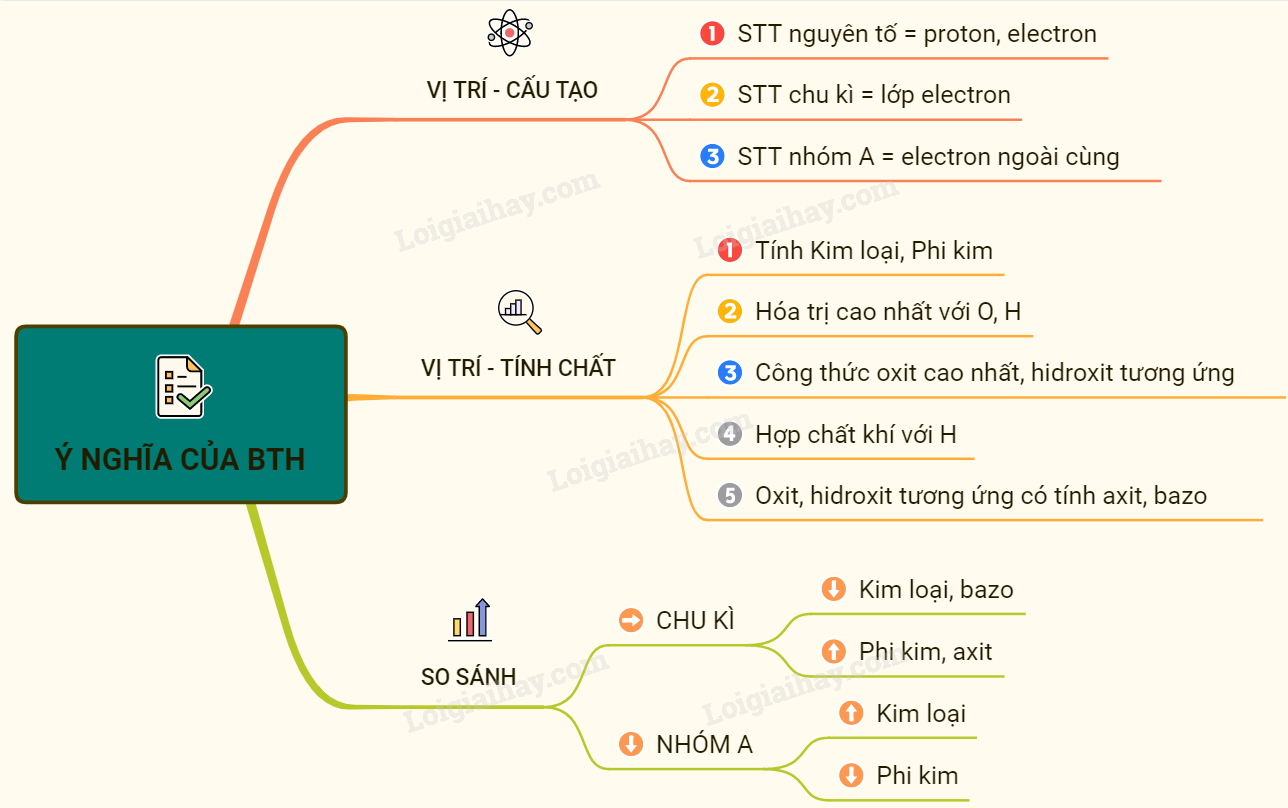
Sơ đồ tư duy: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Các bài khác cùng chuyên mục












Danh sách bình luận