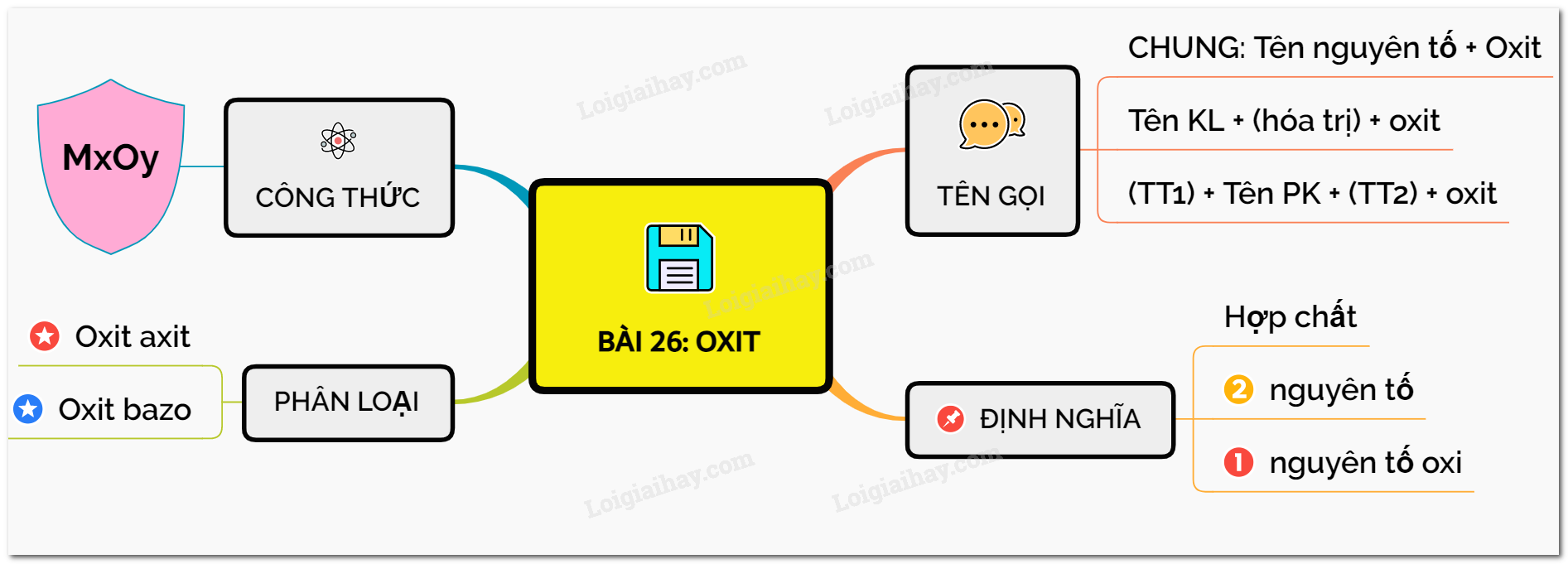
Lý thuyết về oxit
Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
Lý thuyết về oxit
1. Định nghĩa
- Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi
VD: sắt từ oxit Fe3O4, lưu huỳnh đioxit SO2,…
2. Công thức
* Công thức chung: ${{\overset{n}{\mathop{M}}\,}_{x}}{{\overset{II}{\mathop{O}}\,}_{y}}$ với n là hóa trị của M
- Theo quy tắc hóa trị, ta có: n.x = II.y
3. Phân loại:
a. Oxit axit:
- Thường là oxit của phi kim và tương ứng với một axit
- VD: CO2, SO2, SO3, P2O5, N2O5...
+ CO2 tương ứng với axit cacbonic H2CO3
+ SO2 tương ứng với axit sunfurơ H2SO3
+ P2O5 tương ứng với axit photphoric H3PO4
b. Oxit bazo
- Thường là oxit của kim loại và tương ứng với một bazơ
- VD: K2O, CuO, MgO, FeO...
+ K2O tương ứng với bazơ kali hiđroxit KOH.
+ CuO tương ứng với bazơ magie hiđroxit Cu(OH)2.
+ MgO tương ứng với bazơ kẽm hiđroxit Mg(OH)2.
4. Cách gọi tên:
Tên oxit bazơ = Tên kim loại (kèm theo hoá trị nếu kim loại có nhiều hóa trị) + oxit
Ví dụ: FeO : Sắt (II) oxit.
Fe2O3 : Sắt (III) oxit.
CuO : Đồng (II) oxit.
MgO : Magie oxit.
Tên oxit axit = Tiền tố chỉ số nguyên tử phi kim + tên phi kim + tiền tố chỉ số nguyên tử oxi + oxit
Tiền tố: - Mono: nghĩa là 1.
- Đi : nghĩa là 2.
- Tri : nghĩa là 3.
- Tetra : nghĩa là 4.
- Penta : nghĩa là 5.
Ví dụ: SO2 : Lưu huỳnh đioxit.
CO2 : Cacbon đioxit.
N2O3 : Đinitơ trioxit.
N2O5 : Đinitơ pentaoxit.
* Phương pháp giải bài tập xác định công thức oxit:
Bước 1: Gọi công thức của oxit có dạng R2On
Bước 2: Dựa vào khối lượng mol phân tử hoặc phần trăm khối lượng => xác định mối liên hệ giữa R và n
Bước 3: Lập bảng xác định R dựa vào n, cho n từ 1, 2, 3, 4… Nếu đầu bài đã cho biết R hoặc n thì không cần lập bảng.
Bước 4: Chọn giá trị R phù hợp với n và kết luận nguyên tố R
Sơ đồ tư duy: Oxit
Các bài khác cùng chuyên mục













Danh sách bình luận