Lý thuyết phản ứng oxi hóa - khử hóa học 8
Chất khử là chất chiếm oxi của chất khác.
I. SỰ KHỬ VÀ SỰ OXI HÓA
1. Sự khử
- Là sự tách oxi ra khỏi hợp chất
Ví dụ: Phản ứng: CuO + H2 $\xrightarrow{{{t}^{o}}}$ Cu + H2O
Trong PTHH trên, ta thấy H2 đã kết hợp với nguyên tố oxi tạo thành H2O, hay H2 chiếm oxi của CuO
2. Sự oxi hóa
- Sự oxi hóa là sự tác dụng của oxi với một chất.
Ví dụ: 2Zn + O2 $\xrightarrow{{{t}^{o}}}$ 2ZnO
II. CHẤT KHỬ VÀ CHẤT OXI HÓA
- Chất khử là chất chiếm oxi của chất khác.
- Chất oxi hóa là đơn chất oxi hoặc chất nhường oxi cho chất khác.
Ví dụ : trong PTHH: CuO + H2 $\xrightarrow{{{t}^{o}}}$ Cu + H2O
- CuO nhường oxi cho H2 tạo thành Cu => CuO là chất oxi hóa
- H2 chiếm oxi của CuO tạo thành H2O => H2 là chất khử
III. PHẢN ỨNG OXI HÓA – KHỬ
- Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
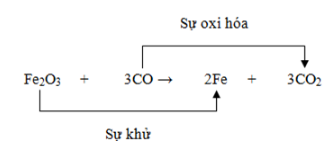
IV. TẦM QUAN TRỌNG CỦA PHẢN ỨNG OXI HÓA – KHỬ
- Sử dụng phản ứng oxi hóa – khử trong công nghiệp luyện kim, công nghiệp hóa học.
- Tuy nhiên, cũng có những phản ứng oxi hóa – khử không có lợi nên cần phải tìm cách hạn chế.
Sơ đồ tư duy: Phản ứng oxi hóa - khử

Các bài khác cùng chuyên mục













Danh sách bình luận