Lý thuyết điều chế khí oxi - phản ứng phân hủy
1. Điều chế oxi
Lý thuyết điều chế oxi – Phản ứng phân hủy.
1. Điều chế oxi
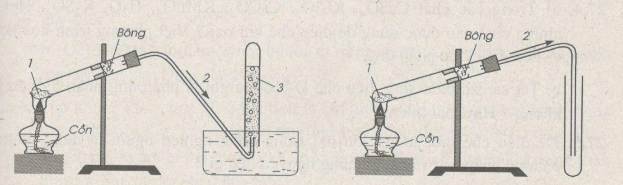
a. Trong phòng thí nghiệm
Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3
2KMnO4 $\xrightarrow{{{t}^{o}}}$ K2MnO4 + MnO2 + O2
2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
2KNO3 $\xrightarrow{{{t}^{o}}}$ 2KNO2 + O2
* Cách thu khí oxi:
- Vì khí oxi ít tan trong nước => thu khí oxi bằng cách đẩy nước
- Khí oxi có ${{d}_{{{O}_{2}}/kk}}\approx 1,1$ => oxi nặng hơn không khí => thu khí oxi bằng cách đẩy không khí
b. Trong công nghiệp
- Bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
Video mô phỏng - Điều chế Oxi bằng phương pháp chưng cất phân đoạn
- Sản xuất từ nước: điện phân nước
2H2O $\xrightarrow{điện\,phân}$ 2H2 ↑ + O2 ↑
2. Phản ứng phân hủy
* Định nghĩa: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới.
Ví dụ:
2KMnO4 $\xrightarrow{{{t}^{o}}}$ K2MnO4 + MnO2 + O2
2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
2H2O $\xrightarrow{điện\,phân}$ 2H2 + O2
CaCO3 $\xrightarrow{{{t}^{o}}}$ CaO + CO2
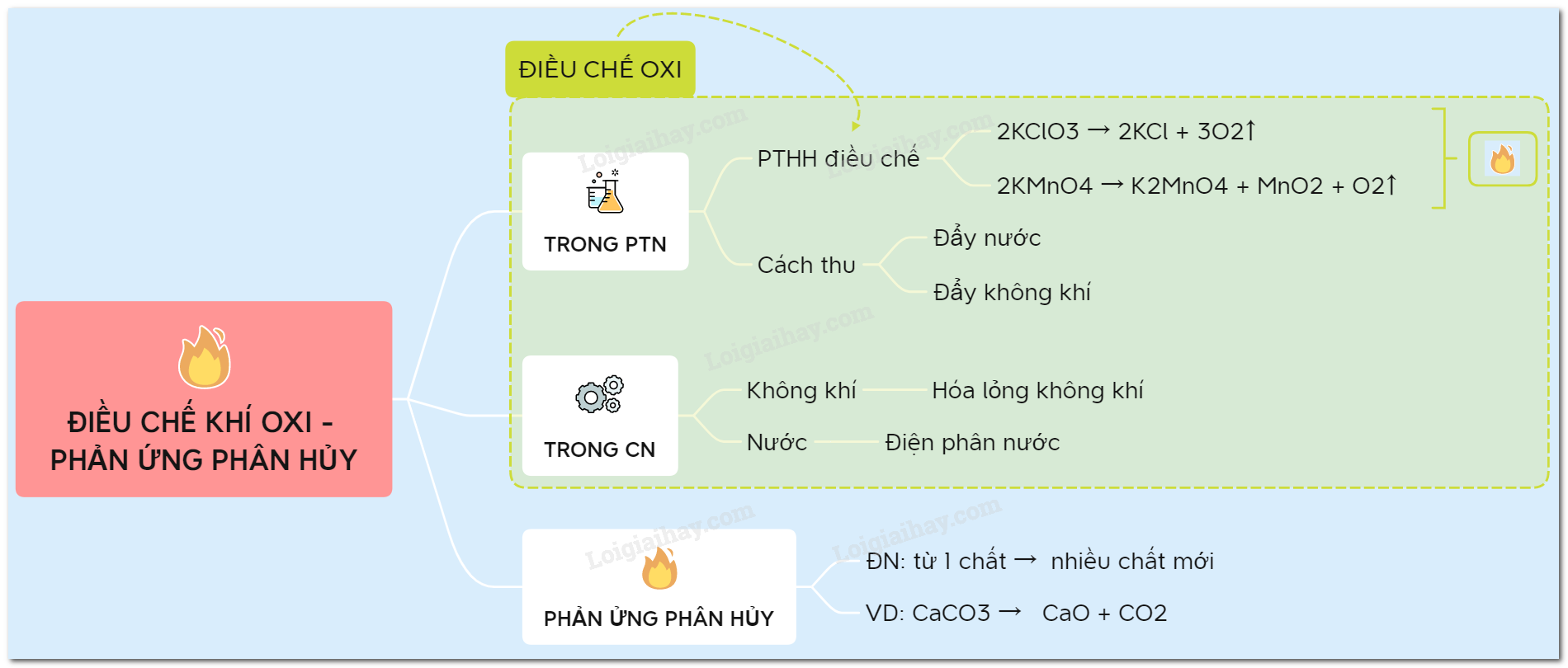
Sơ đồ tư duy: Điều chế khí oxi - phản ứng phân hủy
Các bài khác cùng chuyên mục













Danh sách bình luận