 Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 chân trời sáng tạo
Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 chân trời sáng tạo
 Chủ đề 1. Phản ứng hóa học - KHTN 8 Chân trời sáng tạo
Chủ đề 1. Phản ứng hóa học - KHTN 8 Chân trời sáng tạo Bài 7. Nồng độ dung dịch trang 35, 36, 37 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
Có 2 cốc chứa cùng một thể tích nước muối (dung dịch NaCl), một cốc mặn (đặc) và một cố nhạt (loãng). Đại lượng nào dùng để đánh giá độ đặc, loãng của dung dịch?
Câu hỏi tr 35 CHMĐ
Trả lời câu hỏi mở đầu trang 35 SGK KHTN 8 Chân trời sáng tạo
Có 2 cốc chứa cùng một thể tích nước muối (dung dịch NaCl), một cốc mặn (đặc) và một cố nhạt (loãng). Đại lượng nào dùng để đánh giá độ đặc, loãng của dung dịch?
Phương pháp giải:
Dựa vào kiến thức về nồng độ dung dịch.
Lời giải chi tiết:
Đại lượng nồng độ dùng để đánh giá độ đặc, loãng của dung dịch.
Câu hỏi tr 35 CH 1
Trả lời câu hỏi 1 trang 35 SGK KHTN 8 Chân trời sáng tạo
Hãy xác định chất tan và dung môi trong các dung dịch tạo thành ở Hình 7.1
Phương pháp giải:
Dựa vào Hình 7.1
Lời giải chi tiết:
Chất tan: muối ăn và đường
Dung môi là nước.
Câu hỏi tr 35 CH 2
Trả lời câu hỏi 2 trang 35 SGK KHTN 8 Chân trời sáng tạo
Tại sao lại gọi nước đường, nước muối là các dung dịch.
Phương pháp giải:
Dựa vào khái niệm dung dịch.
Lời giải chi tiết:
Vì nước đường, nước muối là hỗn hợp đồng nhất của chất tan và dung môi.
Câu hỏi tr 35 CH 3
Trả lời câu hỏi 3 trang 35 SGK KHTN 8 Chân trời sáng tạo
Độ tan của một chất phụ thuộc vào những yếu tố nào?
Phương pháp giải:
Dựa vào khái niệm độ tan.
Lời giải chi tiết:
Độ tan của chất phụ thuộc vào nhiệt độ.
Câu hỏi tr 36 CH 1
Trả lời câu hỏi 1 trang 36 SGK KHTN 8 Chân trời sáng tạo
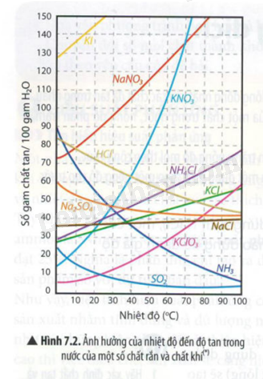
Quan sát đồ thị Hình 7.2, hãy nhận xét độ tan của một số chất rắn và chất khí thay đổi như thế nào khi tăng nhiệt độ.
Phương pháp giải:
Dựa vào Hình 7.2
Lời giải chi tiết:
Độ tan của chất rắn hầu như tăng khi tăng nhiệt độ.
Chất khí giảm khi tăng nhiệt độ.
Câu hỏi tr 36 LT
Trả lời câu hỏi luyện tập trang 36 SGK KHTN 8 Chân trời sáng tạo
Tính độ tan của muối Na2CO3 trong nước ở 25oC. Biết rằng ở nhiệt độ này khi hòa tan hết 76,75 gam Na2CO3 trong 250 gam nước thì được dung dịch bão hòa.
Phương pháp giải:
Dựa vào công thức tính độ tan.
Lời giải chi tiết:
S = \(\frac{{{m_{ct}}}}{{{m_{{\rm{d}}m}}}}.100 = \frac{{76,75}}{{250}}.100 = 30,7gam/100{g_{{H_2}{\rm{O}}}}\)
Câu hỏi tr 36 VD
Trả lời câu hỏi vận dụng trang 36 SGK KHTN 8 Chân trời sáng tạo
Hãy giải thích tại sao:
a) Khi pha nước chanh đá, người ta thường hòa tan đường hoặc muối ăn vào nước nóng, sau đó mới cho đá lạnh vào.
b) Trong sản xuất nước ngọt có gas, người ta thường nén khí (carbon dixode) ở áp suất cao.
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng đến độ tan.
Lời giải chi tiết:
a) Vì nước nóng làm độ tan của đường hoặc muối nhanh hơn, tan nhiều hơn.
b) Khi nén khí ở áp suất cao, độ tan của khí tăng lên.
Câu hỏi tr 36 CH 2
Trả lời câu hỏi 2 trang 36 SGK KHTN 8 Chân trời sáng tạo
Quan sát Hình 7.3, hãy cho biết vì sao 3 dung dịch của cùng một chất nhưng màu sắc của chúng lại khác nhau.
Phương pháp giải:
Dựa vào Hình 7.3
Lời giải chi tiết:
Vì chất tan trong các cốc dung dịch khác nhau.
Câu hỏi tr 36 CH 3
Trả lời câu hỏi 3 trang 36 SGK KHTN 8 Chân trời sáng tạo
Để tính nồng độ phần trăm của dung dịch ta cần biết những thông tin gì?
Phương pháp giải:
Dựa vào công thức tính nồng độ phần trăm của dung dịch.
Lời giải chi tiết:
Để tính nồng độ phần trăm cần biết khối lượng chất tan và khối lượng dung dịch.
Câu hỏi tr 37 LT 1
Trả lời câu hỏi luyện tập 1 trang 37 SGK KHTN 8 Chân trời sáng tạo
Hòa tan 21 gam KNO3 vào 129 gam nước thu được dung dịch KNO3. Tính nồng độ phần trăm của dung dịch KNO3 thu được.
Phương pháp giải:
Dựa vào công thức tính nồng độ phần trăm của dung dịch.
Lời giải chi tiết:
m dung dịch = m chất tan + m dung môi = 21 + 129 = 150g.
C% = \(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{21}}{{150}}.100\% = 14\% \)
Câu hỏi tr 37 CH
Trả lời câu hỏi trang 37 SGK KHTN 8 Chân trời sáng tạo
Làm thế nào để xác định được nồng độ mol của dung dịch?
Phương pháp giải:
Dựa vào công thức tính nồng độ mol của dung dịch.
Lời giải chi tiết:
Để xác định nồng độ mol của dung dịch cần biết số mol chất tan và thể tích dung dịch.
Câu hỏi tr 37 LT 2
Trả lời câu hỏi luyện tập 2 trang 37 SGK KHTN 8 Chân trời sáng tạo
Hòa tan 16 gam CuSO4 khan vào nước thu được 200 ml dung dịch CuSO4. Tính nồng độ mol của dung dịch CuSO4.
Phương pháp giải:
Dựa vào công thức tính nồng độ mol của dung dịch.
Lời giải chi tiết:
n CuSO4 = 16:160 = 0,1 mol
CM = \(\frac{{0,1}}{{0,2}} = 0,5M\)
Câu hỏi tr 38 LT
Trả lời câu hỏi luyện tập trang 38 SGK KHTN 8 Chân trời sáng tạo
Từ muối ăn NaCl, nước cất và các dụng cụ cần thiết. Hãy tính toán và nêu cách pha chế 100ml dung dịch NaCl có nồng độ 1M.
Phương pháp giải:
Dựa vào cách pha chế dung dịch.
Lời giải chi tiết:
n NaCl = CM.V = 0,1.1 = 0,1 mol
m NaCl = 0,1.58,5 = 5,85g
- Cân lấy 5,85gam NaCl khan cho vào cốc có dung tích 100ml.
- Đong lấy 100ml nước cất
- Rót nước vào cốc khuấy nhẹ, ta thu được 100ml dung dịch NaCl có nồng độ 1M.
Câu hỏi tr 38 VD
Trả lời câu hỏi vận dụng trang 38 SGK KHTN 8 Chân trời sáng tạo
Gia đình bác nông dân muốn thực hiện dự án nuôi cá trong một hồ nước ợ. Để có được một hồ chứa nước lợ (dung dịch 1% muối ăn) thì bác nông dân đã cho vào hồ rỗng 1000kg nước biển (nước mặn chứa muối ăn với nồng độ dung dịch 3,5%). Bác nông dân phải đổ thêm vào hồ một khối lượng nước ngọt (có khối lượng muối ăn không đáng kể) là bao nhiêu để được một hồ chứa nước lợ có nồng độ 1% muối ăn?
Phương pháp giải:
Dựa vào công thức tính nồng độ dung dịch.
Lời giải chi tiết:
Khối lượng muối có trong 1000kg nước biển là: 1000.3,5% = 35kg
Gọi x (kg) là khối lượng nước ngọt mà bác nông dân phải thêm vào hồ
Khối lượng nước trong hồ: 1000 + x (kg)
Ta có nồng độ dung dich 1% muối ăn trong hồ chứa: C% = \(\frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100 = \frac{{35}}{{1000 + x}}.100 \to x = 2500kg\)
- Bài 8. Tốc độ phản ứng và chất xúc tác trang 39, 40, 41 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Ôn tập chủ đề 1 trang 43, 44, 45 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 6. Tính theo phương trình hóa học trang 32, 33, 34 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 5. Mol và tỉ khối của chất khí trang 27, 28, 29 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 4. Định luật bảo toàn khối lượng và phương trình hóa học trang 23, 24, 25 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
>> Xem thêm
Các bài khác cùng chuyên mục
- Ôn tập chủ đề 5 trang 133 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 28. Sự nở vì nhiệt trang 128, 129, 130 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 27. Sự truyền nhiệt trang 123, 124, 125 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 26. Năng lượng nhiệt và nội năng trang 120, 121, 122 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Ôn tập chủ đề 4 trang 119 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Ôn tập chủ đề 5 trang 133 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 28. Sự nở vì nhiệt trang 128, 129, 130 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 27. Sự truyền nhiệt trang 123, 124, 125 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Bài 26. Năng lượng nhiệt và nội năng trang 120, 121, 122 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- Ôn tập chủ đề 4 trang 119 SGK Khoa học tự nhiên 8 - Chân trời sáng tạo














Danh sách bình luận