 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Đề số 1 - Hóa học 10
Đáp án và lời giải chi tiết Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Đề số 1 - Hóa học 10
Đề bài
Câu 1. Nhận xét nào dưới đây là không đúng. “Trong nhóm halogen, đi từ flo đến iot ta thấy được”.
A.trạng thái tập hợp: từ thể khí chuyển sang thể lỏng và rắn.
B.màu sắc: đậm dần.
C.nhiệt độ nóng chảy và nhiệt độ sôi: giảm dần.
D.độ âm điện: giảm dần.
Câu 2. Khí hidro clorua là chất khí tan rất nhiều trong nước tạo thành dung dịch axit clohiđric. Trong thí nghiệm thử tính tan của khí hiđrô clorua trong nước, có hiện tượng nước phun mạnh vào bình như hình vẽ mô tả dưới đây. Nguyên nhân dưới đây gây ra hiện tượng đó là
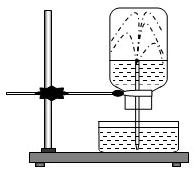
A. do khí hiđro clorua tác dụng với nước hút nước vào bình.
B. do khí hiđro clorua tan mạnh làm giảm áp suất trong bình.
C do trong bình chứa khí hiđro clorua ban đầu không có nước.
D. tất cả các nguyên nhân trên đều đúng.
Câu 3. Chỉ ra đâu không phải là đặc điểm chung của tất cả các halogen?
A. Nguyên tử halogen dễ thu thêm 1 electron.
B. Các nguyên tố halogen đều có khả năng thể hiện các số oxi hóa -1, +1, +3, +5, +7.
C. Halogen là những phi kim điển hình.
D. Liên kết trong phân tử halogen X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử halogen X.
Câu 4. Các nhà máy xử lý nước cấp luôn mong muốn cung cấp một nguồn nước an toàn và không chứa vi trùng, vi khuẩn gây bệnh. Thêm clo là một trong những phương pháp hiệu quả nhất để khử trùng nguồn nước cấp và đảm bảo chúng không xuất hiện trong quá trình phân phối nước qua đường ống tới người tiêu dùng. Clo được chọn làm chất xử lí nước cấp là do
A.clo tác dụng với nước tạo ra HClO, chất này có tính oxi hóa rất mạnh.
B.clo có tính oxi hóa rất mạnh.
C.clo độc nên có tính sát trùng.
D.Cả B và C.
Câu 5. Hòa tan 28,4g một hỗn hợp 2 muối cacbonat của hai kim kim loại hóa trị II bằng dung dịch HCl dư, thu được 10 lít khi ở \(54,6^\circ C\) và 0,8064 atm và một dung dịch X. Cô cạn dung dịch X thu được m gam muối. Giá trị của m là.
A.30,7 gam. B.31,7 gam.
C.60 gam. D.62,4 gam.
Câu 6. Phản ứng dùng để điều chế clo trong phòng thí nghiệm là
\(\eqalign{ & A.6HCl + KCl{O_3} \to KCl + 3C{l_2} + 3{H_2}O. \cr & B.NaCl\buildrel {dp{\rm{dd}}} \over \longrightarrow Na + {1 \over 2}C{l_2} \uparrow . \cr & C.4HCl + Mn{O_2}\buildrel {t^\circ } \over \longrightarrow C{l_2} \uparrow + MnC{l_2} + 2{H_2}O. \cr & D.2NaCl + 2{H_2}O\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{cmn}^{dp{\rm{dd}}}} C{l_2} \uparrow + {H_2} + 2NaOH. \cr} \)
Câu 7. Trong dãy axit HCl, HI, HF, HBr axit mạnh nhất là
A.HI. B.HCl.
C.HBr. D.HF.
Câu 8. Cho 15,8g KMnO4 tác dụng hoàn toàn với dung dịch HCl đặc, dư thu được V lít khí (đktc). Giá trị của V là
A.5,6 lít. B.4,48 lít.
C.3,36 lít. D. 6,72 lít.
Câu 9. Chỉ dùng duy nhất một loại thuốc thử là AgNO3 có thể nhận ra tối đa bao nhiêu chất trong các dung dịch sau: NaF, NaCl, NaBr, NaI?
A.1 B.2.
C.3. D.4.
Câu 10. Sherlock Homes là một nhà thám tử tư ở Luân Đôn nổi tiếng nhờ sự thông minh, khả năng suy diễn loogic và quan sát tinh tường trong khi phá những vụ án mà cảnh sát phải bó tay. Ông đã phát hiện ra cách lấy dâu vân tay của tội phạm lưu trên đồ vật ở hiện trường chỉ sau ít phút thí nghiệm. Bằng cách đem đồ vật có vân tay đặt đối diện với miệng ống nghiệm chứa chất X, dùng đèn cồn đun nóng ở phần đáy ống nghiệm đến khi xuất hiện luồng khí màu tím bốc ra, dấu vân tay sẽ hiện ra một cách hết sức rõ ràng đến từng đường nét. X là chất nào trong số các chất sau?
A.Clo. B.Flo.
D.Brom. D.Iot.
Câu 11. Sục 0,2016 lít khí clo (đktc) vào 150ml dung dịch NaI 2M ( dung dịch X ). Sau đó, đun sôi đuổi hết iot, thêm nước vào dung dịch cho đủ 200 ml ( dung dịch Y). Nồng độ ml mỗi muối trong dung dịch Y là
A.NaCl 0,09 M.
B.NaCl 0,09 M; NaI 1,41 M.
C.NaI 0,09 M; NaCl 1,41 M.
D.NaCl 0,5M.
Câu 12. Cho 200 ml dung dịch A chứa hỗn hợp 2 axit HCl 0,4 M và HNO3 0,6M. Để làm kết tủa hết ion Cl- trong A cần cho vào bao nhiêu ml dung dịch AgNO3 0,5M?
A.200ml. B.300 ml.
C. 160 ml. D.100 ml.
Câu 13. Cho hỗn hợp muối ăn có lẫn MgCl2 và NaBr. Để tinh chế NaCl, các bước tiến hành có thể là
A. Hòa tan hỗn hợp vào dung dịch Na2CO3. Cho clo vào dung dịch còn lại. Cô cạn dung dịch.
B. Cho NaOH vào dung dịch có hoonc hợp 2 chất. Cho clo vào dung dịch còn lại. Cô cạn dung dịch.
C. Cho clo vào dung dịch có hỗn hợp 2 chất. Cô cạn dung dịch. Hòa tan chất kết tinh vào dung dịch Na2CO3. Cô cạn dung dịch.
D. Tất cả các đáp án trên đều đúng.
Câu 14. Người ta có thể dùng nhóm hóa chất nào sau đây để khắc chữ khắc hình trên thủy tinh?
A.NaFrắn, H2SO4 đặc.
B.NaCl rắn, H2SO4 đặc.
C.NaBr đặc, H2SO4 đặc.
D.NaBr rắn, H2SO4 đặc.
Câu 15. Cho các phương trình sau đây:
Cl2 + X → Y
Z + Cl2 → T
Y + Fe → Z + H2
T + NaOH → Fe(OH)3 + NaCl
|
Đáp án |
X |
Y |
Z |
T |
|
A. |
H2 |
HCl |
FeCl2 |
Cl2 |
|
B. |
H2O |
HClO |
FeCl2 |
FeCl3 |
|
C. |
H2 |
HCl |
FeCl2 |
FeCl3 |
|
D. |
Tất cả đều sai |
|||
Câu 16. Trong đời sống hằng ngày chúng ta thường dùng các chất tẩy trắng như Javen, clorua vôi. Thực tế, chất nào được dùng phổ biến hơn? Vì sao?
A.Nước Javen vì nước Javen dễ tạo chất hơn.
B.Clorua vôi vì clorua vôi có hàm lượng hippoclorit cao.
C.Nước Javen, vì nước Javen có hàm lượng hippoclorit cao, rẻ hơn và dễ bảo quản, vận chuyển hơn.
D.Clorua vôi vì clorua vôi dễ chế tạo hơn.
Câu 17. Trong cỡ thể con người tồn tại một lượng iot tập trung ở tuyến giáp trạng. Ở người trưởng thành lượng iot này khoảng 20 – 50mg. Hàng ngày ta phải bổ sung iot cần thiết cho cơ thể bằng cách ăn muối iot. Nếu lượng iot không cung cấp đủ thì sẽ dẫn đến tuyến giáp trạng sưng to thành bướu cổ, nặng hơn là đần độn, vô sinh và các chứng bệnh khác. Thành phần chính của muối iot là
A.KI và KIO3. B.I2 và KIO3.
C.KI và I2. D.KIO và I3.
Câu 18. Cho m gam KMnO4 tác dụng dung dịch HCl để điều chế đủ khí clo tác với sắt, tạo nên 16.25 gam sắt FeCl3. Giá trị của m là
A.94,8 gam. B.9,48 gam.
C.948 gam. D.0,948 gam.
Câu 19. Nguyên tố halogen có thể đẩy O2 ra khỏi nước là
A. I2. B.Cl2.
D.Br2. D.F2.
Câu 20. Hoàn thành phương trình phản ứng hóa học sau:
\(S{O_2} + B{r_2} + {H_2}O \to {H_2}S{O_4} + ...\) Trong dấu ba chấm là
A.HBrO. B.HBrO3.
C.HBrO4. D.HBr.
Câu 21. Cho hình vẽ mô tả sự điều chế Clo trong phòng thí nghiệm như sau:
Phát biểu nào sau đây không đúng?
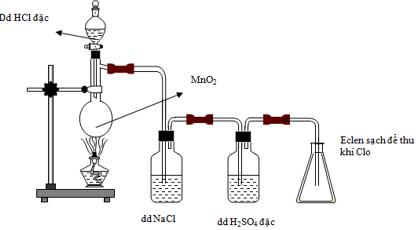
A.Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO.
B.Khí clo thu được trong bình erlen là khí clo khô.
C.Có thể thay MnO2 bằng KMnO4 hoặc KClO3.
D.Không thể thay dung dịch NaCl bằng dung dịch HCl.
Câu 22. Nguyên liệu dùng điều chế nước Javen, clorua vôi, KClO3 có đặc điểm chung là
A.khí clo và axit.
B.khí clo và hiđroxit.
C.khí clo và kim loại.
D. khí clo và muối.
Câu 23. CFC là nguyên nhân chính của
A. hiện tượng mưa axit.
B. sự suy giảm tầng ozon.
C.sự ô nhiễm nguồn nước ngầm.
D.hiện tượng động đất.
Câu 24. Cho hỗn hợp A gồm KBr và KI, hòa tan hoàn toàn A vào nước rồi cho dung dịch brom dư vào dung dịch trên. Đun sôi, cô cạn dung dịch sau phản ứng thì thấy khối lượng sản phẩm B nhỏ hơn khối lượng của A là m gam. Hòa tan sản phẩm B vào nước rồi cho Clo lội qua cho đến dư. Sau phản ứng, cô cạn dung dịch thì thấy khối lượng sản phẩm C nhỏ hơn khối lượng sản phẩm B là m gam. Thành phần % về khối lượng KBr trong hỗn hợp A là
A. 38,7%. B. 56,8%.
D. 3,87%. D. 4,9%.
Câu 25. Phát biểu nào sau đây đúng khi nói về tính chất hóa học của clo trong phương trình phản ứng với nước?
A.Clo thể hiện tính oxi hóa.
B.Clo thể hiện tính khử.
C.Clo vừa thể hiện tính oxi hóa, vừa thể hiện tính oxi hóa.
D.Cả A, B,C đều sai.
Câu 26. Dãy axit nào sau đây được xếp theo thứ tự tính axit tăng dần?
A.HF, HCl, HBr, HI.
B.HI, HBr, HCl, HF.
C.HCl, HF, HI, HBr.
D.HCl, HBr, HI, HF.
Câu 27. Cho lượng dư dung dịch AgNO3 tác dụng với 100ml dung dịch hỗn hợp NaF 0,05M, NaCl 0,1M. Khối lượng kết tủa tạo thành là bao nhiêu?
A.1435 gam. B.1,435 gam.
C.14,35 gam. D.143,5 gam.
Câu 28. Trong phương trình phản ứng sau đây
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} + {H_2}O\)
Hệ số tối giản của các chất trong phương trình hóa học lần lượt là
A. 2, 12, 2, 3, 5, 8.
B. 2, 16, 2, 2, 5, 8.
C. 2, 14, 2, 2, 5, 8.
D. 2, 2, 16, 10, 10.
Câu 29. Những tính chất sau, tính chất nào không phải tính chất của khí hiđroclorua?
A. Tan nhiều trong nước.
B. Tác dụng với khí NH3.
C. Tác dụng với CaCO3 giải phóng khí CO2.
D. Làm đổi màu giấy quỳ tím ẩm.
Câu 30. Trong các dãy sau đây dãy nào tác dụng với dung dịch HCl?
A. AgNO3, MgCO3, BaSO4, MnO2.
B. Fe, CuO, Ba(OH)2, MnO2.
C.Fe2O3, MnO2, Cu, Al.
D. CaCO3, H2SO4, Mg(OH)2, MnO2.
Lời giải chi tiết
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
C |
B |
B |
A |
B |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
A |
A |
A |
D |
D |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
B |
C |
D |
A |
C |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
C |
A |
B |
D |
D |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
D |
B |
B |
C |
C |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
A |
B |
A |
C |
B |
Câu 1
A.trạng thái tập hợp: từ thể khí chuyển sang thể lỏng và rắn. (đúng)
B.màu sắc: đậm dần. (đúng)
C.nhiệt độ nóng chảy và nhiệt độ sôi: giảm dần. (sai, phải là tăng dần)
D.độ âm điện: giảm dần. (đúng)
Đáp án C
Câu 2
Nguyên nhân gây ra hiện tượng đó là do khí hiđro clorua tan mạnh làm giảm áp suất trong bình.
Đáp án B
Câu 3
A. Nguyên tử halogen dễ thu thêm 1 electron. (đúng)
B. Các nguyên tố halogen đều có khả năng thể hiện các số oxi hóa -1, +1, +3, +5, +7. (sai do F chỉ có số OXH -1 trong hợp chất)
C. Halogen là những phi kim điển hình. (đúng)
D. Liên kết trong phân tử halogen X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử halogen X. (đúng)
Đáp án B
Câu 4:
Clo tác dụng với nước:
\(C{l_2} + {H_2}O \to HCl + HClO\)
Axit hipoclorơ HClO sinh ra có tính oxi hóa rất mạnh nên có tác dụng khử trùng, sát khuẩn nước.
Đáp án A.
Câu 5:
Gọi M là kí hiệu nguyên tử A, M’ là kí hiệu nguyên tử B
\(\eqalign{ & MC{O_3} + 2HCl\buildrel {t^\circ } \over \longrightarrow MC{l_2} + {H_2}O + C{O_2} \cr & x{\rm{ }} \to \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ x }} \to \;\;\;\;\;{\rm{ x }} \to\;\;\;\;\; {\rm{ x}} \cr & {\rm{M'C}}{{\rm{O}}_3} + 2HCl\buildrel {t^\circ } \over \longrightarrow M'C{l_2} + {H_2}O + C{O_2} \cr & y{\rm{ }} \to \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{ y }} \to\;\;\;\;\;\;\; {\rm{ y }}\; \to \;\;{\rm{ y}} \cr & {{\rm{n}}_{C{O_2}}} = x + y = {{0,8064.10} \over {0,082.\left( {273 + 54,6} \right)}} \cr&\;\;\;\;\;\;\;\;= 0,3\left( {mol} \right) \cr} \)
Áp dụng định luật bảo toàn khối lượng ta có:
\(28,4 + 0,3,2,36,5 = m + 0,3.44 + 0,3.18\)
\(\Rightarrow m = 31,7\left( {gam} \right)\)
Đáp án B.
Câu 6
Để điều chế clo trog PTN chúng ta cho chất có tính OXH mạnh tác dụng với HCl (đặc)
Đáp án A
Câu 7
Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H trong phân tử axit
H linh động càng mạnh, tính axit càng mạnh
Từ F đến I bán kinh nguyên tử tăng, độ dài liên kết HX tăng => HI có tính axit mạnh nhất.
Đáp án A
Câu 8:
\(\eqalign{ & {n_{KMn{O_4}}} = {{15,8} \over {158}} = 0,1\left( {mol} \right) \cr & {\rm{ 2KMn}}{{\rm{O}}_4} + 16HCl \to 2KCl + 2MnC{l_2} + 8{H_2}O + 5C{l_2} \cr & {n_{C{l_2}}} = {{0,1.5} \over 2} = 0,25\left( {mol} \right);\cr&{V_{C{l_2}}} = 0,25.22,4 = 5,6\left( l \right) \cr} \)
Đáp án A.
Câu 9
Ta có thể nhận ra cả 4 dung dịch
AgF tan, AgCl kết tủa trắng, AgBr kết tủa vàng nhạt, AgI kết tủa vàng đậm.
Đáp án D
Câu 10.
Khi đem đồ vật có vân tay đặt đối diện với miệng ống nghiệm chứa cồn iot thì do bị đun nóng iot “thăng hóa” bốc lên thành khí màu tím (chú ý khí iot rất độc), mà dầu béo, dầu khoáng và mồ hôi là các dung môi hữu cơ mà khí iot dễ tan vào chúng, tạo thành màu nâu trên các vân tay lưu lại. Thế là vân tay hiện ra.
Đáp án D.
Câu 11:
\({n_{C{l_2}}} = \dfrac{0,2016} {22,4} = 0,009\left( {mol} \right)\) ;
nNaI ban đầu = 0,15.2=0,3 (mol)
Phương trình hóa học
\(\eqalign{ & C{l_2}{\rm{ }} + {\rm{ }}2NaI \to 2NaCl + {I_2} \cr & 0,009 \to 0,018 \to 0,018\left( {mol} \right) \cr} \)
Dung dịch Y gồm: NaI dư và NaCl
\( \to \) nNaI dư = 0,3-0,018= 0,282 mol
\( \to \) CM(NaI) = 1,41M; CM(NaI) = 0,09M
Đáp án B.
Câu 12:
\(\eqalign{ & {n_{{H^ + }}} = 0,2.\left( {0,4 + 0,6} \right) = 0,2\left( {mol} \right); \cr & {n_{C{L^ - }}} = 0,08\left( {mol} \right);\cr&{n_{N{O_3}^ - }} = 0,12\left( {mol} \right) \cr} \)
Phương trình hóa học: \(A{g^ + } + C{l^ - } \to AgCl \downarrow \)
\(\eqalign{ & {n_{AgN{O_3}}} = {n_{C{l^ - }}} = 0,08mol \cr & \Rightarrow {V_{{\rm{dd}}AgN{O_3}}} = {{0,08} \over {0,5}} = 0,16\left( {lit} \right) = 160\left( {ml} \right) \cr} \)
Đáp án C.
Câu 13
Để tinh chế NaCl ta có thể sử dụng được tất cả các phương án trên.
Đáp án D
Câu 14
Do SiO2 (chất chiếm thành phần chính trong thủy tinh) có bị hòa tan bởi axit HF nên người ta dùng nhóm hóa chất NaFrắn, H2SO4 đặc để tạo ra HF nhằm hòa tan được thủy tinh => Khắc được chữ
Đáp án A
Câu 15
Ta có phương trình hóa học:
Cl2 + H2 → 2HCl
HCl + Fe → FeCl2 + H2
2FeCl2 + Cl2 → 2FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Đáp án C
Câu 16
Nước Javen, vì nước Javen có hàm lượng hippoclorit cao, rẻ hơn và dễ bảo quản, vận chuyển hơn.
Đáp án C
Câu 17
Thành phần chính của muối iot là KI và KIO3
Đáp án A
Câu 18:
\(\eqalign{ & {n_{FeC{l_3}}} = 0,1mol \cr & {\rm{ 2KMn}}{{\rm{O}}_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} + 8{H_2}O\left( 1 \right) \cr & {\rm{ 2Fe + 3C}}{{\rm{l}}_2}\buildrel {t^\circ } \over \longrightarrow 2FeC{l_3}\left( 2 \right) \cr & {\rm{ 0,15 }} \leftarrow {\rm{ 0,1}} \cr} \)
Theo phương trình (1) ta có:
\(\eqalign{ & {n_{KMn{O_4}}} = {2 \over 5}.{n_{C{l_2}}} = 0,06\left( {mol} \right) \cr & \to {m_{KMn{O_4}}} = 0,06.158 = 9,48g \cr} \)
Đáp án B.
Câu 19
F2 + H2O → 2HF + ½ O2
Đáp án D
Câu 20
SO2 + Br2 + H2O → H2SO4 + 2HBr
Đáp án D
Câu 21
A.Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO. (sai vì CaO có khả năng tác dụng được với khí Cl2)
B.Khí clo thu được trong bình erlen là khí clo khô. (đúng)
C.Có thể thay MnO2 bằng KMnO4 hoặc KClO3. (đúng)
D.Không thể thay dung dịch NaCl bằng dung dịch HCl. (đúng).
Đáp án A
Câu 22
Nguyên liệu dùng điều chế nước Javen, clorua vôi, KClO3 có đặc điểm chung là khí clo và hiđroxit.
Đáp án B
Câu 23
CFC là nguyên nhân chính của sự suy giảm tầng ozon.
Đáp án B
Câu 24:
Gọi x, y lần lượt là số mol của Ki và KBr trong hỗn hợp A.
Khi cho dung dịch brom vào dung dịch A, các phương trình hóa học xảy ra là:
\(\eqalign{ & {\rm{ 2KI + B}}{{\rm{r}}_2} \to 2KBr + {I_2} \cr & {\rm{ x}} \to {\rm{0,5x}} \to {\rm{x }} \to \;\;\;{\rm{0,5x}}\left( {mol} \right) \cr & {m_A} = 166x + 119y\left( 1 \right) \cr & {m_B} = \left( {x + y} \right).119\left( 2 \right) \cr} \)
Khi cho dung dịch clo vào dung dịch B, phương trình hóa học:
\(\eqalign{ & {\rm{ 2KBr + C}}{{\rm{l}}_2} \to 2KCl + B{r_2} \cr & {\rm{ x + y }} \;\;\;\to \;\;\;\;\;\;{\rm{ x + y }}\left( {mol} \right) \cr & {m_C} = \left( {x - y} \right).74,5\left( 3 \right) \cr} \)
Từ (1), (2), (3) :
\(\eqalign{ & 116x - 119y + 74,5y + 74,5x = 2.119\left( {x - y} \right)\cr& \Leftrightarrow x = 17,8y \cr & \to \% {m_{KBr}} = {{119y.100\% } \over {166x + 119y}} = 3,87\% \cr} \)
Đáp án C.
Câu 25
Cl2 + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)HCl + HClO
Đáp án C
Câu 26
Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H trong phân tử axit
H linh động càng mạnh, tính axit càng mạnh
Từ F đến I bán kinh nguyên tử tăng, độ dài liên kết HX tăng => HI có tính axit mạnh nhất.
Đáp án A
Câu 27
Kết tủa tạo thành chính là AgCl
nNaCl = nAgCl = 0,01 (mol)
=> mAgCl = 0,01 * 143,5 = 1,435 (gam)
Đáp án B
Câu 29
Khí HCl không tác dụng với CaCO3 (phải là dung dịch HCl)
Đáp án C
Câu 30
A. AgNO3, MgCO3, BaSO4, MnO2. (loại vì có BaSO4 không tan trong HCl)
B. Fe, CuO, Ba(OH)2, MnO2. (đúng)
C.Fe2O3, MnO2, Cu, Al. (loại vì Cu không tan trong HCl)
D. CaCO3, H2SO4, Mg(OH)2, MnO2. (loại vì H2SO4 không phản ứng với HCl)
Đáp án B
Loigiaihay.com
Các bài khác cùng chuyên mục











