 Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
Giải bài tập hóa học 10, Hóa 10 - Để học tốt hóa học 10
 Đề kiểm tra 45 phút (1 tiết) - Chương 7 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 7 - Hóa học 10
Đề kiểm tra 45 phút (1 tiết) - Chương 7 - Đề số 1 - Hóa học 10
Đáp án và lời giải chi tiết Đề kiểm tra 45 phút (1 tiết) - Chương 7 - Đề số 1 - Hóa học 10
Đề bài
Câu 1. Thực hiện hai thí nghiệm được mô tả như hình vẽ:
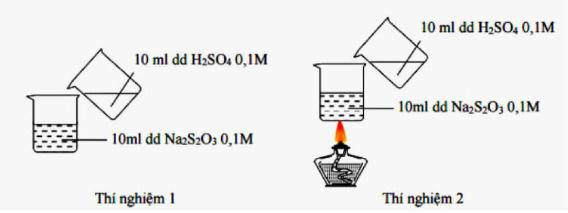
Nhận xét đúng về hiện tượng thí nghiệm xảy ra là?
A.Kết tủa xuất hiện đồng thời.
B.Thí nghiệm 2 xuất hiện kết tủa trước.
C.Thí nghiệm 1 xuất hiện kết tủa trước.
D.Không có kết tủa xuất hiện.
Câu 2. Tốc độ phản ứng là
A.độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C.độ biến thiên nồng đọ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D.độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 3. Trong các trường hợp dưới đây, nếu lượng Fe trong các thí nghiệm đều được lấy bằng nhau thì trường hợp nào tốc độ phản ứng lớn nhất?
A.Fe tác dụng với dung dịch HCl 0,1M.
B.Fe tác dụng với dung dịch HCl 0,2M.
C.Fe tác dụng với dung dịch HCl 0,3M.
D.Fe tác dụng với dung dịch HCl 20% (d=1,2 g/ml).
Câu 4. Dùng không khí nén thổi vào lò cao để đốt cháy than cốc ( trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
A.nhiệt độ, áp suất.
B.tăng điện tích.
C.nồng độ.
D.chất xúc tác.
Câu 5. Trong công nghiệp người ta điều chế NH3 theo phương trình hóa học. \({N_2}\left( k \right) + 3{H_2}\left(k\right)\mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\left( k \right).\) Khi tăng nồng độ H2 lên hai lần (giữ nguyên nồng độ của N2 và nhiệt độ phản ứng) thì tốc độ phản ứng thay đổi thế nào?
A.Tăng lên.
B.Giảm đi.
C.Không thay đổi.
D.Tăng rồi giảm.
Câu 6. Cho phản ứng hóa học:
\(A\left( k \right) + 2B\left( k \right) + \) nhiệt \( \to A{B_2}\left( k \right).\)
Tốc độ phản ứng sẽ tăng khi
A. tăng áp suất.
B. tăng thể tích của bình phản ứng.
C. giảm áp suất.
D. giảm nồng độ của A.
Câu 7. Cho cân bằng hóa học sau:
\({N_2}\left( k \right) + 3{H_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\left( k \right),\Delta H < 0.\)
Cân bằng sẽ chuyển dịch theo chiều thuận khi
A. tăng nồng độ của NH3.
B. tăng áp suất.
C. tăng nhiệt độ.
D. giảm áp suất.
Câu 8. Để hòa tan một tấm Zn trong dung dịch HCl ở \(20^\circ C\) thì cần 27 phút, cũng tấm Zn đó tan hết trong dung dịch HCl nói trên ở \(40^\circ C\) trong 3 phút. Hỏi để hòa tan hết tấm Zn đó trong dung dịch HCl trên ở \(55^\circ C\) thì cần bao nhiêu thời gian?
A.60 giây. B.34,64 giây.
C.20 giây. D.40 giây.
Câu 9. Cho phản ứng :
\(Zn\left( r \right) + 2HCl\left( {{\rm{dd}}} \right) \to ZnC{l_2}\left( {{\rm{dd}}} \right) + {H_2}\left( k \right).\)
Nếu tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ
A. giảm, tốc độ phản ứng tạo ra sản phẩm tăng.
B. giảm, tốc độ phản ứng tạo ra sản phẩm giảm.
C. tăng, tốc độ phản ứng tạo ra sản phẩm tăng.
D. tăng, tốc độ phản ứng tạo ra sản phẩm giảm.
Câu 10. Cho thí nghiệm như hình vẽ:
Thí nghiệm trên dùng để nhận biết sự chuyển dịch cân bằng của phản ứng
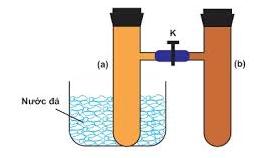
\(\eqalign{ & A.{\rm{ }}2N{O_2} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_4}. \cr & B.{\rm{ N}}{{\rm{O}}_3} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}{O_6}. \cr & C.{\rm{ 2NO}} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {{\rm{N}}_2}{O_2}. \cr & D.{\rm{ 2NO}} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {{\rm{N}}_2}{O_y}. \cr} \)
Câu 11. Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
A.Chất lỏng.
B. Chất rắn.
C.Chất khí.
D.Cả 3 đều đúng.
Câu 12. Cho cân bằng hóa học:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right)\mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} S{O_3}\left( k \right).\)
Phản ứng thuận là phản ứng tỏa nhiệt.
Chọn phát biểu sai trong các phát biểu sau đây:
A.Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C.Cân bằng chuyển dịch theo chiều thuận khi tăng áp suất hệ phản ứng.
D.Cân bằng chuyển dịch theo chiều thuận khi giảm nồng độ SO2.
Câu 13. Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohiđric
Nhóm thứ nhất: Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch axit HCl 2M.
Nhóm thứ hai: Cân 1g bột kẽm và thả vào cốc đựng 300 ml dung dịch axit HCl 2M.
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
A.nhóm thứ hai dùng nhiều axit hơn.
B.diện tích bề mặt bột kẽm lớn hơn.
C.nồng độ kẽm bột lớn hơn.
D.Cả ba nguyên nhân đều sai.
Câu 14. Khi nhiệt độ tăng thêm \(10^\circ C\) , tốc độ phản ứng hóa học tăng thêm 3 lần để tốc độ phản ứng đó (đang tiến hành ở \(30^\circ C\) ) tăng lên 81 lần thì cần thực hiện ở nhiệt độ nào?
A.\(40^\circ C\)
B.\(50^\circ C\)
C.\(60^\circ C.\)
D.\(70^\circ C.\)
Câu 15. Đại lượng đặc trưng cho độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là
A.tốc độ phản ứng.
B.cân bằng hóa học.
C.tốc độ tức thời.
D.quá trình hóa học.
Câu 16. Xét phản ứng sau:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2S{O_3}\left( k \right)\left( {\Delta H < 0} \right)\)
Nồng độ của SO3 sẽ tăng nếu
A.giảm nồng độ của SO2.
B.tăng nồng độ của SO2.
C.tăng nhiệt độ.
D.giảm nồng độ của O2.
Câu 17. Ở nước ta, nghề nấu rượu thủ công đã có từ ngàn xửa và hiện nay một số niws đã phát triển thành các làng nghề có tiếng như rượu làng Vân. Rượu được nấu bằng phương pháp lên men. Tinh bột (gạo, ngô, khoai, sắn...) được nấu chín để nguội, sau đó rắc lên một lớp men rồi đem ủ. Sau khoảng 10 – 20 ngày ( tùy thời tiết) đem chưng cất thu được rượu. Yếu tố nào đã được sử dụng để tăng tốc độ phản ứng theo cách làm trên?
A. Nhiệt độ. B. Xúc tác.
C. Nồng độ D. Áp suất.
Câu 18. Cho phản ứng ở trạng thái cân bằng:
\(A\left( k \right) + B\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} C\left( k \right) + D\left( k \right).\)
Ở điều kiện nhiệt độ và áp suất không đổi, nồng độ của khí A tăng lên khi?
A. tăng nồng độ của khí B.
B. giảm nồng độ của khí B.
C. giảm nồng độ của khí C.
D. giảm nồng độ của khí D.
Câu 19. Cho cân bằng hóa học sau:
\(4{H_2}\left( k \right) + F{e_3}{O_4}\left( r \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 3Fe\left( r \right) + 4{H_2}O\left( h \right)\)
Khi tăng áp suất cân bằng hóa học
A. sẽ dừng lại.
B. sẽ chuyển dịch từ trái sang phải.
C. không bị chuyển dịch.
D. sẽ chuyển dịch từ phải sang trái.
Câu 20. Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải khi tăng áp suất?
\(\eqalign{ & A.2{H_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2{H_2}O\left( k \right). \cr & B.2S{O_3}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2S{O_2}\left( k \right) + {O_2}\left( k \right). \cr & C.2NO\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {N_2}\left( k \right) + {O_2}\left( k \right). \cr & D.2C{O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2CO\left( k \right) + {O_2}\left( k \right). \cr} \)
Câu 21. Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì
A.chỉ làm tăng tốc độ của phản ứng thuận.
B.chỉ làm tăng tốc độ của phản ứng nghịch.
C.làm tăng tốc độ của phản ứng thuận và phản ứng nghịch như nhau.
D.không làm tăng tốc độ phản ứng thuận và phản ứng nghịch.
Câu 22. Trong phản ứng tổng hợp amoniac
\({N_2}\left( k \right) + 2{H_2}\left( k \right)\mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\left( k \right);\Delta H = - 9kJ\)
Sẽ thu được nhiều khí NH3 nếu
A.giảm nhiệt độ và áp suất.
B.tăng nhiệt độ và giảm áp suất.
C.tăng nhiệt độ và áp suất.
D.giảm nhiệt độ và tăng áp suất.
Câu 23. Cho các cân bằng sau
\(\eqalign{ & \left( I \right)2HI\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {H_2}\left( k \right) + {I_2}\left( k \right); \cr & \left( {II} \right)CaC{O_3}\left( r \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} CaO\left( r \right) + C{O_2}\left( k \right); \cr & \left( {III} \right)FeO\left( r \right) + CO\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} Fe\left( r \right) + C{O_2}\left( k \right); \cr & \left( {IV} \right)2S{O_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2S{O_3}\left( k \right). \cr} \)
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
A.4. B.3.
C.2. D.1.
Câu 24. Cho các phát biểu sau
1. Áp suất chỉ ảnh hưởng đến tốc độ phản ứng có chất khí.
2. Tất cả các phản ứng đều cần chất xúc tác để tăng tốc độ phản ứng.
3. Khi nấu thức ăn bằng nồi áp suất thì nhanh chín hơn do yếu tố tăng nhiệt độ.
4. Chất xúc tác làm tăng tốc độ của phản ứng và biến đổi thành chất khác sau khi phản ứng kết thúc.
5. Khi cho phản ứng với cùng một dung dịch axit, 1 gam bột sắt phản ứng sẽ nhanh hơn viên bi sắt nặng 1 gam.
Các phát biểu đúng là
A.(1), (3), (5).
B.(2), (3), (4).
C.(1), (5).
D.(2), (3), (5).
Câu 25. Cho các yếu tố sau:
a.nồng độ chất. b.áp suất.
c.xúc tác. d. nhiệt độ.
e.diện tích tiếp xúc.
Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là
A.a, b, c, d. B.b, c, d, e.
C.a,c, e. D.a,b, c, d, e.
Câu 26. Khi ninh (hầm) thịt cá, để chúng nhanh chín hơn ta có thể dùng cách nào sau đây?
A.Mở vung trong quá trình nấu.
B.Nấu bằng bếp củi.
C.Cho nhiều nước.
D.Thêm một ít muối.
Câu 27. Cho cân bằng hóa học:
\({N_2}\left( k \right) + 3{H_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\left( k \right)\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi
A.thay đổi áp suất của hệ.
B.thay đổi nồng độ N2.
C.thay đổi nhiệt độ.
D.thêm chất xúc tác Fe.
Câu 28.Nhận xét nào dưới đây về cân bằng hóa học là không đúng? Tại thời điểm cân bằng hóa học thiệt lập thì?
A.tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B.số mol các chất tham gia phản ứng không đổi.
C.số mol các sản phẩm không đổi.
D.phản ứng không xảy ra nữa.
Câu 29. Cho cân bằng hóa học sau:
\({H_2}\left( k \right) + {I_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2HI\left( k \right).\)
Yếu tố nào không ảnh hưởng đến cân bằng của hệ?
A.Nồng độ H2.
B.Nồng độ I2.
C.Áp suất chung.
D.Nhiệt độ.
Câu 30. Cho các phát biểu sau
1. Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
2. Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định.
3. Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
4. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
5. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là
A.2,3. B.3, 4.
C.3, 5. D.4, 5.
Lời giải chi tiết
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
B |
C |
D |
A |
C |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
A |
B |
B |
C |
A |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
B |
A |
B |
D |
A |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
B |
B |
B |
C |
A |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
C |
D |
D |
C |
D |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
D |
D |
D |
C |
C |
Câu 1
2 dung dịch chất tham gia phản ứng ở cả 2 thí nghiệm đều giống nhau, tuy nhiên ở thí nghiệm 2 có sự tác động của nhiệt độ
=> Thí nghiệm 2 xuất hiện kết tủa trước
Đáp án B
Câu 2
Tốc độ phản ứng là độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Đáp án C
Câu 3:
Giả sử thể tích đem đi phản ứng là 100ml
\(\Rightarrow {n_{HCl}} = \dfrac{{100.1,2.20}}{{100.35,5}} = 0,676\left( {mol} \right)\)
\(\Rightarrow {C_M} = 6,76M\)
Như vậy nồng độ axit trong dung dịch D là lớn nhất nên tốc độ phản ứng là lớn nhất.
Đáp án D.
Câu 4
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc ( trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là nhiệt độ và áp suất
Đáp án A
Câu 5
\(v = \left[ {{N_2}} \right]*{\left[ {{H_2}} \right]^3}\)
Khi tăng nồng độ H2 lên 2 lần thì tốc độ phản ứng sẽ tăng
Đáp án A
Câu 6
A. tăng áp suất. (đúng)
B. tăng thể tích của bình phản ứng. (sai do giảm khả năng tiếp xúc)
C. giảm áp suất. (sai)
D. giảm nồng độ của A. (sai)
Đáp án A
Câu 7:
Theo nguyên lí chuyển dịch cân bằng Lơ Satơliê, khi tác động một yếu tố bên ngoài vào một phản ứng thuận nghịch đang ở trạng thái cân bằng thì cân bằng sẽ chuyển dịch theo chiều chống lại sự tác động đó.
\({N_2}\left( k \right) + 3{H_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\)\(\,\left( k \right),\Delta H < 0\)
+ Khi tăng nồng độ của NH3, cân bằng chuyển dịch theo chiều giảm nồng độ của NH3 (chiều nghịch).
+ Khi tăng áp suất của hệ thì cân bằng chuyển dịch theo chiều tạo ra số mol khí nhỏ hơn (chiều thuận).
+ Khi tăng nhiệt độ: chiều thuận của phản ứng là phản ứng tỏa nhiệt, nên tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (chiều nghịch).
+ Khi giảm áp suất, cân bằng chuyển dịch theo chiều tạo ra số mol khí nhiều hơn (chiều nghịch).
Đáp án B.
Câu 8
Khi tăng nhiệt độ lên 10 độ, tốc độ tăng lên x lần
=> Tăng nhiệt độ từ 20 độ lên 40 độ, tức là tăng lên 20 độ => tốc độ tăng lên x2 lần.
x2 = 27 : 3 = 9 => x = 3
Khi đun nóng ở 55 độ, thì thời gian cần: \(\frac{{{t_1}}}{{{t_2}}} = \frac{{{v_2}}}{{{v_1}}} = {3^{\frac{{55 - 20}}{{10}}}}\)
=> t2 = 27 x 60 : \({3^{\frac{{55 - 20}}{{10}}}}\)= 34,64 s
Đáp án B
Câu 9:
Theo nguyên lí chuyển dịch cân bằng Lơ Satơliê: Khi tăng hoặc giảm nồng độ một chất trong cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ chất đó.
Vậy khi tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất tăng lên và tốc độ phản ứng tăng lên.
Đáp án C.
Câu 10
2 NO2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)N2O4
Khi nhiệt độ giảm xuống, cân bằng chuyển dịch theo chuyển thuận khiến cho màu sắc từ màu nâu đậm (NO2) nhạt màu dần (N2O4)
Đáp án A
Câu 11
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất rắn tham gia
Đáp án B
Câu 12:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right) \to 2S{O_3}\left( k \right)\). Phản ứng thuận là phản ứng tỏa nhiều.
A.Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ: Sai, vì khi tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (chiều nghịch).
B.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2: Đúng.
C.Cân bằng chuyển dịch theo chiều thuận khi tăng áp suất hệ phản ứng: Đúng
D.Cân bằng chuyển dịch theo chiều thuận khi giảm nồng độ SO2: Đúng.
Đáp án A
Câu 13
Ta nhận thấy, nồng độ axit ở cả 2 thí nghiệm là như nhau => axit không phải là tác nhân khiến cho xuất hiện nhiều bọt khí.
Ở thí nghiệm 2 thay vì dùng với miếng kẽm như thí nghiệm 1, người ta dùng bột kẽm => ở thí nghiệm 2, khí thoát ra sẽ nhanh hơn do diện tích bề mặt nhiều hơn.
Đáp án B
Câu 14:
\(\eqalign{ & {V_2} = {V_1}{.3^{{{{t_2} - {t_1}} \over {10}}}} = {V_1}{.3^{{{{t_2} - 30} \over {10}}}} = 81.{V_1} \cr & \Rightarrow {{{t_2} - 30} \over {10}} = 4 \Rightarrow {t_2} = 70 \cr} \)
Đáp án D.
Câu 15
Đại lượng đặc trưng cho độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là tốc độ phản ứng.
Đáp án A
Câu 16:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2S{O_3}\left( k \right)\)\(\,\left( {\Delta H < 0} \right)\)
+ Khi giảm nồng độ của SO2: cân bằng chuyển chuyện theo chiều tại ra SO2 (chiều nghịch)
\( \Rightarrow \) nồng độ của SO3 giảm.
+ Khi tăng nồng của SO2: cân bằng chuyển dịch theo chiều giảm nồng độ SO2 (chiều thuận)
\( \Rightarrow \) nồng độ của SO3 tăng.
+ Khi tăng nhiệt độ: chiều thuận của phản ứng là phản ứng tỏa nhiệt nên khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch \( \Rightarrow \)nồng độ của SO3 giảm.
+ Khi giảm độ của O2: cân bằng chuyển dịch theo chiều tạo ra O2 (chiều nghịch) \( \Rightarrow \)nồng độ của SO3 giảm.
Đáp án B
Câu 17
Men là chất xúc tác khiến rượu được hình thành nhanh hơn.
Đáp án B
Câu 18
Để tăng nồng độ của khí A ta cần để cho cân bằng chuyển qua chiều nghịch
Để cân bằng chuyển theo chiều thuận, ta cần giảm nồng độ của khí B => Cân bằng sẽ chuyển dịch theo chiều tăng nồng động khí B => cân bằng chuyển dịch theo chiều nghịch
Đáp án B
Câu 19
Ta nhận thấy, trong phương trình trên, n H2 (tham gia) = n H2O (sản phẩm)
=> Khi tăng áp suất thì cân bằng không bị chuyển dịch
Đáp án C
Câu 20
Để hệ cân bằng chuyển dịch sang bên phải khi tăng áp suất thì lượng khí sản phẩm tạp thành phải nhỏ hơn lượng khí chất tham gia phản ứng
Đáp án A
Câu 21
Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì làm tăng tốc độ của phản ứng thuận và phản ứng nghịch như nhau.
Đáp án C
Câu 22
Để thu được nhiều khí NH3 => Cân bằng chuyển dịch theo chiều thuận
Phản ứng này là phản ứng tỏa nhiệt => ta cần giảm nhiệt độ
Tổng số mol khí tạo thành sau phản ứng nhỏ hơn số mol khí tham gia phản ứng => ta cần tăng áp suất
Đáo án D
Câu 23:
Giảm áp suất cân bằng chuyển dịch theo chiều tăng áp suất của hệ (tăng tổng số mol khí)
\(\left( I \right)2HI\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} {H_2}\left( k \right) + {I_2}\left( k \right)\): giảm áp suất, cân bằng không chuyển dịch.
\(\left( {II} \right)CaC{O_3}\left( r \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} CaO\left( r \right) + C{O_2}\left( k \right)\): giảm áp suất, cân bằng chuyển dịch theo chiều thuận.
\(\left( {III} \right)FeO\left( r \right) + CO\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} Fe\left( r \right) + C{O_2}\left( k \right)\): giảm áp suất, cân bằng không chuyển dịch
\(\left( {IV} \right)2S{O_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2S{O_3}\left( k \right)\) : giảm áp suất, cân bằng chuyển dịch theo chiều nghịch
Đáp án D.
Câu 24
1. Áp suất chỉ ảnh hưởng đến tốc độ phản ứng có chất khí. (đúng)
2. Tất cả các phản ứng đều cần chất xúc tác để tăng tốc độ phản ứng. (sai)
3. Khi nấu thức ăn bằng nồi áp suất thì nhanh chín hơn do yếu tố tăng nhiệt độ. (sai, yếu tố áp suất)
4. Chất xúc tác làm tăng tốc độ của phản ứng và biến đổi thành chất khác sau khi phản ứng kết thúc. (sai, chất xúc tác không tham gia vào phản ứng hóa học)
5. Khi cho phản ứng với cùng một dung dịch axit, 1 gam bột sắt phản ứng sẽ nhanh hơn viên bi sắt nặng 1 gam. (đúng)
Đáp án C
Câu 25
Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ, áp suất, chất xúc tác, nhiệt độ, diện tích tiếp xúc.
Đáp án D
Câu 26
Khi ninh (hầm) thịt cá, để chúng nhanh chín hơn ta có thể dùng cách cho thêm một ít muối (yếu tố chất xúc tác)
Đáp án D
Câu 27
Chất xúc tác không làm ảnh hưởng đến cân bằng hóa học.
Đáp án D
Câu 28
A.tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. (đúng)
B.số mol các chất tham gia phản ứng không đổi. (đúng)
C.số mol các sản phẩm không đổi. (đúng)
D.phản ứng không xảy ra nữa. (sai, vì đây là cân bằng động nên phản ứng vẫn xảy ra)
Đáp án D
Câu 29
Ta nhận thấy, số mol khí tham gia phản ứng bằng với số mol khí sản phẩm
=> Khi thay đổi áp suất chung thì cân bằng không bị chuyển dịch.
Đáp án C
Câu 30
1. Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau. (đúng)
2. Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định. (đúng)
3. Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn. (sai)
4. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi. (đúng)
5. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại. (sai)
Đáp án C
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận