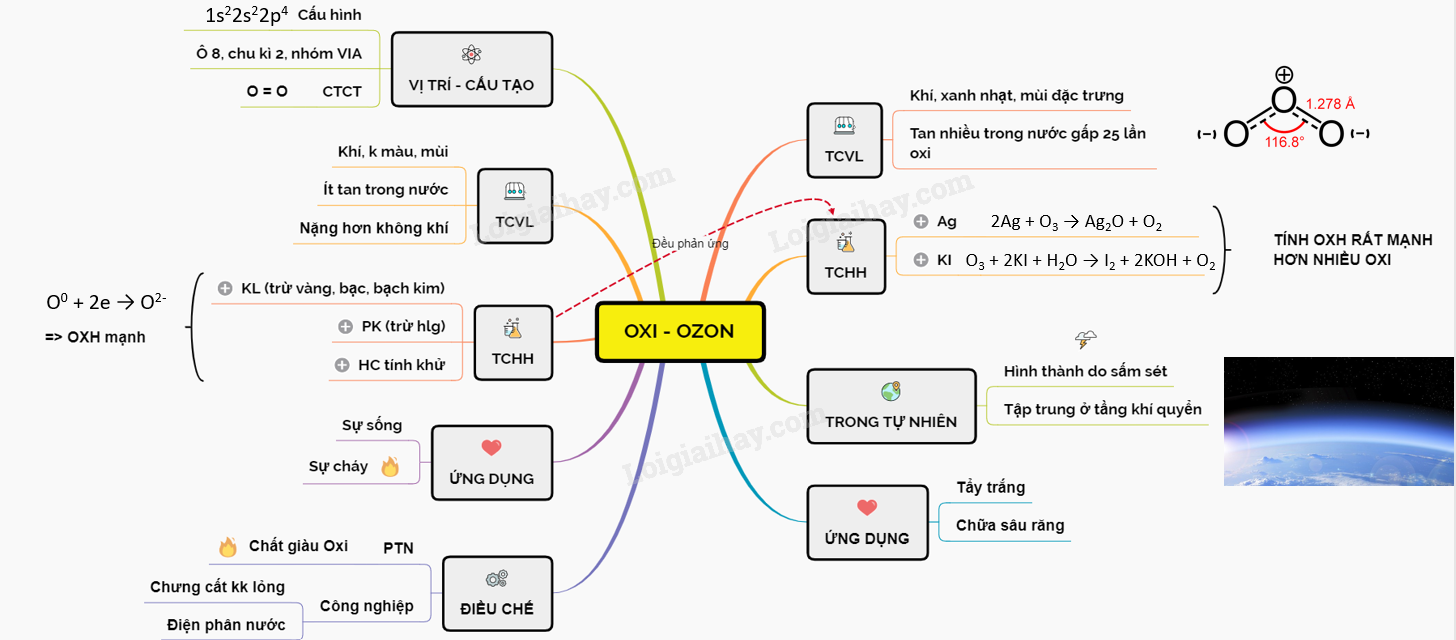
Bài 29: Oxi - Ozon
Nguyên tố oxi có ....
A. OXI
I. VỊ TRÍ VÀ CẤU TẠO
- ZO = 8. Cấu hình e: 1s22s22p4
=> Oxi thuộc chu kì 2 nhóm VIA
- Ở điều kiện thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hóa trị không cực.
- CTCT của oxi: O = O
II. TÍNH CHẤT VẬT Lí
- Là chất khí, không màu, không mùi, ít tan trong nước, hơi nặng hơn không khí.
III. TÍNH CHẤT HÓA HỌC
- Nguyên tử O có 6 e lớp ngoài cùng nên có xu hướng nhận 2 e khi tham gia phản ứng hóa học.
=> Oxi thể hiện tính OXH mạnh khi tham gia phản ứng hóa học.
1. Tác dụng hết với hầu hết các kim loại (trừ vàng, bạc và bạch kim)
2Mg + O2 \(\xrightarrow{t{}^{o}}\) 2MgO
3Fe + 2O2 \(\xrightarrow{t{}^{o}}\) Fe3O4
2. Tác dụng trực tiếp với các phi kim (trừ các halogen)
S + O2 \(\xrightarrow{t{}^{o}}\) SO2
N2 + O2 \(\xrightarrow{t{}^{o}}\) 2NO
3. Tác dụng với các hợp chất có tính khử
2SO2 + O2 \(\xrightarrow{{{t^o}}}\) 2SO3
4FeS2 + 11O2 \(\xrightarrow{{{t^o}}}\)2 Fe2O3 + 8SO2
CH4 + 2O2 \(\xrightarrow{{{t^o}}}\) CO2 + 2H2O
IV. ỨNG DỤNG
- Oxi duy trì sự sống và sự cháy
- được dùng trong y khoa, công nghiệp hóa chất, luyện thép, hàn cắt kim loại, ....
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Phân hủy những hợp chất giàu oxi, ít bền với nhiệt như KMnO4, KClO3,...
VD:
2KMnO4 \(\xrightarrow{{{t^o}}}\) K2MnO4 + MnO2 + O2
2. Trong công nghiệp
a. Chưng cất phân đoạn không khí lỏng
b. Điện phân nước
B. OZON
Ozon là một dạng thù hình của khí oxi.
I. TÍNH CHẤT VẬT Lí
Khí ozon màu xanh nhạt, mùi đặc trưng, hóa lỏng ở nhiệt độ -112 độ C. Khí ozon tan trong nước nhiều hơn so với oxi (gấp khoảng 25 lần)
II. TÍNH CHẤT HÓA HỌC
- Ozon có tính OXH rất mạnh và mạnh hơn oxi.
=> Oxi phản ứng với chất nào thì ozon cũng phản ứng được với chất đó, nhưng với mức độ mạnh hơn.
- Một số phản ứng ozon có thể phản ứng được còn oxi thì không
+ Ozon oxi hóa được Ag ở nhiệt độ thường, còn oxi không làm được điều này:
2Ag + O3 \(\to \) Ag2O + O2
2Ag + O2\(\to \)Không phản ứng
+ Ozon oxi hóa được dung dịch KI còn oxi thì không làm được điều này:
O3 + 2KI + H2O \(\to \) I2 + 2KOH + O2
O2 + 2KI + H2O : Không phản ứng
III. OZON TRONG TỰ NHIÊN
- Được hình thành trong khí quyển khi có sự phóng điện (sấm sét,...), do sự oxh một số chất hữu cơ.
- Ozon tập trung nhiều ở tầng khí quyển. Tầng ozon hấp thụ tia tử ngoại từ tầng cao của không khí, bảo vệ con người và các sinh vật trên mặt đất.
Video mô phỏng - Hiện tượng thủng tầng ozon
IV. ỨNG DỤNG
- Tẩy trắng tinh bột, dầu ăn
- Chữa sâu răng, sát trùng nước sinh hoạt.
Sơ đồ tư duy: Oxi - Ozon
Loigiaihay.com
Các bài khác cùng chuyên mục













Danh sách bình luận