Lý thuyết đơn chất và hợp chất - phân tử
LÝ THUYẾT CẦN NHỚ
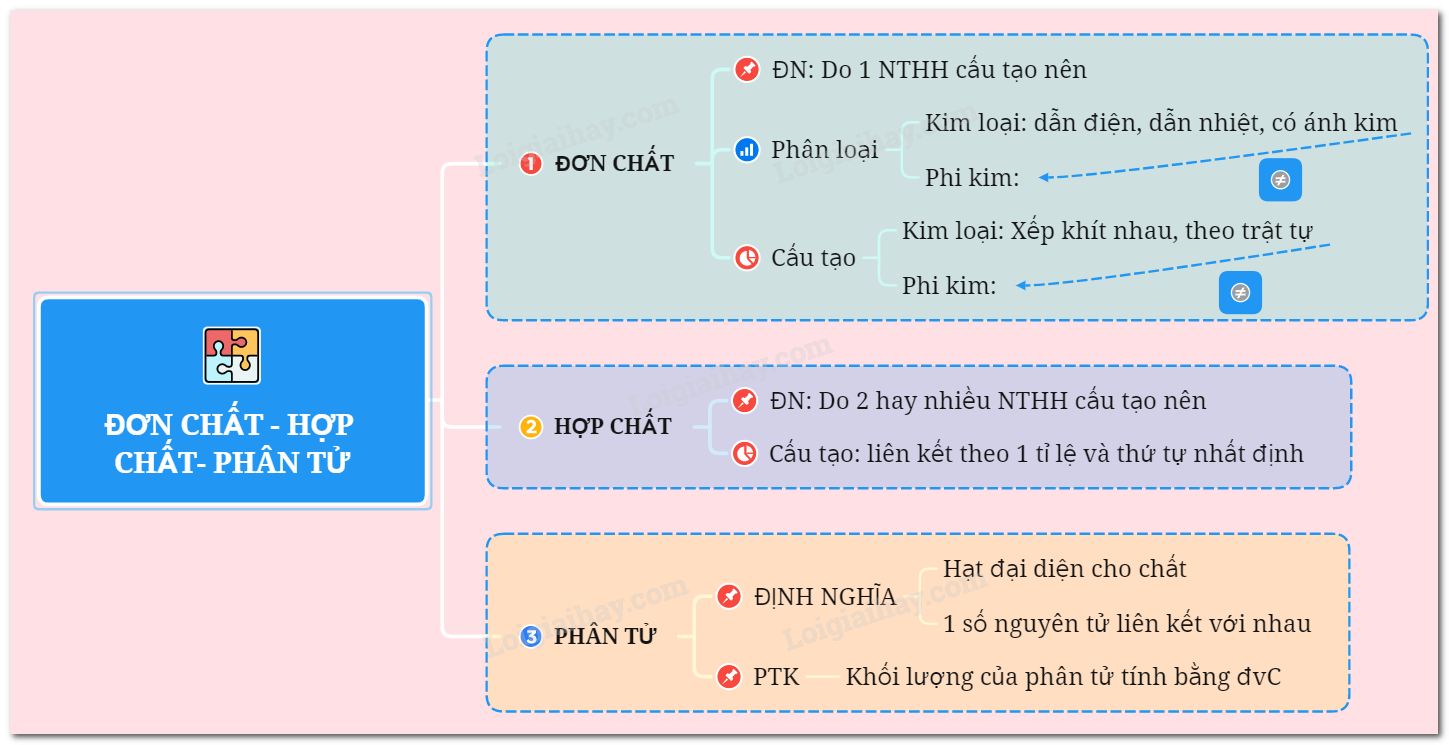
I. ĐƠN CHẤT
1. Khái niệm
- Khí oxi tạo nên từ nguyên tố O.
- Kim loại natri tạo nên từ nguyên tố Na.
- Kim loại nhôm tạo nên từ nguyên tố Al.
=> khí oxi, kim loại Na, Al gọi là đơn chất.
* Định nghĩa: Đơn chất do 1 nguyên tố hoá học cấu tạo nên.
- Đơn chất kim loại: Dẫn điện, dẫn nhiệt, có ánh kim.
- Đơn chất phi kim: Không dẫn điện, không dẫn nhiệt, không có ánh kim.
*Kết luận:
- Đơn chất do 1 nguyên tố hóa học cấu tạo nên.
- Gồm 2 loại đơn chất : Đơn chất kim loại và đơn chất phi kim.
2. Đặc điểm cấu tạo
- Đơn chất kim loại: Nguyên tử sắp xếp khít nhau và theo một trật tự xác định.

- Đơn chất phi kim: Nguyên tử liên kết với nhau theo một số nhất định (thường là 2 nguyên tử).
II. HỢP CHẤT
1. Khái niệm
Ví dụ:
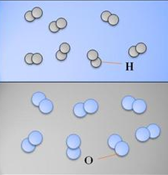
- Nước: H2O gồm nguyên tố H và nguyên tố O.
- Muối ăn: NaCl gồm nguyên tố Na và Cl.
- Axit sunfuric: H2SO4 gồm nguyên tố H, S và O.
* Định nghĩa: Hợp chất là những chất tạo nên từ 2 nguyên tố hóa học trở lên.
- Hợp chất gồm:
+ Hợp chất vô cơ: H2O, NaOH, NaCl, H2SO4....
+ Hợp chất hữu cơ: CH4 (metan), C12H22O11 (đường), C2H2 (axetilen), C2H4 (etilen),...
2. Đặc điểm cấu tạo
- Trong hợp chất: Nguyên tố liên kết với nhau theo một tỷ lệ và một thứ tự nhất định.
III. PHÂN TỬ
1. Định nghĩa
Ví dụ:
- Khí hiđro, oxi : 2 nguyên tử cùng loại liên kết với nhau.
- Nước : 2H liên kết với 1O
- Muối ăn: 1Na liên kết với 1Cl
* Định nghĩa: Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hoá học của chất.
2. Phân tử khối
* Định nghĩa: Phân tử khối là khối lượng của một phân tử tính bằng đơn vị Cacbon (đvC)
VD: O2 = 2.16 = 32 đvC ; Cl2 = 71 đvC.
CaCO3 = 100 đvC ; H2SO4 = 98 đvC.
IV. TRẠNG THÁI CỦA CHẤT
- Mỗi mẫu chất là một tập hợp vô cùng lớn những hạt nguyên tử hay phân tử.
- Tuỳ điều kiện mỗi chất có thể ở 3 trạng thái: rắn, lỏng, khí. Ở trạng thái khí các hạt cách xa nhau.
* So sánh đơn chất và hợp chất
|
|
Đơn chất |
Hợp chất |
|
Ví dụ |
Sắt, đồng, oxi, nitơ, than chì… |
Nước, muối ăn, đường… |
|
Khái niệm |
Là những chất do 1 nguyên tố hoá học cấu tạo nên |
Là những chất do 2 hay nhiều nguyên tố hoá học cấu tạo nên |
|
Phân loại |
Gồm 2 loại: Kim loại và phi kim. |
Gồm 2 loại: hợp chất vô cơ và hợp chất hữu cơ |
|
Phân tử (hạt đại diện) |
- Gồm 1 nguyên tử: kim loại và phi kim rắn - Gồm các nguyên tử cùng loại: Phi kim lỏng và khí |
- Gồm các nguyên tử khác loại thuộc các nguyên tố hoá học khác nhau |
|
Công thức hóa học |
- Kim loại và phi kim rắn: CTHH = KHHH (A) - Phi kim lỏng và khí: CTHH = KHHH + chỉ số (Ax) |
CTHH = KHHH của các nguyên tố + các chỉ số tương ứng AxBy |
* So sánh nguyên tử và phân tử
|
|
Nguyên tử |
Phân tử |
|
Định nghĩa |
Là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất |
Là hạt vô cùng nhỏ, đại diện cho chất và mang đầy đủ tính chất của chất |
|
Sự biến đổi trong phản ứng hoá học. |
Nguyên tử được bảo toàn trong các phản ứng hoá học. |
Liên kết giữa các nguyên tử trong phân tử thay đổi làm cho phân tử này biến đổi thành phân tử khác |
|
Khối lượng |
Nguyên tử khối (NTK) cho biết độ nặng nhẹ khác nhau giữa các nguyên tử và là đại lượng đặc trưng cho mỗi nguyên tố NTK là khối lượng của nguyên tử tính bằng đơn vị Cacbon |
Phân tử khối (PTK) là khối lượng của 1 phân tử tính bằng đơn vị Cacbon PTK = tổng khối lượng các nguyên tử có trong phân tử. |
Sơ đồ tư duy: Đơn chất - Hợp chất - Phân tử
Các bài khác cùng chuyên mục













Danh sách bình luận