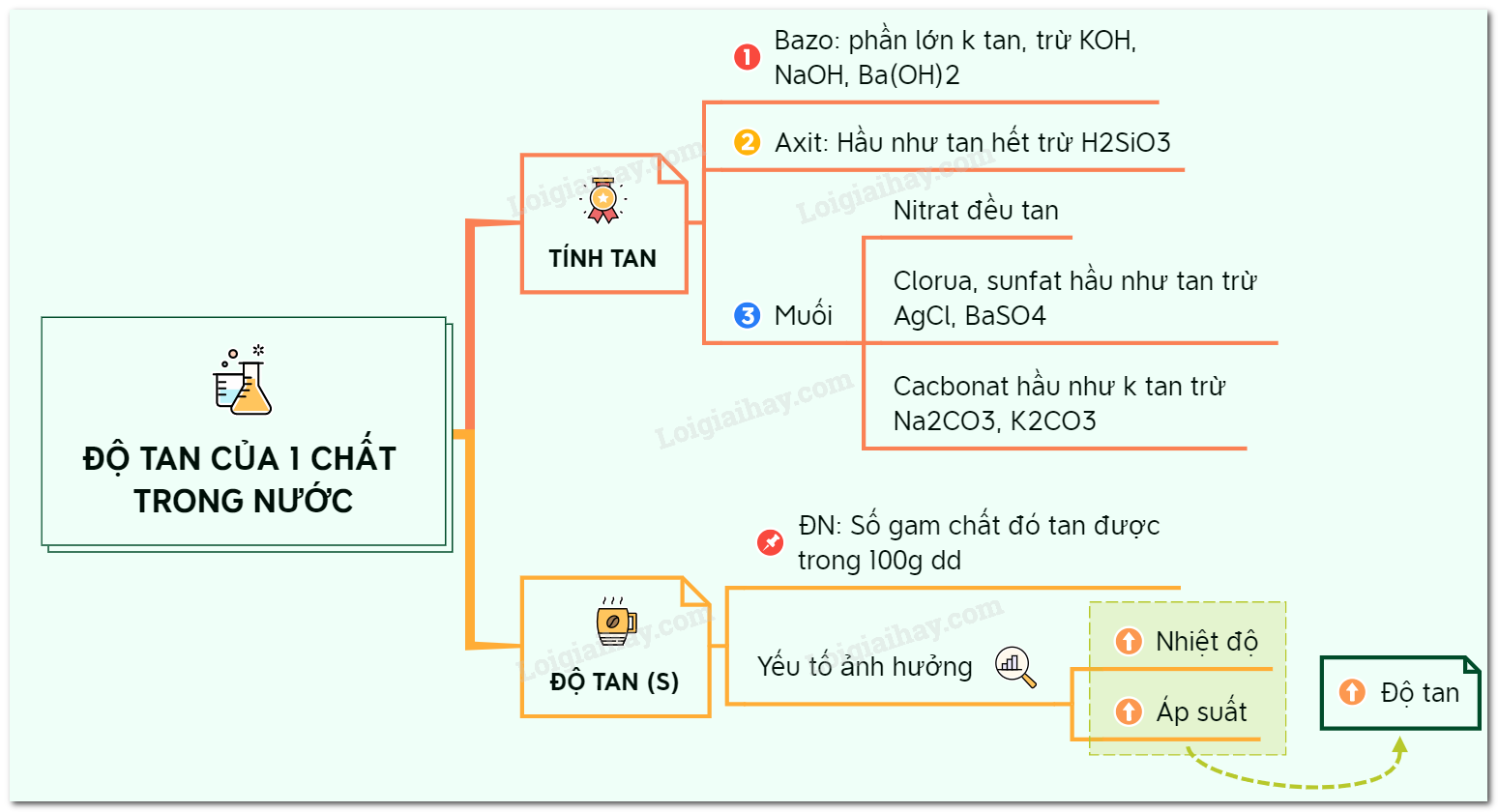
Lý thuyết độ tan của một chất trong nước
Tính tan của các hợp chất trong nước:
I. Chất tan và chất không tan
- Có chất tan được trong nước, có chất không tan được trong nước.
Ví dụ: muối ăn tan được trong nước còn cát không tan trong nước.
II. Tính tan của các hợp chất trong nước
- Bazơ: phần lớn các bazơ không tan, trừ NaOH, KOH, Ba(OH)2 tan, Ca(OH)2 ít tan.
- Axit: hầu hết các axit tan được, trừ H2SiO3.
- Muối:
+ Các muối nitrat đều tan.
+ Phần lớn các muối cloua đều tan trừ AgCl không tan, PbCl2 ít tan.
+ Phần lớn các muối sunfat đều tan trừ PbSO4, BaSO4 không tan, CaSO4 và Ag2SO4 ít tan.
+ Phần lớn muối cacbonat không tan trừ Na2CO3, K2CO3, (NH4)2CO3 tan.
+ Phần lớn muối sunfit không tan trừ Na2SO3, K2SO3, (NH4)2SO3 tan.
III. Độ tan của một chất trong nước
1. Định nghĩa
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định.
Ví dụ: Ở 25oC khi hòa tan 36 gam muối NaCl vào 100 gam nước thì người ta thu được dung dịch muối bão hòa. Người ta nói độ tan của NaCl ở 25oC là 36 gam hay SNaCl = 36 gam
* Phương pháp giải bài tập tính độ tan:
Áp dụng công thức tính độ tan: $S=\frac{{{m}_{ct}}}{{{m}_{dm}}}.100$
Trong đó: mct là khối lượng chất tan để tạo thành dung dịch bão hòa
mdm là khối lượng dung môi (nước) để tạo thành dung dịch bão hòa
2. Những yếu tố ảnh hưởng đến độ tan
- Độ tan của chất rắn phụ thuộc vào nhiệt độ. Phần lớn tăng nhiệt độ thì độ tan của chất rắn tăng.
- Độ tan của chất khí phụ thuộc vào nhiệt độ và áp suất. Độ tan của chất khí tăng khi giảm nhiệt độ và tăng áp suất.
Sơ đồ tư duy: Độ tan của một chất trong nước
Các bài khác cùng chuyên mục













Danh sách bình luận