 Giải bài tập Tài liệu Dạy - học Hóa học lớp 8, Phát triển tư duy đột phá trong dạy học Hóa học 8
Giải bài tập Tài liệu Dạy - học Hóa học lớp 8, Phát triển tư duy đột phá trong dạy học Hóa học 8
 Bài 42. Nồng độ dung dịch
Bài 42. Nồng độ dung dịch
Hoạt động 2 trang 81 Tài liệu dạy - học Hóa học 8 tập 2
Giải bài tập Hoạt động 2 trang 81 Tài liệu dạy - học Hóa học 8 tập 2.
Đề bài
Tìm hiểu về nồng độ mol của dung dịch.
Học sinh đọc thông tin sau và thảo luận nhóm
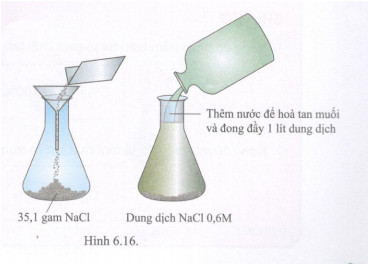
Trung bình trong nước biển nồng độ mol muối ăn vào khoảng 0,6M. Đề đơn giản có thể xem như nước biển chỉ chứa NaCl, dung dịch NaCl 0,6M có thể pha chế như sau:
- Cân 35,1 gam NaCl ( 0,6 mol) cho vào bình đong.
- thêm nước vào để được 1 lit dung dịch ( hình 6.16).
Các em hãy nhận xét và nêu khái niệm về nồng độ mol của dung dịch.
Lời giải chi tiết
|
Nồng độ mol ( kí hiệu là \({C_M}\) ) của dung dịch cho biết số mol chất tan có trong 1 lit dung dịch. \({C_M} = {n \over V}\) trong đó: n là số mol chất tan ( mol ) |
Ví dụ 4: trong 100 gam dung dịch có hòa tan 8 gam \(CuS{O_4}\) . Tính nồng độ mol của dung dịch . ( cho biết khối lượng mol: Cu= 64.S=32.O=16)
Số mol \(CuS{O_4}\) có trong dung dịch là :
\({n_{CuS{O_4}}} = {8 \over {160}} = 0,05mol\)
Nồng độ mol của dung dịch \(CuS{O_4}\)là :
\({C_{M.CuS{O_4}}} = {{{n_{CuS{O_4}}}} \over {{V_{{\rm{dd}}}}}} = {{0,05} \over {0,1}} = 0,5\) (mol/l) hay 0,5M.
Ví dụ 5 : cần bao nhiêu gam \({H_2}S{O_4}\) nguyên chất để điều chế 200ml dung dịch \({H_2}S{O_4}\) 3M?
( cho khối lượng mol H=1.S=32.O=16)
Số mol \({H_2}S{O_4}\) trong 200 ml là:
\({C_{M.{H_2}S{O_4}}} = {{{n_{{H_2}S{O_4}}}} \over {{V_{{\rm{dd}}}}}}\) \( \Rightarrow {n_{{H_2}S{O_4}}} = {C_{M.{H_2}S{O_4}}}.{V_{{\rm{dd}}}}\) \( = 3.0,2 = 0,6\) mol.
Số gam \({H_2}S{O_4}\) nguyên chất là : \({m_{{H_2}S{O_4}}} = 0,6.98 = 58,8\) gam.
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận