 Giải bài tập Tài liệu Dạy - học Hóa học lớp 8, Phát triển tư duy đột phá trong dạy học Hóa học 8
Giải bài tập Tài liệu Dạy - học Hóa học lớp 8, Phát triển tư duy đột phá trong dạy học Hóa học 8
 Bài 42. Nồng độ dung dịch
Bài 42. Nồng độ dung dịch
Bài 5 trang 83 Tài liệu dạy - học Hóa học 8 tập 2
Giải bài tập Bài 5 trang 83 Tài liệu dạy - học Hóa học 8 tập 2.
Đề bài
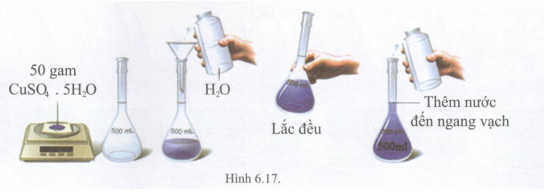
Cho bài tập thực nghiệm như hình 6.17 và tính nồng độ dung dịch thu được.
Lời giải chi tiết
Học sinh vào phòng thí nghiệm và làm thí nghiệm như hình vẽ.
Số mol của \(CuS{O_4}.5{H_2}O\) là :
\(\eqalign{ & {n_{CuS{O_4}.5{H_2}O}} = {{{m_{CuS{O_4}.5{H_2}O}}} \over {{M_{CuS{O_4}.5{H_2}O}}}} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\,= {{50} \over {160 + 5.18}} = 0,2mol \cr & \Rightarrow {n_{CuS{O_4}}} = {n_{CuS{O_4}.5{H_2}O}} = 0,2mol \cr} \)
Nồng độ mol của dung dịch thu được là :
\({CM_{.CuS{O_4}}} = {{{n_{CuS{O_4}}}} \over {{V_{{\rm{dd}}}}}} = {{0,2} \over {0,5}} = 0,4M\)
Loigiaihay.com
Các bài khác cùng chuyên mục












Danh sách bình luận