Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 6
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Đề bài
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
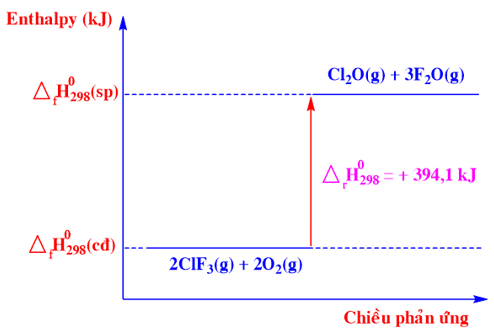
-
A.
Cl2O (g) + 3F2O (g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
-
B.
Cl2O (g) + 3F2O(g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
C.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
D.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Dãy các chất nào sau đây đều tác dụng với hydrochloric acid?
-
A.
Fe2O3, KMnO4, Cu, Fe, AgNO3.
-
B.
Fe2O3, KMnO4¸Fe, CuO, AgNO3.
-
C.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
-
D.
KMnO4, Cu, Fe, H2SO4, Mg(OH)2.
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC).
Trường hợp nào tốc độ phản ứng không đổi ?
-
A.
Thay 5 gam Zn viên bằng 5 gam Zn bột.
-
B.
Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
-
C.
Tăng nhiệt độ phản ứng từ 25oC đến 50oC
-
D.
Dùng thể tích dung dịch H2SO4 gấp đôi ban đầu.
Phát biểu nào sau đây là đúng ?
-
A.
Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon HI.
-
B.
Hydrohalic acid có tính khử mạnh nhất là HF.
-
C.
Có thể phân biệt 3 bình khí HCl, Cl2, H2 bằng thuốc thử quỳ tím ẩm.
-
D.
Trong dãy các hydrogen halide HX, năng lượng liên kết tăng dần từ HF đến HI.
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P(s, đỏ) \( \to \)P (s, trắng) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ
Điều này chứng tỏ phản ứng:
-
A.
tỏa nhiệt, P trắng bền hơn P đỏ.
-
B.
thu nhiệt, P trắng bền hơn P đỏ.
-
C.
tỏa nhiệt, P đỏ bền hơn P trắng.
-
D.
thu nhiệt, P đỏ bền hơn P trắng.
Cho 5,6 gam kim loại sắt vào dung dịch hydrochloric acid, sau phản ứng thu được V lít khí ở đkc. Giá trị của V là:
-
A.
2,479.
-
B.
4,98.
-
C.
3,78.
-
D.
5,60.
Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào?
-
A.
Tăng dần.
-
B.
Giảm dần
-
C.
Tăng sau đó giảm.
-
D.
Không xác định được.
Điều kiện nào sau đây không phải là điều kiện chuẩn ?
-
A.
Áp suất 1bar và nhiệt độ 250C hay 298K
-
B.
Áp suất 1bar và nhiệt độ 298K
-
C.
Áp suất 1bar và nhiệt độ 250C
-
D.
Áp suất 1bar và nhiệt độ 25K
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
-
A.
Vì phản ứng nung vôi là phản ứng tỏa nhiệt.
-
B.
Vì phải ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
-
C.
Để rút ngắn thời gian nung vôi.
-
D.
Vì than hấp thu bớt lượng nhiệt tỏa ra của phản ứng nung vôi.
Tốc độ phản ứng là
-
A.
độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
-
B.
độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
-
C.
độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
-
D.
độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + 1/2O2(g) → CO2(g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Biết nhiệt tạo thành chuẩn của CO2 là -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
-
A.
+221,0 kJ.
-
B.
-221,0 kJ.
-
C.
+110,5 kJ.
-
D.
–110,5 kJ.
Cho các yếu tố: nhiệt độ, áp suất, diện tích bề mặt tiếp xúc, chất xúc tác, nồng độ. Có bao nhiêu yếu tố có thể ảnh hưởng đến tốc độ của phản ứng?
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
-
A.
Nhận thêm 1 electron.
-
B.
Nhường đi 1 electron.
-
C.
Nhận thêm 2 electron.
-
D.
Nhường đi 7 electron.
Hóa chất nào sau đây thường dùng để nhận biết I2?
-
A.
Phenolphtalein.
-
B.
Hồ tinh bột.
-
C.
Quỳ tím.
-
D.
Nước vôi trong.
Một phản ứng có hệ số nhiệt độ Van’t Hoff là γ = 3. Khi nhiệt độ tăng 10oC, tốc độ của phản ứng trên sẽ
-
A.
tăng 3 lần.
-
B.
tăng 9 lần.
-
C.
tăng 9 lần.
-
D.
giảm 3 lần.
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
Quan sát hiện tượng và trả lời câu hỏi:
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
Những câu sau đây là đúng hay sai:
a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) \({\Delta _r}H_{298}^o < 0\)
Cho các phản ứng sau:
a) Trong phản ứng:
3CH3CH2OH + K2Cr2O7 + 4H2SO4 --> 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O
b) Trong phản ứng quang hợp:
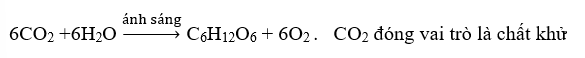
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
d) Quá trình khử là quá trình nhận electron
Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau:
NaCl (aq) + H2O (l) \( \to \) A (aq) + X (g) + Y (g) (*)
a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
Lời giải và đáp án
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:

-
A.
Cl2O (g) + 3F2O (g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
-
B.
Cl2O (g) + 3F2O(g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
C.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
D.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Đáp án : C
Dựa vào sơ đồ biểu diễn biến thiên enthalpy
Chất tham gia: ClF3(g) và O2(g)
Chất sản phẩm: Cl2O(g) và F2O(g)
Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0\) = +394,10 kJ
=>2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
Dãy các chất nào sau đây đều tác dụng với hydrochloric acid?
-
A.
Fe2O3, KMnO4, Cu, Fe, AgNO3.
-
B.
Fe2O3, KMnO4¸Fe, CuO, AgNO3.
-
C.
Fe, CuO, H2SO4, Ag, Mg(OH)2.
-
D.
KMnO4, Cu, Fe, H2SO4, Mg(OH)2.
Đáp án : B
Dựa vào tính chất hóa học của HCl
HCl tác dụng với Fe2O3, KMnO4¸Fe, CuO, AgNO3.
Đáp án B
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC).
Trường hợp nào tốc độ phản ứng không đổi ?
-
A.
Thay 5 gam Zn viên bằng 5 gam Zn bột.
-
B.
Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
-
C.
Tăng nhiệt độ phản ứng từ 25oC đến 50oC
-
D.
Dùng thể tích dung dịch H2SO4 gấp đôi ban đầu.
Đáp án : D
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Trường hợp không làm thay đổi tốc độ phản ứng là: dùng thể tích dung dịch H2SO4 gấp đôi ban đầu
Đáp án D
Phát biểu nào sau đây là đúng ?
-
A.
Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon HI.
-
B.
Hydrohalic acid có tính khử mạnh nhất là HF.
-
C.
Có thể phân biệt 3 bình khí HCl, Cl2, H2 bằng thuốc thử quỳ tím ẩm.
-
D.
Trong dãy các hydrogen halide HX, năng lượng liên kết tăng dần từ HF đến HI.
Đáp án : C
Có thể phân biệt 3 bình khí HCl, Cl2, H2 bằng quỳ tím ẩm. Vì HCl làm quỳ tím chuyển màu đỏ, Cl2 làm quỳ tím chuyển hồng, sau đó mất màu dần, H2 không làm quỳ tìm đổi màu.
Đáp án C
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P(s, đỏ) \( \to \)P (s, trắng) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ
Điều này chứng tỏ phản ứng:
-
A.
tỏa nhiệt, P trắng bền hơn P đỏ.
-
B.
thu nhiệt, P trắng bền hơn P đỏ.
-
C.
tỏa nhiệt, P đỏ bền hơn P trắng.
-
D.
thu nhiệt, P đỏ bền hơn P trắng.
Đáp án : D
Dựa vào dấu của biến thiên enthalpy
Phản ứng trên có \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ > 0 => phản ứng thu nhiệt, P đỏ bền hơn P trắng
Đáp án D
Cho 5,6 gam kim loại sắt vào dung dịch hydrochloric acid, sau phản ứng thu được V lít khí ở đkc. Giá trị của V là:
-
A.
2,479.
-
B.
4,98.
-
C.
3,78.
-
D.
5,60.
Đáp án : A
Dựa vào số mol của Fe
n Fe = 5,6: 56 = 0,1 mol
Fe + 2HCl \( \to \)FeCl2 + H2
0,1 0,1
V H2 = 0,1 . 24,79 = 2,479l
Đáp án A
Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào?
-
A.
Tăng dần.
-
B.
Giảm dần
-
C.
Tăng sau đó giảm.
-
D.
Không xác định được.
Đáp án : A
Dựa vào xu hướng biến đổi của tính acid
Từ HF đến HI, tính acid tăng dần
Đáp án A
Điều kiện nào sau đây không phải là điều kiện chuẩn ?
-
A.
Áp suất 1bar và nhiệt độ 250C hay 298K
-
B.
Áp suất 1bar và nhiệt độ 298K
-
C.
Áp suất 1bar và nhiệt độ 250C
-
D.
Áp suất 1bar và nhiệt độ 25K
Đáp án : D
Dựa vào khái niệm điều kiện chuẩn
Điều kiện ở áp suất 1 bar và nhiệt độ 25K không phải điều kiện chuẩn
Đáp án D
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
-
A.
Vì phản ứng nung vôi là phản ứng tỏa nhiệt.
-
B.
Vì phải ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
-
C.
Để rút ngắn thời gian nung vôi.
-
D.
Vì than hấp thu bớt lượng nhiệt tỏa ra của phản ứng nung vôi.
Đáp án : B
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Xếp đá vôi lẫn với than trong lò vì phản ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
Đáp án B
Tốc độ phản ứng là
-
A.
độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
-
B.
độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
-
C.
độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
-
D.
độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Đáp án : C
Dựa vào khái niệm tốc độ phản ứng
Tốc độ phản ứng là độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian
Đáp án C
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + 1/2O2(g) → CO2(g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Biết nhiệt tạo thành chuẩn của CO2 là -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
-
A.
+221,0 kJ.
-
B.
-221,0 kJ.
-
C.
+110,5 kJ.
-
D.
–110,5 kJ.
Đáp án : D
Dựa vào công thức tính biến thiên enthalpy của phản ứng
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CO) = - 283,0\\ \to {\Delta _f}H_{298}^o(CO) = {\Delta _f}H_{298}^o(C{O_2}) + 283 = - 393,5 + 283 = - 110,5kJ\end{array}\)
Đáp án D
Cho các yếu tố: nhiệt độ, áp suất, diện tích bề mặt tiếp xúc, chất xúc tác, nồng độ. Có bao nhiêu yếu tố có thể ảnh hưởng đến tốc độ của phản ứng?
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Có 5 yếu tố ảnh hưởng đến tốc độ phản ứng
Đáp án A
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
-
A.
Nhận thêm 1 electron.
-
B.
Nhường đi 1 electron.
-
C.
Nhận thêm 2 electron.
-
D.
Nhường đi 7 electron.
Đáp án : A
Dựa vào cấu hình electron lớp ngoài của nguyên tố halogen
Các nguyên tố halogen có 7 electron lớp ngoài cùng nên có xu hướng nhận thêm 1 electron
Đáp án A
Hóa chất nào sau đây thường dùng để nhận biết I2?
-
A.
Phenolphtalein.
-
B.
Hồ tinh bột.
-
C.
Quỳ tím.
-
D.
Nước vôi trong.
Đáp án : B
Có thể dùng hồ tinh bột để nhận biết I2
Một phản ứng có hệ số nhiệt độ Van’t Hoff là γ = 3. Khi nhiệt độ tăng 10oC, tốc độ của phản ứng trên sẽ
-
A.
tăng 3 lần.
-
B.
tăng 9 lần.
-
C.
tăng 9 lần.
-
D.
giảm 3 lần.
Đáp án : A
Dựa vào công thức tính hệ số nhiệt độ Van’t Hoff.
\(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{(VT - 10)}}{{10}}}} = {3^1}\)
Tốc độ phản ứng tăng 3 lần
Đáp án A
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
Quan sát hiện tượng và trả lời câu hỏi:
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
(a) sai, vì diện tích tiếp xúc của đá vôi dạng viên ít hơn so với đập nhỏ
(b) đúng
(c) sai, diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm
(d) sai, phản ứng trên không phản ứng ứng oxi hóa khử vì không có sự trao đổi electron
Những câu sau đây là đúng hay sai:
a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) \({\Delta _r}H_{298}^o < 0\)
a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) \({\Delta _r}H_{298}^o < 0\)
(a) sai, điều kiện ứng với 1 bar (đối với chất lỏng)
(b) sai, Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất
(c) sai, xung quanh nóng hơn do phản ứng tỏa nhiệt
(d) đúng
Cho các phản ứng sau:
a) Trong phản ứng:
3CH3CH2OH + K2Cr2O7 + 4H2SO4 --> 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O
b) Trong phản ứng quang hợp:
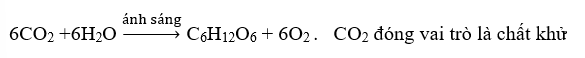
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
d) Quá trình khử là quá trình nhận electron
a) Trong phản ứng:
3CH3CH2OH + K2Cr2O7 + 4H2SO4 --> 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O
b) Trong phản ứng quang hợp:
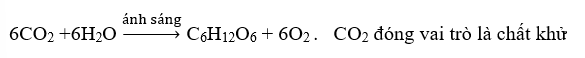
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
d) Quá trình khử là quá trình nhận electron
a) đúng
b) sai, CO2 đóng vai trò chất oxi hóa
c) sai, xảy ra cả quá trình oxi hóa và khử
d) đúng
Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau:
NaCl (aq) + H2O (l) \( \to \) A (aq) + X (g) + Y (g) (*)
a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)

Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel: NaCl và NaClO.
Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2.
- Vì A ở dạng dung dịch, Y ở dạng khí
⇒ A là dung dịch NaOH, Y là khí Cl2
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
a) Đúng, vì A là NaOH và Y là Cl2
b) đúng, vì X là H2
c) sai, X là H2
d) đúng
Biểu thức tốc độ phản ứng: \(\nu = k.{{\rm{[}}S{O_2}{\rm{]}}^2}{{\rm{[}}{{\rm{O}}_{\rm{2}}}{\rm{]}}^1}\)
Khi nồng độ của SO2 tăng 2 lần và oxygen tăng 3 thì tốc độ phản ứng tăng 12 lần
v 40 = v15 . 3,5(40 – 15)/10 = 4,6 (M/s)
1 phương trình phản ứng chứng tỏ Cl- có tính khử:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Xét phản ứng đốt cháy methane:
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch
Phát biểu nào sau đây không đúng khi nói về phản ứng của đơn chất nhóm VIIA với dung dịch muối halide?
Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối tạo ra trong dung dịch là
Thuốc tím chứa ion permanganate (MnO4-) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của manganse trong ion permanganate là gì?
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:
- Khái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |




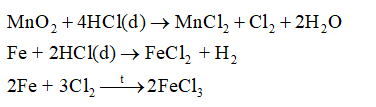






Danh sách bình luận