Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 8
Hạt mang điện trong hạt nhân nguyên tử là:
Đề bài
Hạt mang điện trong hạt nhân nguyên tử là:
-
A.
Electron.
-
B.
Proton.
-
C.
Neutron.
-
D.
Neutron và electron.
Cho các nguyên tử \({}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z.\)Những nguyên tử nào cùng thuộc một nguyên tố hóa học?
-
A.
X và Y.
-
B.
Y và Z.
-
C.
X và Z.
-
D.
X, Y và Z.
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitrogen là:
-
A.
14,7.
-
B.
14,0.
-
C.
14,4.
-
D.
13,7.
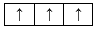
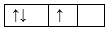
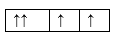
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.
-
B.
-
C.
-
D.
Một nguyên tố R có cấu hình electron: 1s22s22p63s23p4, công thức hợp chất của R với hydrogen và công thức oxide cao nhất là:
-
A.
RH2, RO.
-
B.
RH2, RO3.
-
C.
RH2, RO2.
-
D.
RH5, R2O5.
Cấu hình electron nào sau đây không phải của kim loại?
-
A.
1s22s22p63s23p63d64s2.
-
B.
1s22s22p63s23p5.
-
C.
1s22s22p63s2.
-
D.
1s22s22p63s23p1.
Ion nào sau đây không là ion đơn nguyên tử?
-
A.
Al3+.
-
B.
NO3-.
-
C.
Br -.
-
D.
Ca2+.
Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
-
A.
liên kết cộng hoá trị không phân cực.
-
B.
liên kết hydrogen.
-
C.
liên kết cộng hoá trị phân cực.
-
D.
liên kết ion.
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
-
A.
Ca.
-
B.
S.
-
C.
K.
-
D.
Cl.
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
-
A.
Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
-
B.
Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
-
C.
Hạt nhân của nguyên tố Ca có 20 proton.
-
D.
Nguyên tố Ca là một phi kim.
Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A trong bảng tuần hoàn là:
-
A.
Nhóm VA, chu kì 3.
-
B.
Nhóm VIIA, chu kì 2.
-
C.
Nhóm VIIB, chu kì 2
-
D.
Nhóm VIA, chu kì 3
Liên kết ion được tạo thành giữa?
-
A.
Hai nguyên tử kim loại.
-
B.
Hai nguyên tử phi kim.
-
C.
Một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình.
-
D.
Ba nguyên tử trở lên.
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết nào?
-
A.
Kim loại.
-
B.
Cộng hóa trị có cực.
-
C.
Ion.
-
D.
Cộng hóa trị không cực.
Công thức cấu tạo nào sau đây là công thức Lewis?
-
A.
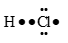
-
B.
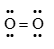
-
C.
-
D.
O=C=O
Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
-
A.
O2, H2O, NH3
-
B.
H2O, HCl, H2S
-
C.
HCl, N2, H2S
-
D.
HCl, Cl2, H2O
-
A.
liên kết cộng hóa trị có cực.
-
B.
liên kết ion.
-
C.
liên kết cho – nhận.
-
D.
liên kết hydrogen.
Cation M2+ có cấu hình electron 1s22s22p63s23p6. Cấu hình electron của nguyên tử M là?
-
A.
1s22s22p63s2
-
B.
1s22s22p63s23p64s2
-
C.
1s22s22p63s23p4
-
D.
1s22s22p63s23p2
Phân tử nào sau đây có chứa liên kết ba?
-
A.
N2
-
B.
NH3
-
C.
H2O
-
D.
C6H6
Cho nguyên tử sulfur (lưu huỳnh) có Z = 16 và N = 16.
a. Số khối của nguyên tử sulfur là 16.
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
Aluminium có rất nhiều ứng dụng trong cuộc sống. Aluminium được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,… đặc biệt dùng trong công nghệ sản xuất vỏ máy bay do nhẹ, bền. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tử Aluminium thuộc chu kì 3 và nhóm IIIA.
a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
b. Nguyên tử Aluminium có 3 lớp electron.
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8.
a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
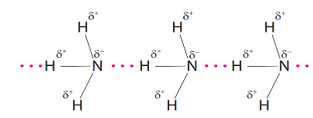
Ammonia là chất khí không màu có mùi khai là xốc. Ammonia là chất trung gian trong sản xuất phân bón. Công thức Lewis của Ammonia hình bên
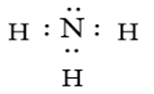
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
Trong sản xuất thịt chế biến sẵn, người ta thường bổ sung một hợp chất có công thức dạng X2Y để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư, tránh các trường hợp ngộ độc thực phẩm do thịt bị ôi thiu. Phân tử X2Y có tồng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Phần trăm khối lượng của Y trong oxide cao nhất của Y là bao nhiêu?
Đáp án:
Hợp chất X có công thức là A2B có tổng số hạt (p, n, e) là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử nguyên tố A có số proton nhiều hơn so với nguyên tử nguyên tố B là 3. Số hạt mang điện của nguyên tử A là ?
Đáp án:
Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là?
Đáp án:
Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết: Tổng số proton trong hợp chất bằng 46. Trong hạt nhân của M có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Trong hạt nhân của X có số hạt mang điện bằng số hạt không mang điện. Trong hợp chất M2X, nguyên tố X chiếm 17,02% về khối lượng. Liên kết M2X thuộc liên kết gì?
Đáp án:
Lời giải và đáp án
Hạt mang điện trong hạt nhân nguyên tử là:
-
A.
Electron.
-
B.
Proton.
-
C.
Neutron.
-
D.
Neutron và electron.
Đáp án : B
Dựa vào thành phần nguyên tử.
Hạt proton mang điện tích dương trong hạt nhân nguyên tử.
Đáp án B
Cho các nguyên tử \({}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z.\)Những nguyên tử nào cùng thuộc một nguyên tố hóa học?
-
A.
X và Y.
-
B.
Y và Z.
-
C.
X và Z.
-
D.
X, Y và Z.
Đáp án : C
Các nguyên tố hóa học có cùng số proton khác nhau neutron.
X và Z cùng có 6 proton nên thuộc cùng nguyên tố hóa học
Đáp án C
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitrogen là:
-
A.
14,7.
-
B.
14,0.
-
C.
14,4.
-
D.
13,7.
Đáp án : B
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar M_N} = \frac{{14.99,63 + 15.0,37}}{{100}} = 14\)
Đáp án B
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.
-
B.

-
C.

-
D.

Đáp án : B
Dựa vào sự phân bố electron theo ô orbital.
B đúng, vì cần đầy đủ electron vào ô orbital và mỗi orbital chứa tối đa 2 spin trái dấu.
Đáp án B
Một nguyên tố R có cấu hình electron: 1s22s22p63s23p4, công thức hợp chất của R với hydrogen và công thức oxide cao nhất là:
-
A.
RH2, RO.
-
B.
RH2, RO3.
-
C.
RH2, RO2.
-
D.
RH5, R2O5.
Đáp án : B
Dựa vào cấu hình electron của R.
Vì R có 6 electron lớp ngoài cùng nên công thức oxide cao nhất là RO3 và công thức với hydrogen là RH2
Đáp án B
Cấu hình electron nào sau đây không phải của kim loại?
-
A.
1s22s22p63s23p63d64s2.
-
B.
1s22s22p63s23p5.
-
C.
1s22s22p63s2.
-
D.
1s22s22p63s23p1.
Đáp án : B
Các nguyên tử kim loại có 1,2,3 số electron lớp ngoài cùng.
1s22s22p63s23p5 có 7 electron lớp ngoài cùng nên không thuộc nguyên tố kim loại.
Đáp án B
Ion nào sau đây không là ion đơn nguyên tử?
-
A.
Al3+.
-
B.
NO3-.
-
C.
Br -.
-
D.
Ca2+.
Đáp án : B
Dựa vào các ion.
Ion NO3- là ion đa nguyên tử.
Đáp án B
Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
-
A.
liên kết cộng hoá trị không phân cực.
-
B.
liên kết hydrogen.
-
C.
liên kết cộng hoá trị phân cực.
-
D.
liên kết ion.
Đáp án : A
Dựa vào hiệu độ âm điện.
Liên kết trong phân tử SO3 là liên kết cộng hóa trị không phân cực.
Đáp án A
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
-
A.
Ca.
-
B.
S.
-
C.
K.
-
D.
Cl.
Đáp án : C
Dựa vào thành phần nguyên tử
Ta có: p + n + e = 58
p + e – n = 18
và p = e
giải phương trình ta được: p = e = 19; n = 20.
X là K
Đáp án C
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
-
A.
Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
-
B.
Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
-
C.
Hạt nhân của nguyên tố Ca có 20 proton.
-
D.
Nguyên tố Ca là một phi kim.
Đáp án : D
Dựa vào vị trí của Ca.
D sai vì nguyên tố Ca là một kim loại.
Đáp án D
Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A trong bảng tuần hoàn là:
-
A.
Nhóm VA, chu kì 3.
-
B.
Nhóm VIIA, chu kì 2.
-
C.
Nhóm VIIB, chu kì 2
-
D.
Nhóm VIA, chu kì 3
Đáp án : B
Dựa vào vị trí của A trong bảng tuần hoàn.
Cấu hình của nguyên tố A là: 1s2 2s22p5
Vậy A ở chu kì 2, nhóm VIIA
Đáp án B
Liên kết ion được tạo thành giữa?
-
A.
Hai nguyên tử kim loại.
-
B.
Hai nguyên tử phi kim.
-
C.
Một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình.
-
D.
Ba nguyên tử trở lên.
Đáp án : C
Dựa vào khái niệm liên kết ion.
Liên kết ion được tạo thành giữa một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình.
Đáp án C
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết nào?
-
A.
Kim loại.
-
B.
Cộng hóa trị có cực.
-
C.
Ion.
-
D.
Cộng hóa trị không cực.
Đáp án : C
Xác định nguyên tử nguyên tố X, Y từ đó xác định liên kết.
X là kim loại K, Y là phi kim F.
Liên kết hóa học giữa nguyên tử K và nguyên tử F thuộc liên kết ion.
Đáp án C
Công thức cấu tạo nào sau đây là công thức Lewis?
-
A.
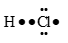
-
B.
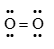
-
C.
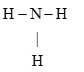
-
D.
O=C=O
Đáp án : B
Dựa vào công thức Lewis.
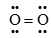
biểu diễn công thức Lewis của phân tử O2.
Đáp án B
Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
-
A.
O2, H2O, NH3
-
B.
H2O, HCl, H2S
-
C.
HCl, N2, H2S
-
D.
HCl, Cl2, H2O
Đáp án : B
Dựa vào liên kết cộng hóa trị phân cưc.
H2O, HCl, H2S chứa liên kết cộng hóa trị phân cực.
Đáp án B
-
A.
liên kết cộng hóa trị có cực.
-
B.
liên kết ion.
-
C.
liên kết cho – nhận.
-
D.
liên kết hydrogen.
Đáp án : D
Dựa vào khái niệm liên kết hydrogen.
Các đường nét đứt đại diện cho liên kết hydrogen hình thành giữa nguyên tử nitrogen và hydrogen.
Đáp án D
Cation M2+ có cấu hình electron 1s22s22p63s23p6. Cấu hình electron của nguyên tử M là?
-
A.
1s22s22p63s2
-
B.
1s22s22p63s23p64s2
-
C.
1s22s22p63s23p4
-
D.
1s22s22p63s23p2
Đáp án : B
Dựa vào cấu hình của M
M có khả năng nhường 2 electron để tạo thành cation M2+ nên cấu hình electron của nguyên tử M là: 1s22s22p63s23p64s2
Đáp án B
Phân tử nào sau đây có chứa liên kết ba?
-
A.
N2
-
B.
NH3
-
C.
H2O
-
D.
C6H6
Đáp án : A
Dựa vào cấu tạo của các nguyên tử, phân tử.
N2 chứa liên kết ba N≡N
Đáp án A
Cho nguyên tử sulfur (lưu huỳnh) có Z = 16 và N = 16.
a. Số khối của nguyên tử sulfur là 16.
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
a. Số khối của nguyên tử sulfur là 16.
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
Dựa vào vị trí của S trong bảng tuần hoàn.
a. sai, số khối của nguyên tử S là 32.
b. đúng
c. sai, nguyên tử sulfur có 9 ô orbital.
d. đúng
Aluminium có rất nhiều ứng dụng trong cuộc sống. Aluminium được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,… đặc biệt dùng trong công nghệ sản xuất vỏ máy bay do nhẹ, bền. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tử Aluminium thuộc chu kì 3 và nhóm IIIA.
a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
b. Nguyên tử Aluminium có 3 lớp electron.
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
b. Nguyên tử Aluminium có 3 lớp electron.
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
Dựa vào vị trí của Al trong bảng tuần hoàn.
a. đúng
b. đúng
c. sai, nguyên tố Al có tính kim loại yếu hơn nguyên tố Na
d. sai, Al2O3 là oxide lưỡng tính.
Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8.
a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
Dựa vào vị trí của X, Y trong bảng tuần hoàn.
a. sai, số electron hóa trị của Y là 6
b. đúng
c. sai, hợp chất tạo thành giữa X và Y là chất rắn tan tốt trong nước.
d. sai, nguyên tử X nhường 1 electron, nguyên tử Y nhận 2 electron
Ammonia là chất khí không màu có mùi khai là xốc. Ammonia là chất trung gian trong sản xuất phân bón. Công thức Lewis của Ammonia hình bên
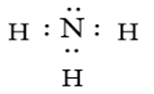
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
Dựa vào cấu tạo của ammonia.
a. sai, cặp electron dùng chung lệch về phía nguyên tử nitrogen.
b. đúng
c. đúng
d. sai, liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và s gọi là liên kết σ
Trong sản xuất thịt chế biến sẵn, người ta thường bổ sung một hợp chất có công thức dạng X2Y để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư, tránh các trường hợp ngộ độc thực phẩm do thịt bị ôi thiu. Phân tử X2Y có tồng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Phần trăm khối lượng của Y trong oxide cao nhất của Y là bao nhiêu?
Đáp án:
Đáp án:
Xác định X, Y dựa vào thành phần nguyên tử
Tổng proton X2Y là 2.PX + PY =23 (1)
2 nhóm A liên tiếp trong 1 chu kì, ta có PX – PY =1 (2) hoặc PY – PX =1 (3)
Từ (1) và (2) giải ra PX=8 (O), PY=7 (N). Công thức N2O5
\(\% {m_N} = \frac{{14.2}}{{14.2 + 16.5}}.100\% = 25,925\% \)
Từ (1) và (3) giải ra PX, Py lẻ (loại)
Hợp chất X có công thức là A2B có tổng số hạt (p, n, e) là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử nguyên tố A có số proton nhiều hơn so với nguyên tử nguyên tố B là 3. Số hạt mang điện của nguyên tử A là ?
Đáp án:
Đáp án:
Dựa vào thành phần nguyên tử
Gọi các hạt trong nguyên tử A là n1, e1, p1
Các hạt trong nguyên tử B là n2, e2, p2
Theo bài ra , ta có: 4p1 + 2n1 + 2p2 + n2 = 92
4p1 + 2p2 – 2n1 – n2 = 28
P1 – p2 = 3
Suy ra p1 = 11, p2 = 8
Vậy số hạt mang điện của A là 11+ 11 = 22
Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là?
Đáp án:
Đáp án:
Dựa vào khái niệm liên kết hydrogen.
H2O, NH3, C2H5OH chứa liên kết hydrogen.
Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết: Tổng số proton trong hợp chất bằng 46. Trong hạt nhân của M có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Trong hạt nhân của X có số hạt mang điện bằng số hạt không mang điện. Trong hợp chất M2X, nguyên tố X chiếm 17,02% về khối lượng. Liên kết M2X thuộc liên kết gì?
Đáp án:
Đáp án:
Dựa vào thành phần nguyên tử.
Ta có: 2.PM + PX = 46 (1)
2.NM – 2.PM = 1 (2)
PX = NX (3)
%X = \(\frac{{{P_X} + {N_X}}}{{2.({P_M} + {N_M}) + {P_X} + {N_X}}}.100 = 17.02\% \) (4)
Từ (1), (2), (3), (4) ta được PM = 19; PX = 8
Vậy M là K; X là O
Liên kết trong K2O là liên kết ion.
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Chu kì là
Nguyên tử chứa những hạt mang điện là
Trong hạt nhân nguyên tử có chứa những loại hạt nào?
Phát biểu nào sau đây không đúng?
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
Cho các nguyên tố X(Z=12), Y(Z=11), M(Z=14), N (Z=13). Tính kim loại được sắp xếp theo thứ tự giảm dần là:
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận