Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 4
Trong hạt nhân nguyên tử có chứa những loại hạt nào?
Đề bài
Trong hạt nhân nguyên tử có chứa những loại hạt nào?
-
A.
proton, neutron.
-
B.
electron, neutron.
-
C.
electron, proton.
-
D.
proton, neutron, electron.
Hạt nào sau đây mang điện tích âm?
-
A.
Proton.
-
B.
Hạt nhân.
-
C.
Electron.
-
D.
Neutron.
Khối lượng của một proton bằng
-
A.
0,00055 amu.
-
B.
0,1 amu.
-
C.
1 amu.
-
D.
0,0055 amu.
Nguyên tố hóa học là những nguyên tử có cùng
-
A.
số neutron.
-
B.
nguyên tử khối.
-
C.
số khối.
-
D.
số proton.
Số hiệu nguyên tử (Z) của nguyên tố hóa học không bằng giá trị nào sau đây?
-
A.
Số hạt proton.
-
B.
Số hạt electron.
-
C.
Số điện tích dương.
-
D.
Số hạt neutron.
Đồng vị là những nguyên tử có
-
A.
cùng số proton, khác số neutron.
-
B.
cùng số neutron.
-
C.
cùng số khối.
-
D.
cùng số proton, cùng số neutron.
Số electron tối đa trong lớp M là bao nhiêu?
-
A.
2.
-
B.
8.
-
C.
32.
-
D.
18.
Phân lớp nào sau đây kí hiệu sai?
-
A.
1s.
-
B.
3p.
-
C.
3d.
-
D.
2d.
Trong bảng tuần hoàn, số thứ tự của ô nguyên tố không được tính bằng
-
A.
số proton.
-
B.
số electron.
-
C.
số hiệu nguyên tử.
-
D.
số khối.
Một nguyên tử có chứa 8 proton trong hạt nhân. Số hiệu nguyên tử của nguyên tử này là
-
A.
8.
-
B.
9.
-
C.
16.
-
D.
4.
Nguyên tử X có chứa 7 proton và 8 neutron. Kí hiệu nguyên tử của X là
-
A.
\({}_7^8{\rm{X}}\).
-
B.
\({}_7^{15}{\rm{X}}\).
-
C.
\({}_8^7{\rm{X}}\).
-
D.
\({}_{15}^7{\rm{X}}\).
Cặp nguyên tử nào sau đây là đồng vị của nhau?
-
A.
\({}_6^{12}{\rm{X}},{}_5^{10}{\rm{Y}}\).
-
B.
\({}_1^1{\rm{M}},{}_2^4{\rm{G}}\).
-
C.
\({}_8^{16}{\rm{D}},{}_8^{17}{\rm{E}}\).
-
D.
\({}_9^{17}{\rm{L}},{}_1^3{\rm{T}}\).
Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì sẽ
-
A.
thu năng lượng.
-
B.
giải phóng năng lượng.
-
C.
không thay đổi năng lượng.
-
D.
vừa thu vừa giải phóng năng lượng.
Cấu hình electron nào sau đây là của nguyên tử Oxygen (Z = 8)?
-
A.
1s22s32p3.
-
B.
1s22s42p2.
-
C.
1s22s12p5.
-
D.
1s22s22p4.
Cấu hình orbital nào sau đây viết đúng?
-
A.
-
B.
-
C.
-
D.
Cho các cấu hình electron sau:
(1) 1s2. (2) 1s22s22p3. (3) 1s22s22p6.
(4) 1s22s22p63s23p1. (5) 1s22s22p63s2. (6) 1s22s22p63s23p64s1.
Có bao nhiêu cấu hình electron trong các cấu hình cho trên là của nguyên tử kim loại?
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử, gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
tương tác Van Der Waals.
-
D.
liên kết cho – nhận.
Trong dãy halogen, tương tác van der Waals (1) …… theo sự (2) …. của số electron (và proton) trong phân tử, làm (3) …. nhiệt độ nóng chảy, nhiệt độ sôi của các chất
-
A.
(1) tăng, (2) tăng, (3) tăng.
-
B.
(1) tăng, (2) giảm, (3) tăng.
-
C.
(1) giảm, (2) tăng, (3) giảm.
-
D.
(1) giảm, (2) tăng, (3) tăng.
Mức độ ảnh hưởng của tương tác van der Waals so với liên kết hydrogen
-
A.
yếu hơn.
-
B.
mạnh hơn.
-
C.
cân bằng.
-
D.
không so sánh được.
Mô tả sự hình thành ion của nguyên tử S (Z = 16) theo quy tắc octet là
-
A.
S + 2e \( \to \) S2−.
-
B.
S \( \to \) S2++ 2e.
-
C.
S \( \to \) S6++ 6e.
-
D.
S \( \to \) S2−+ 2e.
Lời giải và đáp án
Trong hạt nhân nguyên tử có chứa những loại hạt nào?
-
A.
proton, neutron.
-
B.
electron, neutron.
-
C.
electron, proton.
-
D.
proton, neutron, electron.
Đáp án : A
Dựa vào kiến thức về thành về cấu tạo nguyên tử
Hạt nhân nguyên tử chứa proton và neutron
Đáp án A
Hạt nào sau đây mang điện tích âm?
-
A.
Proton.
-
B.
Hạt nhân.
-
C.
Electron.
-
D.
Neutron.
Đáp án : C
Dựa vào kiến thức về thành phần cấu tạo nguyên tử
Hạt electron mang điện tích âm
Đáp án C
Khối lượng của một proton bằng
-
A.
0,00055 amu.
-
B.
0,1 amu.
-
C.
1 amu.
-
D.
0,0055 amu.
Đáp án : C
Dựa vào khối lượng của các hạt cấu tạo nên nguyên tử
mp = 1amu
đáp án C
Nguyên tố hóa học là những nguyên tử có cùng
-
A.
số neutron.
-
B.
nguyên tử khối.
-
C.
số khối.
-
D.
số proton.
Đáp án : D
Dựa vào khái niệm của nguyên tố hóa học
Nguyên tố hóa hộc là những nguyên tử có cùng số proton
Đáp án D
Số hiệu nguyên tử (Z) của nguyên tố hóa học không bằng giá trị nào sau đây?
-
A.
Số hạt proton.
-
B.
Số hạt electron.
-
C.
Số điện tích dương.
-
D.
Số hạt neutron.
Đáp án : D
Dựa vào: p = e = Z
Z không bằng số hạt neutron
Đáp án D
Đồng vị là những nguyên tử có
-
A.
cùng số proton, khác số neutron.
-
B.
cùng số neutron.
-
C.
cùng số khối.
-
D.
cùng số proton, cùng số neutron.
Đáp án : A
Dựa vào khái niệm về đồng vị
Đồng vị là những nguyên tử có cùng số proton khác số neutron
Đáp án A
Số electron tối đa trong lớp M là bao nhiêu?
-
A.
2.
-
B.
8.
-
C.
32.
-
D.
18.
Đáp án : D
Vỏ nguyên tử được chia thành các lớp K, L, M, N
Lớp M là lớp thứ 3 chứa tối đa 18 electron
Đáp án D
Phân lớp nào sau đây kí hiệu sai?
-
A.
1s.
-
B.
3p.
-
C.
3d.
-
D.
2d.
Đáp án : D
Trong các lớp được chia thành các phân lớp s, p, d, f
Lớp thứ 2 chứa 2 phân lớp s, p
Đáp án D
Trong bảng tuần hoàn, số thứ tự của ô nguyên tố không được tính bằng
-
A.
số proton.
-
B.
số electron.
-
C.
số hiệu nguyên tử.
-
D.
số khối.
Đáp án : D
Ô nguyên tố = số hiệu nguyên tử Z = số p = số e
Số thứ tự không bằng số khối
Đáp án D
Một nguyên tử có chứa 8 proton trong hạt nhân. Số hiệu nguyên tử của nguyên tử này là
-
A.
8.
-
B.
9.
-
C.
16.
-
D.
4.
Đáp án : A
Dựa vào số Z = số p = số e
Số hiệu nguyên tử = 8
Đáp án A
Nguyên tử X có chứa 7 proton và 8 neutron. Kí hiệu nguyên tử của X là
-
A.
\({}_7^8{\rm{X}}\).
-
B.
\({}_7^{15}{\rm{X}}\).
-
C.
\({}_8^7{\rm{X}}\).
-
D.
\({}_{15}^7{\rm{X}}\).
Đáp án : B
Dựa vào kí hiệu nguyên tử: \({}_Z^AX\)
Số khối của nguyên tử X = 7 + 8 = 15
Vì p = e = Z => Z = 7
Kí hiệu đúng là \({}_7^{15}{\rm{X}}\)
Đáp án B
Cặp nguyên tử nào sau đây là đồng vị của nhau?
-
A.
\({}_6^{12}{\rm{X}},{}_5^{10}{\rm{Y}}\).
-
B.
\({}_1^1{\rm{M}},{}_2^4{\rm{G}}\).
-
C.
\({}_8^{16}{\rm{D}},{}_8^{17}{\rm{E}}\).
-
D.
\({}_9^{17}{\rm{L}},{}_1^3{\rm{T}}\).
Đáp án : C
Đồng vị là những nguyên tố có cùng số proton khác nhau về số neutron
\({}_8^{16}{\rm{D}},{}_8^{17}{\rm{E}}\)có cùng số proton khác nhau về số neutron
Đáp án C
Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì sẽ
-
A.
thu năng lượng.
-
B.
giải phóng năng lượng.
-
C.
không thay đổi năng lượng.
-
D.
vừa thu vừa giải phóng năng lượng.
Đáp án : A
Theo Rutherford – Bohr, electron ở càng xa hạt nhân thì có năng lượng càng cao.
Nếu electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu năng lượng
Đáp án A
Cấu hình electron nào sau đây là của nguyên tử Oxygen (Z = 8)?
-
A.
1s22s32p3.
-
B.
1s22s42p2.
-
C.
1s22s12p5.
-
D.
1s22s22p4.
Đáp án : D
Dựa vào cách viết cấu hình của nguyên tử O
Vì O có Z = 8 => cấu hình electron của O là: 1s22s22p4
Đáp án D
Cấu hình orbital nào sau đây viết đúng?
-
A.
-
B.
-
C.
-
D.
Đáp án : B
Mỗi obital nguyên tử chứa tối đa 2 electron được kí hiệu bằng mũi tên ngược chiều. Khi điền electron vào obital nguyên tử cần tuân theo nguyên lí Pauli
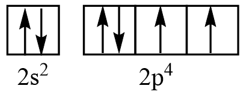
Đáp án B
Cho các cấu hình electron sau:
(1) 1s2. (2) 1s22s22p3. (3) 1s22s22p6.
(4) 1s22s22p63s23p1. (5) 1s22s22p63s2. (6) 1s22s22p63s23p64s1.
Có bao nhiêu cấu hình electron trong các cấu hình cho trên là của nguyên tử kim loại?
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Đáp án : B
Nguyên tử kim loại thường có 1, 2, 3 hoặc 4 electron lớp ngoài cùng
(1) là He => khí hiếm
(2) có 5e lớp ngoài cùng => phi kim
(3) có 8e lớp ngoài cùng => khí hiếm
(4) có 3e lớp ngoài cùng => kim loại
(5) có 2e lớp ngoài cùng => kim loại
(6) có 1e lớp ngoài cùng => kim loại
Đáp án B
Một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử, gọi là
-
A.
liên kết cộng hóa trị.
-
B.
liên kết ion.
-
C.
tương tác Van Der Waals.
-
D.
liên kết cho – nhận.
Đáp án : B
Dựa vào khái niệm về liên kết hóa học
Liên kết được hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử được gọi là liên kết ion
Đáp án B
Trong dãy halogen, tương tác van der Waals (1) …… theo sự (2) …. của số electron (và proton) trong phân tử, làm (3) …. nhiệt độ nóng chảy, nhiệt độ sôi của các chất
-
A.
(1) tăng, (2) tăng, (3) tăng.
-
B.
(1) tăng, (2) giảm, (3) tăng.
-
C.
(1) giảm, (2) tăng, (3) giảm.
-
D.
(1) giảm, (2) tăng, (3) tăng.
Đáp án : A
Trong dãy halogen, tương tác van der Waals tăng lên theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của của chất
Đáp án A
Mức độ ảnh hưởng của tương tác van der Waals so với liên kết hydrogen
-
A.
yếu hơn.
-
B.
mạnh hơn.
-
C.
cân bằng.
-
D.
không so sánh được.
Đáp án : A
Mức độ ảnh hưởng của tương tác van der Waals yếu hơn so với liên kết hydrogen
Đáp án A
Mô tả sự hình thành ion của nguyên tử S (Z = 16) theo quy tắc octet là
-
A.
S + 2e \( \to \) S2−.
-
B.
S \( \to \) S2++ 2e.
-
C.
S \( \to \) S6++ 6e.
-
D.
S \( \to \) S2−+ 2e.
Đáp án : A
Các nguyên tử nguyên tố có xu hướng nhường hoặc nhận electron để đạt cấu hình của khí hiếm (quy tắc octet)
S có 6 electron lớp ngoài cùng nên có xu hướng nhận thêm 2e để đạt 8e lớp ngoài cùng của khí hiếm
Đáp án A
a) Vì X và Y đứng kế tiếp nhau trong cùng một chu kì nên hạt nhân của chúng chỉ khác nhau 1 đơn vị
giả sử ZX < ZY => ZY = ZX + 1
Theo đề bài, ta có: ZX = ZY = ZX + ZX = 1 = 25 => ZX = 12 và ZY = 13
Cấu hình electron của X: 1s22s22p63s2 => X là Mg
Cấu hình electron của Y: ls22s22p63s23p1 => Y là Al
b) Đối với nguyên tử X:
+ X thuộc chu kì 3 vì có 3 lớp electron
+ X thuộc nhóm IIA vì có 2 electron ở lớp ngoài => X là kim loại
+ X thuộc ô thứ 12 vì (Z=12)
Đối với nguyên tử Y
+ Y thuộc chu kì 3 vì có 3 electron
+ Y thuộc nhóm IIIA vì có 3 electron ở lớp ngoài cùng => Y là kim loại
c) Công thức hợp chất oxit cao nhất của X, Y lần lượt là: MgO và Al2O3
A, M, X thuộc chu kì 3 nên n = 3
Cấu hình electron, vị trí và tên nguyên tố A: 1s22s22p63s1
=> A ở ô số 11, nhóm IA, A là kim loại Na
M: 1s22s22p63s23p1
=> M ở ô số 13, nhóm IIIA, M là kim loại Al
X: 1s22s22p63s23p5 => X ở ô số 17, nhóm VIIA, X là phi kim Cl
Nguyên tử chứa những hạt mang điện là
Chu kì là
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Phát biểu nào sau đây không đúng?
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
Cho các nguyên tố X(Z=12), Y(Z=11), M(Z=14), N (Z=13). Tính kim loại được sắp xếp theo thứ tự giảm dần là:
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận