Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 11
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
Đề bài
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
-
A.
Proton
-
B.
Electron
-
C.
Proton và neutron
-
D.
Neutron
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về
-
A.
số neutron
-
B.
số proton
-
C.
số electron
-
D.
điện tích hạt nhân.
Kí hiệu phân lớp electron nào sau đây sai?
-
A.
3s
-
B.
3p
-
C.
3d
-
D.
3f
-
A.
s
-
B.
px
-
C.
py
-
D.
pz
Cấu hình electron của nguyên tử Al (Z = 13) là
-
A.
1s22s22p63p3
-
B.
1s22s22p53s23p2
-
C.
1s22s22p62d3
-
D.
1s22s22p63s23p1
Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu sau:
(a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y.
(b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y
(c) X và Y đều là phi kim
(d) X thuộc chu kì IA, Y thuộc chu kì VA.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
-
A.
IA
-
B.
IIA
-
C.
VIIIA
-
D.
VIIA
Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
-
A.
Công thức oxide cao nhất của R là R2O5.
-
B.
R có tính phi kim mạnh hơn Si (Z = 14).
-
C.
R là nguyên tố p
-
D.
Nguyên tử R có 5 electron ở phân lớp ngoài cùng.
Biết rằng đường kính của nguyên tử gấp 10000 lần đường kính của hạt nhân. Nếu đường kính của nguyên tử khoảng 10 pm (picomet) thì đường kính của hạt nhân khoảng
-
A.
102 pm.
-
B.
10–4 pm.
-
C.
10–2 pm.
-
D.
10-3 pm
Nguyên tố magnesium có 2 đồng vị là \({}_{12}^{24}{\rm{Mg}}\)và \({}_{12}^{25}{\rm{Mg}}\). Tỉ lệ số nguyên tử của hai đồng vị là: \({}_{12}^{24}{\rm{Mg}}\): \({}_{12}^{25}{\rm{Mg}}\)= 3:2. Nguyên tử khối trung bình của magnesium là
-
A.
24,2
-
B.
24,4.
-
C.
25,3.
-
D.
26,5.
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.

-
B.
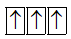
-
C.
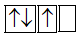
-
D.
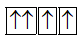
Hạt nhân nguyên tử Y có 3 hạt proton và 4 hạt neutron. Kí hiệu nguyên tử của Y là
-
A.
\(_4^7Y\)
-
B.
\(_7^4Y\)
-
C.
\(_3^7Y\)
-
D.
\(_7^3Y\)
Một nguyên tử X có tổng số hạt proton, neutron và electron là 34. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân nguyên tử X là bao nhiêu?
-
A.
+ 11
-
B.
-11
-
C.
12
-
D.
+23
-
A.
bằng nguyên tử khối.
-
B.
bằng tổng số các hạt proton và neutron.
-
C.
bằng tổng khối lượng các hạt proton và neutron.
-
D.
bằng tổng các hạt proton, neutron và electron.
Nguyên tử của nguyên tố hóa học X có cấu hình electron là [Ne]3s23p5. Nguyên tố X thuộc
-
A.
chu kì 3, nhóm VIIB
-
B.
chu kì 3, nhóm VA
-
C.
chu kì 3, nhóm VIIA.
-
D.
chu kì 3, nhóm IIA.
Có các nhận định sau:
a. Nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là kim loại.
b. Hạt nhân nguyên tử gồm hạt proton và electron.
c. Lớp K là lớp có mức năng lượng thấp nhất.
d. Ion X- có cấu hình e là 1s22s22p6. Vậy nguyên tố X là khí hiếm.
e. Nguyên tử khối của nguyên tố X là 17. Tính gần đúng thì khối lượng nguyên tử nguyên tố đó nặng gấp 17 lần đơn vị khối lượng.
Số nhận định đúng là:
-
A.
3
-
B.
5
-
C.
2
-
D.
1
Anion X2– có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron của X là
-
A.
1s22s22p63s23p4.
-
B.
1s22s22p63s23p64s2.
-
C.
1s22s22p4.
-
D.
1s22s22p63s23p6.
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.
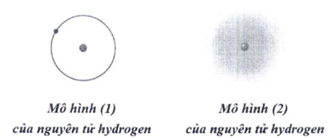
Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Trong tự nhiên, đồng có 2 đồng vị \(_{29}^{63}Cu\)và \(_{29}^{65}Cu\), nguyên tử khối trung bình của Cu là 63,54.
Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Có thể tạo được 4 loại CuX2 khác nhau.
Số neutron chênh lệch giữa 2 đồng vị là 4.
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32.
X thuộc họ p
Y có 6 electron hóa trị.
X, Y thuộc cùng một nhóm.
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
Cho các nhận định về orbital p như sau:
Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Lời giải và đáp án
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
-
A.
Proton
-
B.
Electron
-
C.
Proton và neutron
-
D.
Neutron
Đáp án : B
Dựa vào thành phần nguyên tử.
Vỏ nguyên tử chứa các hạt electron mang điện tích âm.
Đáp án B
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về
-
A.
số neutron
-
B.
số proton
-
C.
số electron
-
D.
điện tích hạt nhân.
Đáp án : A
Dựa vào khái niệm nguyên tố hóa học.
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về số neutron, có cùng số proton.
Đáp án A
Kí hiệu phân lớp electron nào sau đây sai?
-
A.
3s
-
B.
3p
-
C.
3d
-
D.
3f
Đáp án : D
Dựa vào lớp và phân lớp.
Phân lớp f xuất hiện từ lớp thứ tư.
Đáp án D
-
A.
s
-
B.
px
-
C.
py
-
D.
pz
Đáp án : A
Dựa vào hình dạng orbital.
Hình bên biểu diễn hình dạng s vì orbital s có dạng hình cầu.
Đáp án A
Cấu hình electron của nguyên tử Al (Z = 13) là
-
A.
1s22s22p63p3
-
B.
1s22s22p53s23p2
-
C.
1s22s22p62d3
-
D.
1s22s22p63s23p1
Đáp án : D
Dựa vào cấu hình electron.
Cấu hình electron của nguyên tử Al là: 1s22s22p63s23p1
Đáp án D
Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu sau:
(a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y.
(b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y
(c) X và Y đều là phi kim
(d) X thuộc chu kì IA, Y thuộc chu kì VA.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : A
Dựa vào cấu hình electron của X và Y.
X là kim loại potassium (K); Y là phi kim chlorine (Cl)
(a) đúng
(b) đúng
(c) sai, X là kim loại
(d) sai, Y thuộc chu kì VIIA.
Đáp án A
-
A.
1
-
B.
2
-
C.
3
-
D.
4
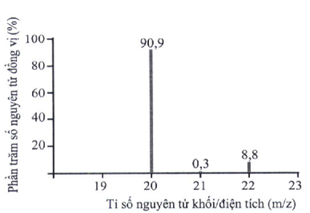
Đáp án : C
Dựa vào phổ khối lượng của Ne.
Có 3 đồng vị bền của Ne là: \(^{20}Ne{,^{21}}Ne{,^{22}}Ne\)
Đáp án C
Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
-
A.
IA
-
B.
IIA
-
C.
VIIIA
-
D.
VIIA
Đáp án : C
Dựa vào cấu tạo của bảng tuần hoàn.
Các nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn.
Đáp án C
Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
-
A.
Công thức oxide cao nhất của R là R2O5.
-
B.
R có tính phi kim mạnh hơn Si (Z = 14).
-
C.
R là nguyên tố p
-
D.
Nguyên tử R có 5 electron ở phân lớp ngoài cùng.
Đáp án : D
Dựa vào vị trí của R trong bảng tuần hoàn.
R là nguyên tố nitrogen (N) trong bảng tuần hoàn.
A. Đúng
B. Đúng, do N ở nhóm VA; Si ở nhóm IVA nên tính phi kim N mạnh hơn Si.
C. Đúng
D. Sai, do N có 3 electron phân lớp p ngoài cùng.
Đáp án D
Biết rằng đường kính của nguyên tử gấp 10000 lần đường kính của hạt nhân. Nếu đường kính của nguyên tử khoảng 10 pm (picomet) thì đường kính của hạt nhân khoảng
-
A.
102 pm.
-
B.
10–4 pm.
-
C.
10–2 pm.
-
D.
10-3 pm
Đáp án : D
Dựa vào kích thước hạt nhân nguyên tử.
Đường kính của hạt nhân khoảng: \(\frac{{10}}{{10000}} = {10^{ - 3}}pm\)
Đáp án D
Nguyên tố magnesium có 2 đồng vị là \({}_{12}^{24}{\rm{Mg}}\)và \({}_{12}^{25}{\rm{Mg}}\). Tỉ lệ số nguyên tử của hai đồng vị là: \({}_{12}^{24}{\rm{Mg}}\): \({}_{12}^{25}{\rm{Mg}}\)= 3:2. Nguyên tử khối trung bình của magnesium là
-
A.
24,2
-
B.
24,4.
-
C.
25,3.
-
D.
26,5.
Đáp án : B
Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố.
\({\bar M_{Mg}} = \frac{{24.3 + 25.2}}{5} = 24,4\)
Đáp án B
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.

-
B.
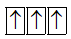
-
C.

-
D.

Đáp án : B
Dựa vào quy tắc Hunt.
B đúng vì cần điền các electron vào tất cả các ô orbital, và 1 ô chứa 2 spin ngược chiều.
Đáp án B
Hạt nhân nguyên tử Y có 3 hạt proton và 4 hạt neutron. Kí hiệu nguyên tử của Y là
-
A.
\(_4^7Y\)
-
B.
\(_7^4Y\)
-
C.
\(_3^7Y\)
-
D.
\(_7^3Y\)
Đáp án : C
Dựa vào kí hiệu nguyên tố.
Kí hiệu nguyên tử của Y là: \(_3^7Y\)
Đáp án C
Một nguyên tử X có tổng số hạt proton, neutron và electron là 34. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân nguyên tử X là bao nhiêu?
-
A.
+ 11
-
B.
-11
-
C.
12
-
D.
+23
Đáp án : A
Dựa vào thành phần nguyên tử.
Ta có: p + n + e = 34
p + e – n = 10
\( \to \) n = 12; p = e = 11
Điện tích hạt nhân nguyên tử X là +11.
Đáp án A
-
A.
bằng nguyên tử khối.
-
B.
bằng tổng số các hạt proton và neutron.
-
C.
bằng tổng khối lượng các hạt proton và neutron.
-
D.
bằng tổng các hạt proton, neutron và electron.
Đáp án : B
Dựa vào kiến thức về nguyên tố hóa học.
Trong nguyên tử, số khối bằng tổng các hạt proton và neutron.
Đáp án B
Nguyên tử của nguyên tố hóa học X có cấu hình electron là [Ne]3s23p5. Nguyên tố X thuộc
-
A.
chu kì 3, nhóm VIIB
-
B.
chu kì 3, nhóm VA
-
C.
chu kì 3, nhóm VIIA.
-
D.
chu kì 3, nhóm IIA.
Đáp án : C
Dựa vào cấu hình electron của X.
X có 7 electron lớp ngoài cùng nên thuộc nhóm IIA.
X có 3 lớp electron nên thuộc chu kì 3
Đáp án C
Có các nhận định sau:
a. Nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là kim loại.
b. Hạt nhân nguyên tử gồm hạt proton và electron.
c. Lớp K là lớp có mức năng lượng thấp nhất.
d. Ion X- có cấu hình e là 1s22s22p6. Vậy nguyên tố X là khí hiếm.
e. Nguyên tử khối của nguyên tố X là 17. Tính gần đúng thì khối lượng nguyên tử nguyên tố đó nặng gấp 17 lần đơn vị khối lượng.
Số nhận định đúng là:
-
A.
3
-
B.
5
-
C.
2
-
D.
1
Đáp án : C
Dựa vào cấu hình electron nguyên tử.
a. sai, nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là phi kim.
b. sai, hạt nhân nguyên tử gồm p và n.
c. đúng
d. sai, nguyên tố X là phi kim có cấu hình là 1s22s22p5
e. đúng
Đáp án C
Anion X2– có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron của X là
-
A.
1s22s22p63s23p4.
-
B.
1s22s22p63s23p64s2.
-
C.
1s22s22p4.
-
D.
1s22s22p63s23p6.
Đáp án : A
Nguyên tử nhận electron để trở thành anion.
Cấu hình electron của X là 1s22s22p63s23p4.
Đáp án A
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.

Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Dựa vào mô hình Rutherford – Bohr.
a. sai, mô hình (2) là mô hình hiện đại, mô hình (1) là hành tinh nguyên tử.
b. sai, khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hiện đại.
c. đúng
d. đúng
Trong tự nhiên, đồng có 2 đồng vị \(_{29}^{63}Cu\)và \(_{29}^{65}Cu\), nguyên tử khối trung bình của Cu là 63,54.
Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Có thể tạo được 4 loại CuX2 khác nhau.
Số neutron chênh lệch giữa 2 đồng vị là 4.
Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Có thể tạo được 4 loại CuX2 khác nhau.
Số neutron chênh lệch giữa 2 đồng vị là 4.
Dựa vào kiến thức về đồng vị.
Gọi % đồng vị \(_{29}^{63}Cu\)là a%, % đồng vị \(_{29}^{65}Cu\)là 100% - a%
Ta có: \({\bar M_{Cu}} = \frac{{a.63 + (100 - a).65}}{{100}} = 63,54 \to a = 73\% \)
a. Sai
b. đúng vì %\(_{29}^{63}Cu\)trong CuCl2 là: \(\frac{{73\% .63}}{{63,54 + 35,5.2}}.100 = 34,18\% \)
c. sai, có thể tạo ra 2 loại CuX2 là \(_{29}^{63}Cu\)X2 và \(_{29}^{65}Cu\)X2
d. sai, số neutron chênh lệch giữa 2 đồng vị là 2.
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32.
X thuộc họ p
Y có 6 electron hóa trị.
X, Y thuộc cùng một nhóm.
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
X thuộc họ p
Y có 6 electron hóa trị.
X, Y thuộc cùng một nhóm.
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
Dựa vào cấu hình electron X, Y.
Theo đề ra ta có: PX = EX = NX và PY = EY = NY
Trong hợp chất XY2, X chiếm 50% về khối lượng nên: \(\frac{{{M_{\rm{X}}}}}{{2{M_Y}}} = 1 \to {P_{\rm{X}}} + {N_{\rm{X}}} = 2{P_Y} + 2{N_Y} \to {P_X} = 2{P_Y}\)(1)
Tổng số proton trong phân tử XY2 là 32 nên PX + 2PY = 32 (2)
Từ (1) và (2) ta tìm được X là S và Y là O
Công thức XY2 là SO2
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4
a. đúng
b. đúng
c. đúng
d. sai, F có độ âm điện lớn nhất.
Cho các nhận định về orbital p như sau:
Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Dựa vào năng lượng orbital nguyên tử.
a. đúng. Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
b. đúng. Các obitan 2px, 2py, 2pz định hướng theo các trục x, y, z.
c. đúng. Các electron trên cùng một lớp có mức năng lượng xấp xỉ nhau.
d. sai. Năng lượng của các electron thuộc các obitan 2s và 2px là xấp xỉ nhau.
Dựa vào số hiệu nguyên tử.
Các nguyên tố kim loại có số hiệu nguyên tử là 13, 19, 20.
Đáp án 3
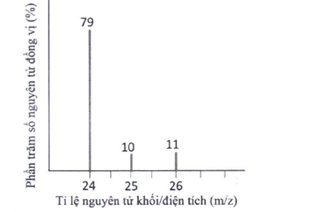
Dựa vào phổ khối của Mg.
\({\bar M_{Mg}} = \frac{{79.24 + 25.10 + 11.26}}{{100}} = 24,32\)
Đáp án 24,3
Dựa vào thành phần nguyên tử.
Ta có: P + E + N = 28
N – P = 1
P = E
Giải ra ta được: P = E = 9; N = 10
Nguyên tử khối của X là: 9 + 10 = 19
Đáp án 19.
Dựa vào công thức tính nguyên tử khối trung bình.
Nguyên tử khối trung bình của C là: \(\frac{{12.98,89 + 13.1,11}}{{100}} = 12,0111\)
%12C trong H2CO3 là: \(\frac{{12.98,89\% }}{{2 + 12,0111 + 16.3}}.100 = 19,14\% \)
Đáp án 19,14
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
Nếu hình dung nguyên tử như một khối cầu
I. Trắc nghiệm
I. Trắc nghiệm
Câu 1: Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng
Câu 1: Hoà tan 6 gam kim loại X (hoá trị II) tác dụng vừa đủ 3,7185 lít khí Cl2 (ở 25oC, 1 bar). Kim loại X là A. Ca. B. Zn. C. Ba. D. Mg.
Câu 1: Nguyên tử X có cấu hình electron [Ar]3d84s2. Vị trí của X trong bảng hệ thống tuần hoàn là A. số thứ tự 30, chu kì 4, nhóm IIA. B. số thứ tự 28, chu kì 4, nhóm VIIIA. C. số thứ tự 28, chu kì 4, nhóm VIIIB. D. số thứ tự 30, chu kì 4, nhóm VIIIB
Câu 1: Phát biểu nào sau đây không đúng? A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử. B. Số khối của hạt nhân bằng tổng số proton và số neutron.
Orbital nguyên tử là A. đám mây chứa electron có dạng hình cầu. B. đám mây chứa electron có dạng hình số 8 nổi
Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 3e. Vậy số hiệu nguyên tử của nguyên tố R là. Khi cho 3,36 g một kim loại thuộc phân nhóm chính nhóm I tác dụng với nước thì có 0,48 g khí H2 thoát ra. Vậy kim loại trên là
Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?Nguyên tử nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không mang điện là 22 hạt. Số khối A của nguyên tử X là
Theo chiều tăng của điện tích hạt nhân, độ âm điện của các nguyên tố trong cùng một chu kì: Các nguyên tố thuộc cùng nhóm IIIA thì nguyên tử của chúng đều có
Phân lớp d có tối đa bao nhiêu electron Cho cấu hình electron nguyên tử các nguyên tố: Be (1s22s2), Mg (1s22s22p63s2), C (1s22s22p2). Nguyên tố nào cùng thuộc chu kì 2?
Cho ba nguyên tố M, N và P có số hiệu nguyên tử lần lượt là 11 và 13, 15. Dựa vào đặc điểm cấu hình electron trong nguyên tử, khẳng định nào sau đây là đúng? Trong nguyên tử, hạt mang điện là
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận