Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 5
Nguyên tử chứa những hạt mang điện là
Đề bài
Nguyên tử chứa những hạt mang điện là
-
A.
proton và electron.
-
B.
proton neutron và electron.
-
C.
proton và neutron.
-
D.
electron và neutron.
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
-
A.
Neutron, m \( \approx \) 1 amu, q = 0.
-
B.
Proton, m \( \approx \) 0,00055 amu, q = +1.
-
C.
Electron, m \( \approx \) 1 amu, q = -1.
-
D.
Proton, m \( \approx \) 1 amu, q = -1.
Mệnh đề nào sau đây không đúng?
-
A.
Trong chu kì, các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
-
B.
Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau.
-
C.
Nguyên tử của các nguyên tố trong cùng phân nhóm bao giờ cũng có cùng số electron hóa trị.
-
D.
Trong chu kì, các nguyên tố được sắp xếp theo chiều khối lượng nguyên tử tăng dần.
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6. Cấu hình electron của nguyên tử X là:
-
A.
1s22s22p2
-
B.
1s22s22p63s2
-
C.
1s22s22p4
-
D.
1s22s22p5
Trong một nhóm A theo chiều tăng của điện tích hạt nhân
-
A.
Tính kim loại giảm dần, nên tính base của các oxide và hydroxide của kim loại tăng dần
-
B.
Tính phi kim tăng dần, nên tính aicd của các oxide và hydroxide của phi kim tăng dần
-
C.
Tính kim loại tăng, nên tính base của các oxide và hydroxide của kim loại
-
D.
Tính phi kim giảm, nên tính acid của các oxide và hydroxide của phi kim tăng dần
Nhóm các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
-
A.
\({}_8^{16}M\); \({}_8^{17}Z\).
-
B.
\({}_8^{16}N\);\({}_{11}^{22}T\).
-
C.
\({}_{11}^{22}D;{}_{10}^{22}Q\)
-
D.
\({}_7^{14}X\); \({}_8^{16}Y\).
Dãy nào sau đây sắp xếp theo thứ tự tăng dần tính acid ?
-
A.
Cl2O7; Al2O3; SO3; P2O5
-
B.
Al2O3; P2O5; SO3; Cl2O7
-
C.
P2O5; SO3; Al2O3; Cl2O7
-
D.
Al2O3; SO3; P2O5; Cl2O7
Sự chuyển động của electron theo quan điểm hiện đại được mô tả
-
A.
Electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
-
B.
Chuyển động của electron trong nguyên tử theo một quỹ đạo nhất định hình tròn hay hình bầu dục.
-
C.
Electron chuyển động cạnh hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
-
D.
Electron chuyển động rất chậm gần hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
Nguyên tố R có Z = 16, hợp chất khí của nó với hydrogen có công thức hóa học dạng:
-
A.
HX
-
B.
H2X
-
C.
H3X
-
D.
H4X
Mỗi orbital nguyên tử chứa tối đa
-
A.
2 electron.
-
B.
1 electron.
-
C.
3 electron.
-
D.
4 electron.
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.
-
B.
-
C.
-
D.
Hợp chất nào dưới đây chỉ có liên kết cộng hóa trị trong phân tử?
-
A.
Na2SO4.
-
B.
HClO.
-
C.
KNO3.
-
D.
NH4Cl.
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
-
A.
cộng hóa trị không cực.
-
B.
ion yếu.
-
C.
ion mạnh.
-
D.
cộng hóa trị phân cực.
Theo qui tắc octet thì công thức cấu tạo của phân tử SO2 là:
-
A.
O – S – O.
-
B.
O = S → O.
-
C.
O = S = O.
-
D.
O ← S → O.
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H(2,20); Na(0,93); Hợp chất nào sau đây là hợp chất ion:
-
A.
NaF.
-
B.
CH4.
-
C.
H2O.
-
D.
CO2.
Công thức Lewis của CS2 là
-
A.
-
B.
-
C.
-
D.
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là:
-
A.
1,3,5,7.
-
B.
2,4,6,8.
-
C.
2,6,10,14.
-
D.
1,2,3,4.
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
-
A.
chu kì 4, nhóm VIIIB.
-
B.
chu kì 4, nhóm VIB.
-
C.
chu kì 3, nhóm IIIA.
-
D.
chu kì 3, nhóm VIA.
Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
-
A.
Kích thước hạt nhân rất nhỏ so với nguyên tử.
-
B.
Hạt nhân có kích thước bằng một nửa nguyên tử.
-
C.
Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử.
-
D.
Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử.
Cho các nguyên tử sau: \({}_{{\rm{13}}}^{{\rm{26}}}{\rm{X}}\), \({}_{{\rm{12}}}^{{\rm{26}}}{\rm{Y}}\), \({}_{{\rm{13}}}^{{\rm{27}}}{\rm{Z}}\), \({}_{{\rm{13}}}^{{\rm{28}}}{\rm{T}}\). Phát biểu đúng là:
-
A.
X, Z và T là các đồng vị của nhau.
-
B.
X và Y là hai đồng vị của nhau.
-
C.
Y và Z là hai đồng vị của nhau.
-
D.
Y, Z, T đều có cùng số neutron.
Trong nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu hạt nhân nguyên tử X là:
-
A.
\({}_{{\rm{92}}}^{{\rm{235}}}{\rm{X}}\).
-
B.
\({}_{{\rm{143}}}^{{\rm{235}}}{\rm{X}}\).
-
C.
\({}_{{\rm{92}}}^{{\rm{143}}}{\rm{X}}\).
-
D.
\({}_{{\rm{235}}}^{{\rm{92}}}{\rm{X}}\).
Copper có hai đồng vị \({}_{29}^{63}Cu\) (Chiếm 73%) và \({}_{29}^{65}Cu\) (Chiếm 27%). Nguyên tử khối trung bình của Copper là:
-
A.
63,54.
-
B.
64,0.
-
C.
64,46.
-
D.
63,45.
Nếu orbital chứa 2 electron (hai mũi tên ngược chiều nhau) thì electron đó gọi là
-
A.
electron ghép đôi.
-
B.
electron độc thân.
-
C.
orbital trống.
-
D.
orbital s.
Liên kết hydrogen là
-
A.
liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
-
B.
liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
-
C.
liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
-
D.
liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Lớp M (n=3) có số electron tối đa là
-
A.
18.
-
B.
8.
-
C.
9.
-
D.
32.
Lời giải và đáp án
Nguyên tử chứa những hạt mang điện là
-
A.
proton và electron.
-
B.
proton neutron và electron.
-
C.
proton và neutron.
-
D.
electron và neutron.
Đáp án : A
Dựa vào kiến thức về thành phần cấu tạo nguyên tử
Nguyên tử chứa hạt proton mang điện tích dương, hạt electron mang điện tích âm
Đáp án A
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
-
A.
Neutron, m \( \approx \) 1 amu, q = 0.
-
B.
Proton, m \( \approx \) 0,00055 amu, q = +1.
-
C.
Electron, m \( \approx \) 1 amu, q = -1.
-
D.
Proton, m \( \approx \) 1 amu, q = -1.
Đáp án : A
Dựa vào khối lượng và điện tích của các hạt cấu tạo nên nguyên tử
Neutron, m \( \approx \) 1 amu, q = 0.
Proton, m \( \approx \) 1 amu, q = +1.
Electron, m \( \approx \) 0,00055 amu, q = -1.
Đáp án A
Mệnh đề nào sau đây không đúng?
-
A.
Trong chu kì, các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
-
B.
Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau.
-
C.
Nguyên tử của các nguyên tố trong cùng phân nhóm bao giờ cũng có cùng số electron hóa trị.
-
D.
Trong chu kì, các nguyên tố được sắp xếp theo chiều khối lượng nguyên tử tăng dần.
Đáp án : D
Dựa vào nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân
Đáp án D
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6. Cấu hình electron của nguyên tử X là:
-
A.
1s22s22p2
-
B.
1s22s22p63s2
-
C.
1s22s22p4
-
D.
1s22s22p5
Đáp án : B
Các nguyên tử có xu hướng cho hoặc nhận electron để đạt cấu hình electron của khí hiếm
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6 vì X2+ đã nhường đi 2 electron nên cấu hình lớp vỏ của X là 3s2
Đáp án B
Trong một nhóm A theo chiều tăng của điện tích hạt nhân
-
A.
Tính kim loại giảm dần, nên tính base của các oxide và hydroxide của kim loại tăng dần
-
B.
Tính phi kim tăng dần, nên tính aicd của các oxide và hydroxide của phi kim tăng dần
-
C.
Tính kim loại tăng, nên tính base của các oxide và hydroxide của kim loại
-
D.
Tính phi kim giảm, nên tính acid của các oxide và hydroxide của phi kim tăng dần
Đáp án : B
Dựa vào xu hướng biến đổi của các nguyên tố và hợp chất trong bảng tuần hoàn
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân tính kim loại giảm dần nên tính base của các oxide giảm dần, ngược lại tính phi kim tăng dần nên tính acid của các oxide tăng dần
Đáp án B
Nhóm các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
-
A.
\({}_8^{16}M\); \({}_8^{17}Z\).
-
B.
\({}_8^{16}N\);\({}_{11}^{22}T\).
-
C.
\({}_{11}^{22}D;{}_{10}^{22}Q\)
-
D.
\({}_7^{14}X\); \({}_8^{16}Y\).
Đáp án : A
Các nguyên tử của cùng một nguyên tố có cùng số proton
\({}_8^{16}M\); \({}_8^{17}Z\) có cùng số proton => thuộc cùng một nguyên tố hóa học
Đáp án A
Dãy nào sau đây sắp xếp theo thứ tự tăng dần tính acid ?
-
A.
Cl2O7; Al2O3; SO3; P2O5
-
B.
Al2O3; P2O5; SO3; Cl2O7
-
C.
P2O5; SO3; Al2O3; Cl2O7
-
D.
Al2O3; SO3; P2O5; Cl2O7
Đáp án : B
Trong cùng một chu kì, tính acid tăng dần
Al2O3; P2O5; SO3; Cl2O7 tăng dần tính acid
Đáp án B
Sự chuyển động của electron theo quan điểm hiện đại được mô tả
-
A.
Electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
-
B.
Chuyển động của electron trong nguyên tử theo một quỹ đạo nhất định hình tròn hay hình bầu dục.
-
C.
Electron chuyển động cạnh hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
-
D.
Electron chuyển động rất chậm gần hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
Đáp án : A
Dựa vào sự chuyển động của electron theo quan điểm hiện đại
Theo quan điểm hiện đại electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử
Đáp án A
Nguyên tố R có Z = 16, hợp chất khí của nó với hydrogen có công thức hóa học dạng:
-
A.
HX
-
B.
H2X
-
C.
H3X
-
D.
H4X
Đáp án : B
Xác định nguyên tố R trong bảng tuần hoàn
Nguyên tố R có Z = 16 => R là sulfur thuộc chu kì 3 nhòm VIA nên hóa trị với oxygen là 6 và hydrogen là 2
Đáp án B
Mỗi orbital nguyên tử chứa tối đa
-
A.
2 electron.
-
B.
1 electron.
-
C.
3 electron.
-
D.
4 electron.
Đáp án : A
Mỗi orbital nguyên tử chứa tối đa 2 electron
Đáp án A
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
-
A.
-
B.
-
C.
-
D.
Đáp án : B
Dựa vào sự phân bố electron theo ô orbital theo thuyết Pauli
Đáp án B
Hợp chất nào dưới đây chỉ có liên kết cộng hóa trị trong phân tử?
-
A.
Na2SO4.
-
B.
HClO.
-
C.
KNO3.
-
D.
NH4Cl.
Đáp án : B
Dựa vào phân loại của liên kết hóa học
Liên kết hóa trị thường là liên kết giữa các phi kim
HClO chứa liên kết cộng hóa trị trong phân tử
Đáp án B
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
-
A.
cộng hóa trị không cực.
-
B.
ion yếu.
-
C.
ion mạnh.
-
D.
cộng hóa trị phân cực.
Đáp án : A
Dựa vào phân loại của liên kết hóa học
Liên kết hóa trị thường là liên kết giữa các phi kim
N2 chứa liên kết cộng hóa trị trong phân tử
Đáp án A
Theo qui tắc octet thì công thức cấu tạo của phân tử SO2 là:
-
A.
O – S – O.
-
B.
O = S → O.
-
C.
O = S = O.
-
D.
O ← S → O.
Đáp án : B
Dựa vào quy tắc octet
SO2 có công thức cấu tạo: O = S → O.
Đáp án B
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H(2,20); Na(0,93); Hợp chất nào sau đây là hợp chất ion:
-
A.
NaF.
-
B.
CH4.
-
C.
H2O.
-
D.
CO2.
Đáp án : A
Liên kết ion có hiệu độ âm điện \( \ge 1,7\)
NaF có hiệu độ âm điện = 3,05 > 1,7 => chứa liên kết ion
Đáp án A
Công thức Lewis của CS2 là
-
A.
-
B.
-
C.
-
D.
Đáp án : B
Công thức Lewis biểu thị các liên kết của các nguyên tử và electron chưa liên kết của các nguyên tử
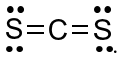
Đáp án B
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là:
-
A.
1,3,5,7.
-
B.
2,4,6,8.
-
C.
2,6,10,14.
-
D.
1,2,3,4.
Đáp án : C
Dựa vào số electron trong các phân lớp
Số electron tối đa trên phân lớp s, p, d, f lần lượt là: 2, 6, 10, 14
Đáp án C
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
-
A.
chu kì 4, nhóm VIIIB.
-
B.
chu kì 4, nhóm VIB.
-
C.
chu kì 3, nhóm IIIA.
-
D.
chu kì 3, nhóm VIA.
Đáp án : B
2Z + N = 73 + 3 và 2Z – N = 17 + 3 => Z = 24; N = 28
Cấu hình electron M: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 => chu kì 4, nhóm VIB
Đáp án B
Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
-
A.
Kích thước hạt nhân rất nhỏ so với nguyên tử.
-
B.
Hạt nhân có kích thước bằng một nửa nguyên tử.
-
C.
Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử.
-
D.
Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử.
Đáp án : C
Kích thước của hạt nhân gần bằng kích thước của nguyên tử vì khối lượng electron rất nhỏ xấp xỉ bằng 0
Đáp án C
Cho các nguyên tử sau: \({}_{{\rm{13}}}^{{\rm{26}}}{\rm{X}}\), \({}_{{\rm{12}}}^{{\rm{26}}}{\rm{Y}}\), \({}_{{\rm{13}}}^{{\rm{27}}}{\rm{Z}}\), \({}_{{\rm{13}}}^{{\rm{28}}}{\rm{T}}\). Phát biểu đúng là:
-
A.
X, Z và T là các đồng vị của nhau.
-
B.
X và Y là hai đồng vị của nhau.
-
C.
Y và Z là hai đồng vị của nhau.
-
D.
Y, Z, T đều có cùng số neutron.
Đáp án : A
Đồng vị là tập hợp các nguyên tử có cùng số proton
X, Z, T có cùng số proton
Đáp án A
Trong nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu hạt nhân nguyên tử X là:
-
A.
\({}_{{\rm{92}}}^{{\rm{235}}}{\rm{X}}\).
-
B.
\({}_{{\rm{143}}}^{{\rm{235}}}{\rm{X}}\).
-
C.
\({}_{{\rm{92}}}^{{\rm{143}}}{\rm{X}}\).
-
D.
\({}_{{\rm{235}}}^{{\rm{92}}}{\rm{X}}\).
Đáp án : A
Dựa vào kí hiệu của nguyên tố: \({}_Z^AX\)
Số khối A = P + N = 92 + 143 = 235
Đáp án A
Copper có hai đồng vị \({}_{29}^{63}Cu\) (Chiếm 73%) và \({}_{29}^{65}Cu\) (Chiếm 27%). Nguyên tử khối trung bình của Copper là:
-
A.
63,54.
-
B.
64,0.
-
C.
64,46.
-
D.
63,45.
Đáp án : A
Dựa vào công thức tính nguyên tử khối trung bình
\(\bar M\)= 63.73% + 65.27% = 63,54amu
Đáp án A
Nếu orbital chứa 2 electron (hai mũi tên ngược chiều nhau) thì electron đó gọi là
-
A.
electron ghép đôi.
-
B.
electron độc thân.
-
C.
orbital trống.
-
D.
orbital s.
Đáp án : A
2 electron trong orbital được gọi là electron ghép đôi
Đáp án A
Liên kết hydrogen là
-
A.
liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
-
B.
liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
-
C.
liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
-
D.
liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Đáp án : D
Dựa vào khái niệm của liên kết hydrogen
Liên kết hydrogen là liên kết được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Đáp án D
Lớp M (n=3) có số electron tối đa là
-
A.
18.
-
B.
8.
-
C.
9.
-
D.
32.
Đáp án : A
Dựa vào số electron trong các lớp
Lớp M có tối đa 18 electron
Đáp án A
Chu kì là
Nguyên tố R ở nhóm A, nguyên tử R có phân lớp electron ngoài cùng là 4s1.
Hạt mang điện trong hạt nhân nguyên tử là:
Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường
Trong hạt nhân nguyên tử có chứa những loại hạt nào?
Phát biểu nào sau đây không đúng?
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
Cho các nguyên tố X(Z=12), Y(Z=11), M(Z=14), N (Z=13). Tính kim loại được sắp xếp theo thứ tự giảm dần là:
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận