30 câu hỏi lý thuyết về hidro clorua - axit clohidric - muối clorua có lời giải (phần 2)
Làm đề thiCâu hỏi 1 :
Cho các phản ứng:
(1) 2HCl + Fe -> FeCl2 + H2.
(2) HCl + NaOH -> NaCl + H2O.
(3) 4HCl + MnO2 -> MnCl2 + Cl2 + 2H2O.
(4) 2HCl + Na2CO3 -> 2NaCl + CO2 + H2O.
Số phản ứng axit clohidric (HCl) thể hiện tính khử là:
- A 1
- B 2
- C 3
- D 4
Đáp án: A
Phương pháp giải:
Chất khử là chất nhường electron => số oxi hóa tăng
H đạt số oxi hóa cao nhất nên không còn khả năng nhường e
=> Cl nhường e để lên mức oxi hóa cao hơn
Xác định số oxi hóa của Cl trước và sau phản ứng từ đó chọn ra phản ứng mà HCl thể hiện tính khử.
Lời giải chi tiết:
(1) Số oxi hóa của Cl không đổi (-1)
(2) Số oxi hóa của Cl không đổi (-1)
(3) Cl- → Cl0 ( có sự tăng số oxi hóa)
(4) Số oxi hóa của Cl không đổi (-1)
Đáp án A
Câu hỏi 2 :
Cho các chất: Cu, NaOH, Fe2O3, MnO2 và Fe lần lượt tác dụng với HCl. Số phản ứng hoá học xảy ra là:
- A 2
- B 3
- C 4
- D 5
Đáp án: C
Phương pháp giải:
Dựa vào tính chất hóa học của HCl
Lời giải chi tiết:
Các chất phản ứng: NaOH; Fe2O3; MnO2; Fe
NaOH + HCl → NaCl + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
MnO2 + 2HCl(đặc,nóng) → MnCl2 + Cl2 + 2H2O
Fe + 2HCl → FeCl2 + H2
Đáp án C
Câu hỏi 3 :
Phương trình điều chế HCl trong phòng thí nghiệm là:
- A H2 + Cl2 -> HCl.
- B NaCl + H2SO4 -> NaHSO4 + HCl.
- C NaCl + H2O -> NaOH + HCl.
- D BaCl2 + H2SO4 -> BaSO4 + HCl.
Đáp án: B
Phương pháp giải:
Dựa vào phương pháp điều chế HCl.
Lời giải chi tiết:
Trong phòng thí nghiệm, người ta điều chế HCl bằng phương pháp cho NaCl tinh thể phản ứng với H2SO4 đặc, nóng:
NaCltt + H2SO4 đ,n→ NaHSO4 + HCl.
Đáp án B
Câu hỏi 4 :
Kim loại nào sau đây tác dụng với dung dịch HCl loãng và tác dụng với khí Cl2 cho cùng loại muối clorua kim loại?
- A Fe.
- B Cu
- C Zn
- D Ag
Đáp án: C
Phương pháp giải:
Tính chất hóa học của Clo
Lời giải chi tiết:
- Ag, Cu không phản ứng được với HCl => Loại
- Fe phản ứng: Fe + 2HCl → FeCl2 + H2
Fe + 1,5Cl2 \(\buildrel {{t^0}} \over\longrightarrow \)FeCl3
Vậy Fe cho 2 loại muối clorua khác nhau => Loại
- Zn: Zn + 2HCl → ZnCl2 + H2
Zn + Cl2 \(\buildrel {{t^0}} \over\longrightarrow \)ZnCl2
Vậy Zn phản ứng với Cl2 và HCl đều cho ZnCl2 thỏa mãn đề bài.
Đáp án C
Câu hỏi 5 :
Axit clohiđric tác dụng được với tất cả các chất nào sau đây ?
- A Na2CO3 , Ca, AgNO3,CuO
- B H2, Na, MnO2, Cu
- C BaO, Fe, NH3 , AgCl
- D HBr, CaCO3, NaBr, NaNO3
Đáp án: A
Phương pháp giải:
Tính chất hóa học của HCl
Lời giải chi tiết:
A đúng
B loại Cu
C loại AgCl
D loại HBr, NaBr, NaNO3
Đáp án A
Câu hỏi 6 :
Trong thí nghiệm thử tính tan của khí hidroclorua trong nước như hình bên, nhận xét nào sau đây không đúng
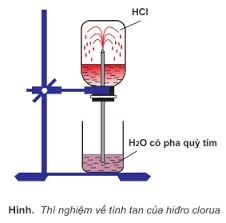
- A Có các tia nước màu hồng phun mạnh vào bình
- B Áp suất khí trong bình HCl giảm
- C Nếu thay khí HCl bằng khí CO2 thì không có tia nước phun vào bình
- D Nếu thay dung dịch quỳ tím bằng dung dịch phenolphtalein thì không có tia nước phun vào bình
Đáp án: D
Phương pháp giải:
Quan sát hình vẽ nhận xét sự tự phun HCl vào bình
Lời giải chi tiết:
A đúng vì HCl làm quỳ chuyển hồng
B đúng
C đúng vì CO2 tan ít trong nước
D sai vì phenolphthalein chỉ là chất chỉ thị màu, HCl vẫn tan tốt trong nước → phun mạnh vào bình
Đáp án D
Câu hỏi 7 :
Công thức hóa học của clorua vôi là:
- A CaCl2.
- B Ca(ClO)2.
- C CaOCl2.
- D Ca(ClO2)2.
Đáp án: C
Câu hỏi 8 :
Nước Javen là dung dịch chứa hỗn hợp:
- A NaCl và NaClO.
- B NaCl và NaClO3.
- C NaOH và NaClO.
- D NaOH và NaClO3.
Đáp án: A
Câu hỏi 9 :
Trong công nghiệp, HCl được tổng hợp từ
- A H2 và Cl2.
- B H2 và không khí.
- C Cl2 và không khí.
- D NaCl và H2SO4.
Đáp án: A
Lời giải chi tiết:
Trong công nghiệp, HCl được tổng hợp từ H2 và Cl2: H2 + Cl2 → 2HCl
Đáp án A
Câu hỏi 10 :
Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
- A MgCO3, NaOH, CuO.
- B AgNO3, (NH4)2CO3, CuS.
- C KNO3, CaCO3, Fe(OH)3.
- D FeS, BaSO4, KOH.
Đáp án: A
Lời giải chi tiết:
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
NaOH + HCl → NaCl + H2O
CuO + 2HCl → CuCl2 + H2O
Đáp án A
Câu hỏi 11 :
Khi cho axit sunfuric đặc tác dụng với NaCl (rắn) thì khí sinh ra là gì?
- A SO2.
- B H2S.
- C Cl2.
- D HCl.
Đáp án: D
Lời giải chi tiết:
NaClrắn + H2SO4 đặc → NaHSO4 + HClkhí
Đáp án D
Câu hỏi 12 :
Nước Gia-ven có tính chất sát trùng và tẩy màu là do
- A nguyên tử Cl trong NaClO có số oxi hóa +1 thể hiện tính oxi hóa mạnh.
- B NaClO phân hủy ra oxi nguyên tử có tính oxi hóa mạnh.
- C NaClO phân hủy ra Cl2 có tính oxi hóa mạnh.
- D NaCl trong nước Gia-ven có tính tẩy màu và sát trùng.
Đáp án: A
Lời giải chi tiết:
Nước Gia-ven gồm NaCl và NaClO, nguyên tử Cl trong NaClO có số oxi hóa +1 thể hiện tính oxi hóa mạnh.
Đáp án A
Câu hỏi 13 :
Kim loại nào dưới đây không tác dụng với dung dịch HCl?
- A Mg.
- B Na
- C Fe.
- D Cu.
Đáp án: D
Lời giải chi tiết:
Cu không tác dụng với dung dịch HCl vì Cu đứng sau H trong dãy hoạt động hóa học.
Đáp án D
Câu hỏi 14 :
Viết phương trình hóa học của các phản ứng để hoàn thành dãy chuyển hóa sau:
\(C{l_2}\xrightarrow{{(1)}}NaCl\xrightarrow{{(2)}}{\text{ }}HCl{\text{ }}\xrightarrow{{(3)}}KCl\xrightarrow{{(4)}}{\text{ }}AgCl\)
Phương pháp giải:
Dựa vào tính chất hóa học của các chất để viết phương trình hóa học.
Lời giải chi tiết:
(1) Cl2 + 2Na → 2NaCl
(2) 2NaCl + H2SO4 đặc \(\xrightarrow{{{t^0}}}\) Na2SO4 + 2HCl
(3) HCl + KOH → KCl + H2O
(4) KCl + AgNO3 → AgCl↓ + KNO3
Câu hỏi 15 :
Đổ từ từ dung dịch AgNO3 vào dung dịch NaCl, hiện tượng quan sát được là?
- A Xuất hiện kết tủa trắng.
- B Xuất hiện kết tủa đen.
- C Xuất hiện kết tủa vàng nhạt.
- D Xuất hiện kết tủa vàng đậm.
Đáp án: A
Lời giải chi tiết:
PTHH: AgNO3 + NaCl → AgCl ↓ trắng + NaNO3
Đáp án A
Câu hỏi 16 :
Cho sơ đồ thí nghiệm điều chế chất X:
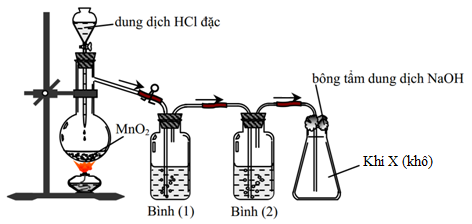
Chất X là
- A O2.
- B H2S.
- C H2.
- D Cl2.
Đáp án: D
Phương pháp giải:
Dựa vào tính chất hóa học của HCl: có tính khử khi tác dụng với chất oxi hóa mạnh như KMnO4, KClO3 hay MnO2.
Lời giải chi tiết:
Ta thấy HCl đặc phản ứng với MnO2 theo PTHH:
4HClđặc + MnO2 → MnCl2 + Cl2 + 2H2O
Vậy khí X thu được là khí Cl2.
Đáp án D
Câu hỏi 17 :
X là một loại muối clorua, là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Gia-ven,…. Đặc biệt, X có vai trò quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn. X là:
- A
KCl.
- B
NaCl.
- C
AlCl3.
- D
ZnCl2.
Đáp án: B
Phương pháp giải:
Dựa vào ứng dụng của các muối clorua.
Lời giải chi tiết:
Muối natri clorua (NaCl) là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Gia-ven, … Đặc biệt, NaCl có vai trò quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn.
Đáp án B
Câu hỏi 18 :
Cho dãy các kim loại: K, Ag, Mg, Al. Số kim loại trong dãy phản ứng được với dung dịch HCl là
- A 1
- B 4
- C 3
- D 2
Đáp án: C
Phương pháp giải:
Những kim loại đứng trước H trong dãy hoạt động hóa học có khả năng tác dụng với dung dịch HCl tạo ra muối và khí H2.
Lời giải chi tiết:
Những kim loại phản ứng được với dung dịch HCl là K, Mg, Al
Đáp án C
Câu hỏi 19 :
Kim loại nào sau đây không tác dụng với dung dịch HCl?
- A Cu
- B Al
- C Mg
- D Na
Đáp án: A
Phương pháp giải:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch HCl.
Lời giải chi tiết:
Các kim loại đứng trước H trong dãy hoạt động hóa học tác dụng được với dung dịch HCl.
Do đó kim loại Cu không tác dụng với dung dịch HCl.
Đáp án A
Câu hỏi 20 :
Dung dịch nào sau đây làm quỳ tím hóa đỏ
- A HCl.
- B KCl.
- C NaOH.
- D Na2SO4
Đáp án: A
Phương pháp giải:
Dung dịch axit làm quỳ tím chuyển đỏ
Lời giải chi tiết:
Dung dịch HCl là dd axit nên làm quỳ tím chuyển sang màu đỏ
Đáp án A
Câu hỏi 21 :
Dùng dung dịch nào sau đây để nhận biết ion clorua (Cl-)
- A AgNO3.
- B quỳ tím
- C phenolphtalein.
- D Oxi
Đáp án: A
Phương pháp giải:
Dấu hiệu nhận biết ion clorua (Cl-) là dùng muối Ag+
Lời giải chi tiết:
Dùng dd AgNO3 để nhận biết ion clorua (Cl-) vì khi đó xuất hiện kết tủa trắng.
PT ion rút gọn: Ag+ + Cl- → AgCl↓ trắng
Đáp án A
Câu hỏi 22 :
Cho phản ứng hóa học sau:
HCl (đặc) + KMnO4 (tinh thể) → ......... + Cl2 + ........ + ........
Tổng hệ số cân bằng phương trình hóa học (tỉ lệ tối giản) của phản ứng là
- A 33.
- B 36.
- C 34.
- D 35.
Đáp án: D
Phương pháp giải:
- Xác định các chất còn thiếu.
- Cân bằng phản ứng.
Cân bằng phản ứng oxi hóa - khử bằng phương pháp thăng bằng electron:
1. Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận.
4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Lời giải chi tiết:
Xác định số oxi hóa của các nguyên tố thay đổi:
\(H\mathop {Cl}\limits^{ - 1} + K\mathop {Mn}\limits^{ + 7} {O_4} \to KCl + \mathop {Mn}\limits^{ + 2} C{l_2} + {\mathop {Cl}\limits^0 _2} + {H_2}O\)
\(\begin{array}{*{20}{c}}{\mathop { \times 2}\limits^{} }\\{\mathop { \times 5}\limits^{} }\end{array}\left| \begin{array}{l}\mathop {Mn}\limits^{ + 7} {\rm{ + 5e}} \to \mathop {Mn}\limits^{ + 2} \\\mathop {2Cl}\limits^{ - 1} \to \mathop {C{l_2}}\limits^0 {\rm{ + 2e}}\end{array} \right.\)
⟹ PTHH: 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Tổng hệ số cân bằng phương trình hóa học (tỉ lệ tối giản) của phản ứng là 16 + 2 + 2 + 2 + 5 + 8 = 35.
Đáp án D
Câu hỏi 23 :
Phản ứng hóa học nào sau đây chứng tỏ HCl có tính khử?
- A HCl + NaOH → NaCl + H2O
- B
HCl + NH3 → NH4Cl
- C
HCl + Mg → MgCl2 + H2
- D 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Đáp án: D
Phương pháp giải:
- Xác định số oxi hóa của Cl trước và sau phản ứng
- Xác định phản ứng HCl thể hiện tính khử (số oxi hóa của Cl tăng)
Lời giải chi tiết:
Xét số oxi hóa của các nguyên tố trong phản ứng:
\(4H\mathop {Cl}\limits^{ - 1} \;\; + {\rm{ }}Mn{O_2}\;\; \to MnC{l_2}\; + {\rm{ }}{\mathop {Cl}\limits^0 _2}\; + \;2{H_2}O\)
Ta thấy số oxi hóa của Cl tăng từ -1 lên 0 nên HCl có tính khử.
Đáp án D
Câu hỏi 24 :
Chất nào sau đây tác dụng được với dung dịch HCl?
- A BaCl2.
- B NaCl.
- C Al(OH)3.
- D Al(NO3)3.
Đáp án: C
Phương pháp giải:
HCl có tính chất chung của axit: phản ứng với kim loại đứng trước H, oxit bazơ, bazơ và muối
Lời giải chi tiết:
HCl phản ứng với Al(OH)3 theo PTHH: Al(OH)3 + 3HCl → AlCl3 + 3H2O
Đáp án C
Câu hỏi 25 :
Khí hidroclorua có thể điều chế được bằng phản ứng giữa tinh thể muối ăn với:
- A Xút
- B Axit H2SO4 loãng
- C H2O
- D Axit H2SO4 đặc, đun nóng
Đáp án: D
Phương pháp giải:
Dựa vào phương pháp điều chế khí HCl trong phòng thí nghiệm.
Lời giải chi tiết:
Khí hidroclorua có thể điều chế được bằng phản ứng giữa tinh thể muối ăn với axit H2SO4 đặc, đun nóng.
PTHH:
\(\begin{gathered}
NaCl + {H_2}S{O_4}\xrightarrow{{{{250}^0}C}}NaHS{O_4} + HCl \hfill \\
2NaCl + {H_2}S{O_4}\xrightarrow{{{{400}^0}C}}N{a_2}S{O_4} + 2HCl \hfill \\
\end{gathered} \)
Đáp án D
Câu hỏi 26 :
Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
- A 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
- B 2HCl + Mg → MgCl2 + H2
- C HCl + AgNO3 → AgCl + HNO3
- D 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
Đáp án: B
Phương pháp giải:
Chất oxi hóa là chất nhận electron.
Lời giải chi tiết:
Ở phản ứng: HCl + Mg → MgCl2 + H2 ta thấy HCl nhận e nên là chất oxi hóa:
2H+ + 2e → H2
Đáp án B
Câu hỏi 27 :
Trong phản ứng sau: Cl2 + 2H2O + SO2 → H2SO4 + 2HCl, thì :
- A Cl2 là chất oxi hóa, H2O là chất khử.
- B Cl2 là chất oxi hóa, SO2 là chất khử.
- C Cl2 là chất khử, SO2 là chất oxi hóa.
- D SO2 là chất khử, H2O là chất oxi hóa.
Đáp án: B
Phương pháp giải:
Chất khử là chất nhường e, chất oxi hóa là chất nhận e.
Lời giải chi tiết:
\({\mathop {Cl}\limits^0 _2} + 2e \to 2\mathop {Cl}\limits^{ - 1} \) => Cl2 là chất oxi hóa
\(\mathop S\limits^{ + 4} - 2e \to \mathop S\limits^{ + 6} \) => SO2 là chất khử
Đáp án B
Câu hỏi 28 :
Axit HCl có thể tác dụng được với bao nhiêu chất trong dãy sau: Al, Mg(OH)2, Na2SO4, FeS, Fe2O3, Ag2SO4, K2O, CaCO3, Mg(NO3)2
- A 6
- B 7
- C 8
- D 9
Đáp án: B
Phương pháp giải:
Dựa vào tính chất hóa học của axit HCl.
Lời giải chi tiết:
6 HCl +2 Al → 2AlCl3 + 3H2
2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
2 HCl + FeS → FeCl2 + H2S
6 HCl + Fe2O3 → 2 FeCl3 + 3 H2O
2 HCl + Ag2SO4 → 2 AgCl + H2SO4
2 HCl + K2O → 2 KCl + H2O
2 HCl + CaCO3 → CaCl2 + H2O + CO2
Đáp án B
Câu hỏi 29 :
Oxit nào sau đây có thể làm khô khí HCl
- A CuO
- B P2O5
- C CO2
- D CO
Đáp án: B
Phương pháp giải:
Chất có thể làm khô khí HCl là chất có khả năng hút nước và không phản ứng với HCl
Lời giải chi tiết:
Chất có thể làm khô khí HCl là chất có khả năng hút nước và không phản ứng với HCl đó là P2O5.
Đáp án B
Câu hỏi 30 :
Cho các phản ứng sau:
(1) NaOH + HCl -> NaCl + H2O.
(2) K2CO3 + HCl -> KCl + CO2 + H2O.
(3) MnO2 + HCl -> MnCl2 + Cl2 + H2O.
(4) KMnO4 + HCl -> KCl + MnCl2 + Cl2 + H2O.
(5) Fe + HCl -> FeCl2 + H2.
(6) HCl + CuO -> CuCl2 + H2O.
Số phản ứng HCl chỉ thể hiện tính oxi hoá là:
- A 1
- B 2
- C 3
- D 6
Đáp án: A
Phương pháp giải:
Chất oxi hóa là chất nhận electron => số oxi hóa giảm
Cl đạt số oxi hóa thấp nhất nên không còn khả năng nhận e
=> H nhận e để lên xuống mức oxi hóa thấp hơn (tạo thành H2)
Lời giải chi tiết:
Phản ứng HCl chỉ thể hiện tính oxi hoá là:
(5) Fe + HCl → FeCl2 + H2.
Đáp án A
20 bài tập vận dụng về axit clohidric có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
20 bài tập vận dụng về axit clohidric (phần 2) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
30 bài tập lý thuyết về hidro clorua - axit clohidric - muối clorua có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









