30 bài tập vận dụng về kim loại tác dụng với axit nitric có lời giải (phần 1)
Làm đề thiCâu hỏi 1 :
Hoà tan hoàn toàn 5,6 gam Fe bằng dung dịch HNO3 1M (dư). Sau phản ứng thu được dung dịch A và một khí không màu hoá nâu trong không khí là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là (biết đã lấy dư 10% so với lượng cần thiết):
- A 400 ml.
- B 440 ml.
- C 360 ml.
- D 300 ml.
Đáp án: B
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
Khí không màu hóa nâu trong không khí là NO
Bảo toàn e : 3.nFe = 3nNO => nNO = 0,1 mol
=> nHNO3 pứ = 4nNO = 0,4 mol
Do lượng axit đã dùng dư 10% so với lượng phản ứng nên ta có:
=> nHNO3 bđ = 0,4 + 0,4.10% = 0,44 mol
=> Vdd HNO3 = 0,44 lit = 440 ml
Đáp án B
Câu hỏi 2 :
Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu trong dung dịch HNO3 loãng dư, sau phản ứng thu được 4,48 lít NO (đktc) là sản phẩm khử duy nhất. Phần trăm theo khối lượng kim loại Cu có trong hỗn hợp là:
- A 63,16%.
- B 36,84%.
- C 42,11%.
- D 57,89%.
Đáp án: A
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
Giả sử hỗn hợp X gồm x mol Fe và y mol Cu.
- Bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 0,6 (1)
- Khối lượng hỗn hợp: mX = 56x + 16y = 15,2 (2)
Từ (1), (2) => x = 0,1; y = 0,15 mol
=> %mCu(X) = 63,16%
Đáp án A
Câu hỏi 3 :
Hoà tan hoàn toàn 26 gam kim loại R chưa rõ hoá trị bằng dung dịch HNO3 dư, sau phản ứng thu được 2,016 lít hỗn hợp khí N2O và N2 có tỉ khối hơi so với H2 là 166/9 (không còn sản phẩm khử nào khác). Biết thể tích khí đo ở đktc. Kim loại R là:
- A Mg.
- B Fe.
- C Cu.
- D Zn.
Đáp án: D
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
Giải hệ: n khí = nN2O + nN2 = 0,09 mol và m khí = 44nN2O + 28nN2 = 3,32 gam
=> nN2O = 0,05 ; nN2 = 0,04 mol
Giả sử hóa trị của R là n.
Số mol của R là 26/R (mol)
Bảo toàn e: n.nR = 8nN2O + 10nN2 => n.(26/R) = 8.0,05 + 10.0,04 => R = 32,5n
Thay các giá trị n = 1, 2, 3 vào thấy với n = 2 thì M = 65 (Zn)
Đáp án D
Câu hỏi 4 :
Hoà tan hoàn toàn hỗn hợp X gồm: Fe, Cu, Al và Mg trong dung dịch HNO3 vừa đủ, sau phản ứng thu được 4,48 lít NO2, 3,36 lít NO, 2,24 lít N2 và 1,12 lít N2O (không có NH4NO3). Số mol HNO3 đã dùng là:
- A 2,7 mol.
- B 0,5 mol.
- C 1,6 mol.
- D 1,9 mol.
Đáp án: A
Phương pháp giải:
Bài toán KL + HNO3:
Cách thiết lập công thức số mol HNO3 phản ứng theo số mol sản phẩm khử của N+5:
Đặt công thức chung của KL là M, hóa trị n
M - n e → M(NO3)n
1 mol n mol 1 mol
Nhận thấy: n e nhường = n (mol); nNO3- (muối với KL) = n (mol)
=> nNO3- (muối với KL) = n e = 3nNO + nNO2 + 10nN2 + 8nN2O + 8nNH4NO3 (*)
BTNT "N": nHNO3 = nNO3- (muối với KL) + nNO + nNO2 + 2nN2 + 2nN2O + 2nNH4NO3 (**)
Thay (*) vào (**) => nHNO3 = 4nNO + 2nNO2 + 12nN2 + 10nN2O + 10nNH4NO3
Lời giải chi tiết:
Áp dụng công thức tính nhanh: nHNO3 = 2nNO2 + 4nNO + 12nN2 + 10nN2O = 2,7 mol
Đáp án A
Câu hỏi 5 :
Hòa tan 1,2 g kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ ở đktc (giả thiết phản ứng chỉ tạo ra khí N2). Vậy X là:
- A Zn
- B Cu
- C Mg
- D Al
Đáp án: C
Lời giải chi tiết:
X → X+n + ne 2N+5 + 10e → N2
0,1/n ← 0,1 mol 0,1 ← 0,01 mol
=> MX = 12n
Vì hóa trị của kim loại thường là 1,2,3 nên ta thấy n= 2 thì M =24 (Mg) thỏa mãn
Đáp án C
Câu hỏi 6 :
Hoà tan hoàn toàn 2,24 gam kim loại R chưa rõ hoá trị bằng dung dịch HNO3, sau phản ứng thu được dung dịch gồm muối nitrat của kim loại R và 0,896 lít khí NO (đktc) là sản phẩm khử duy nhất . Kim loại R là:
- A Al.
- B Fe.
- C Mg.
- D Cu.
Đáp án: B
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nNO = 0,04 mol
R → R+n + ne N+5 + 3e → N+2
0,12/n ← 0,12 mol 0,12←0,04
Áp dụng định luật bảo toàn e ta có ne cho = n e nhận = 0,12 mol
=> nR = 0,12/n
=> MR = 2,24 : (0,12/n) = 56n/3
=> n = 3, R = 56 (Fe)
Đáp án B
Câu hỏi 7 :
Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Thể tích dung dịch HNO3 đã dùng là:
- A 0,25 lít.
- B 0,45 lít.
- C 0,7 lít.
- D 0,9 lít.
Đáp án: C
Lời giải chi tiết:

Câu hỏi 8 :
Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là:
- A 0,1 lít.
- B 0,4 lít.
- C 2,24 lít.
- D 8,96 lít.
Đáp án: B
Lời giải chi tiết:
nNO=0,1 mol
NO3- + 4H+ + 3e → NO + 2H2O
0,4 ← 0,1
VHNO3 = nHNO3 : CM = 0,4 : 1 = 0,4 lít
Đáp án B
Câu hỏi 9 :
Hoà tan hoàn toàn 5,6 gam Fe bằng dung dịch HNO3 đặc nóng dư, sau phản ứng thu được muối Fe(NO3)3 và V lít khí NO2 ở đktc, là sản phẩm khử duy nhất. Giá trị của V là:
- A 2,24 lít.
- B 4,48 lít.
- C 6,72 lít.
- D 8,96 lít.
Đáp án: C
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nFe = 0,1 mol
Fe → Fe+3 + 3e N+5 +1e → N+4
0,1 → 0,3 mol 0,3 → 0,3 mol
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol
=> nNO2 = n e nhận = 0,3 mol
=> VNO2 = 0,3 . 22,4 = 6,72 lít
Đáp án C
Câu hỏi 10 :
Hoà tan hoàn toàn m gam Cu bằng dung dịch HNO3 loãng dư, sau phản ứng thu được dung dịch chứa muối Cu(NO3)2 và 2,24 lít khí NO (ở đktc) là sản phẩm khử duy nhất. Giá trị của m là:
- A 3,2 gam.
- B 6,4 gam.
- C 9,6 gam.
- D 12,8 gam.
Đáp án: C
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nNO= 0,1 mol
Cu → Cu+2 + 2e N+5 +3e → N+2
0,15 ← 0,3 mol 0,3 ← 0,1 mol
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol
=> nCu = n e cho : 2 = 0,15 mol
=> m = 0,15 . 64 = 9,6g
Đáp án C
Câu hỏi 11 :
Hoà tan hoàn toàn m gam Cu bằng dung dịch HNO3 loãng dư, sau phản ứng thu được dung dịch chứa muối Cu(NO3)2 và hỗn hợp khí gồm NO; NO2 có số mol lần lượt là 0,1 và 0,2 mol. Giá trị của m là:
- A 9,6 gam.
- B 16,0 gam.
- C 19,2 gam.
- D 22,4 gam.
Đáp án: B
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nNO = 0,1 mol
Cu → Cu+2 + 2e
0,25 ← 0,5 mol
N+5 +3e → N+2
0,3 ← 0,1 mol
N+5 + 1e → N+4
0,2 ← 0,2
Áp dụng định luật bảo toàn e ta có: n e cho = n e nhận = 0,5 mol
=> nCu = ne cho : 2 = 0,25 mol
=> m = 0,25.64 = 16 (g)
Đáp án B
Câu hỏi 12 :
Hoà tan hoàn toàn hỗn hợp X gồm 5,6 gam Fe và 6,4 gam Cu, sau phản ứng thu được dung dịch A chứa hỗn hợp muối gồm Fe(NO3)3 và Cu(NO3)2; khí NO2 (đktc) là sản phẩm khử duy nhất. Thể tích khí NO2 thu được là:
- A 11,2 lít.
- B 8,96 lít.
- C 6,72 lít.
- D 4,48 lít.
Đáp án: A
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nFe = 0,1 mol; nCu = 0,1 mol
Cu → Cu+2 + 2e
0,1 → 0,2 mol
Fe → Fe+3 + 3e
0,1 → 0,3 mol
N+5 +1e → N+4
0,5 →0,5 mol
Áp dụng định luật bảo toàn e ta có: n e cho = n e nhận = 0,5 mol
=> nNO2 = n e nhận = 0,5 mol
=> V = 0,5.22,4 = 11,2 (l)
Đáp án A
Câu hỏi 13 :
Hoàn tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và 13,44 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Phần trăm theo khối lượng của Fe trong hỗn hợp X là:
- A 36,84%.
- B 63,16%.
- C 55,26%.
- D 44,74%.
Đáp án: A
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nCu = x mol và nFe = y mol
=> mX = 64x + 56y = 15,2 (1)
nNO2 = 13,44:22,4 = 0,6 mol
Cu → Cu+2 + 2e
X → 2x mol
Fe → Fe+3 + 3e
y → 3y mol
N+5 +1e → N+4
0,6 →0,6 mol
Áp dụng định luật bảo toàn e ta có: n e cho = n e nhận = 2x + 3y = 0,6 mol (2)
Giải (1) và (2) được x = 0,15 và y = 0,1
%mFe = [0,1.56/15,2].100% = 36,84%
Đáp án A
Câu hỏi 14 :
Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch Y gồm 2 muối Fe(NO3)3 và Cu(NO3)2; 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Dung dịch Y tác dụng vừa đủ với m’ gam Mg (Mg đẩy Fe và Cu ra khỏi muối). Giá trị của m’ là:
- A 1,2 gam.
- B 2,4 gam.
- C 3,6 gam.
- D 4,8 gam.
Đáp án: A
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
\(\left\{ \begin{gathered}
Fe \hfill \\
Cu \hfill \\
\end{gathered} \right.\xrightarrow{{ + HN{O_3}}}\left\{ \begin{gathered}
N{O_2} \hfill \\
Fe{(N{O_3})_3} \hfill \\
Cu{(N{O_3})_2} \hfill \\
\end{gathered} \right.\xrightarrow{{ + Mg\,du}}\left\{ \begin{gathered}
M{g^{2 + }} \hfill \\
Fe \hfill \\
Cu \hfill \\
\end{gathered} \right.\)
Từ sơ đồ dễ thấy sau tất cả các phản ứng chỉ có Mg và N thay đổi số oxi hóa thay đổi
Ta có: Mg → Mg+2 + 2e N+5 + 1e → N+4
a → 2a 0,1 ← 0,1
Áp dụng định luật bảo toàn e ta có: 2a = 0,1 => a = 0,05 mol
=> m = 0,05.24 = 1,2 (g)
Đáp án A
Câu hỏi 15 :
Hoà tan 0,1 mol Cu vào 120ml dung dịch X gồm HNO3 1M và H2SO4 0,5M. Sau khi phản ứng kết thúc thu được V lit khí NO duy nhất. Giá trị của V:
- A 1,344 lit
- B 1,49 lit
- C 0,672 lit
- D 1,12 lit
Đáp án: A
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nCu = 0,1 mol; nH+ = 0,24 mol; nNO3- = 0,12 mol
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Từ PTHH ta có: \(\frac{{{n_{Cu}}}}{3} > \frac{{{n_{{H^ + }}}}}{8} < \frac{{{n_{N{O_3}^ - }}}}{2}\) => H+ phản ứng hết
nNO = nH+:4 = 0,06 mol
VNO = 0,06.22,4 = 1,344 (l)
Đáp án A
Câu hỏi 16 :
Hòa tan 9,6 gam Cu vào 180 ml dung dịch hỗn hợp HNO3 1M và H2SO4 0,5M, kết thúc phản ứng thu được V lít (ở đktc) khí không màu duy nhất thoát ra, hóa nâu ngoài không khí. Giá trị của V là:
- A 1,344 lít
- B 4,032 lít
- C 2,016 lít
- D 1,008 lít
Đáp án: C
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
nCu = 0,15 mol; nNO3- = 0,18 mol; nH+ = 0,36 mol
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Vì \(\frac{{{n_{{H^ + }}}}}{8} < \frac{{{n_{Cu}}}}{3} < \frac{{{n_{N{O_3}^ - }}}}{2}\) => H+ hết, Cu dư
=> nNO = nH+ : 4 = 0,09 mol
=> VNO = 0,09.22,4 = 2,016 (l)
Đáp án C
Câu hỏi 17 :
Hòa tan m hỗn hợp A gồm Mg và Al vào dung dịch HCl dư thì thu được 9,632 lít khí (đktc). Nếu hòa tan hết m gam hỗn hợp A vào dung dịch HNO3 thì thoát ra 0,1 mol khí NO và 0,05 mol khí N2O. Số mol HNO3 đã tham gia phản ứng là
- A 1,1 mol.
- B 0,63 mol.
- C 1,06 mol.
- D 1,08 mol.
Đáp án: A
Phương pháp giải:
Bảo toàn electron.
Công thức tính nhanh: nHNO3 = 4nNO + 10nN2O + 10nNH4NO3
Lời giải chi tiết:
*Khi A + HCl:
Bảo toàn e: 3nAl + 2nMg = 2nH2 (*)
*Khi A + HNO3:
3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3 (**)
Từ (*) và (**) => 2nH2 = 3nNO + 8nN2O + 8nNH4NO3
2.0,43 = 3.0,1 + 8.0,05 + 8.nNH4NO3 => nNH4NO3 = 0,02 mol
Công thức tính nhanh: nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 1,1 mol
Đáp án A
Câu hỏi 18 :
Cho 1,92 gam Cu tác dụng với 100 ml dung dịch HNO3 0,3M và HCl 0,3M thì thể tích khí NO (đktc) thu được là
- A 0,448 lít.
- B 0,336 lít.
- C 0,168 lít.
- D 0,672 lít.
Đáp án: B
Phương pháp giải:
Tính toán theo PTHH: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Lời giải chi tiết:
PT: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,03 0,06 0,03
Ta thấy: 0,06/8 < 0,03/3 < 0,03/2 nên H+ hết, Cu và NO3- dư
=> nNO = 0,25nH+ = 0,25.0,06 = 0,015 mol
=> VNO = 0,336 lít
Đáp án B
Câu hỏi 19 :
Cho Cu tác dụng với dung dịch HNO3 thu được muối Cu(NO3)2 và hỗn hợp khí gồm 0,1 mol NO và 0,2 mol NO2. Khối lượng của Cu đã phản ứng là:
- A 12,8 gam.
- B 6,4 gam.
- C 3,2 gam.
- D 16 gam.
Đáp án: D
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
Bảo toàn e: 2nCu = 3nNO + nNO2
=> 2nCu = 3.0,1 + 0,2 => nCu = 0,25 mol
=> mCu = 0,25.64 = 16 gam
Đáp án D
Câu hỏi 20 :
Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
- A 0,448.
- B 0,792.
- C 0,672.
- D 0,746.
Đáp án: C
Phương pháp giải:
Tính theo PT ion: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Lời giải chi tiết:
nCu = 0,05 mol; nH+ = nHNO3 + 2nH2SO4 = 0,12 mol; nNO3- = nHNO3 = 0,08 mol
PT ion: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Bđ: 0,05 0,12 0,08 (Ta thấy: 0,12/8 < 0,05/3 < 0,08/2 => H+ hết; Cu và NO3- dư)
Pư: 0,045 ← 0,12 → 0,03
=> nNO = 0,03 mol => V = 0,672 lít
Đáp án C
Câu hỏi 21 :
Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
- A 37,8 gam.
- B 18,9 gam.
- C 28,35 gam.
- D 39,8 gam.
Đáp án: D
Phương pháp giải:
Bảo toàn electron.
Lời giải chi tiết:
nZn = 0,2 mol; nN2 = 0,02 mol
Bảo toàn e: 2nZn = 10nN2 + 8nNH4NO3
=> 2.0,2 = 10.0,02 + 8nNH4NO3 => nNH4NO3 = 0,025 mol
=> Muối gồm: 0,2 mol Zn(NO3)2 và 0,025 mol NH4NO3
=> m muối = 0,2.189 + 0,025.80 = 39,8 gam
Đáp án D
Câu hỏi 22 :
Cho 20 gam hỗn hợp gồm Zn, Al, Mg tác dụng hết với dung dịch HNO3 dư thu được hỗn hợp khí gồm 0,05 mol N2O (sản phẩm khử duy nhất). Tổng khối lượng muối khan thu được sau phản ứng là:
- A 26,2 gam
- B 36,3 gam
- C 44,8 gam
- D 51 gam
Đáp án: C
Lời giải chi tiết:
Đáp án: C
Phương pháp: bảo toàn khối lượng, dùng CT tính nhanh :
n NO3− ( TRONG MUỐI) = n NO2 + 3.n NO + 8.n NH4NO3 + 8. n N2O + 10. n N2
Hướng dẫn giải:
n NO3− = 8 n N2O = 8. 0,05 =0,4 (mol)
=> Khối lượng muối = 20 + 0,4. 62 = 44, 8 (gam)
Câu hỏi 23 :
Cho 10 gam hỗn hợp gồm Cu, Al, Mg tác dụng hết với dung dịch HNO3 dư thu được hỗn hợp khí gồm 0,1 mol NO và 0,11 mol NO2 (sản phẩm khử duy nhất). Tổng khối lượng muối tạo ra trong dung dịch là:
- A 34,8 gam
- B 35, 42 gam
- C 54, 42 gam
- D 45,42 gam
Đáp án: B
Lời giải chi tiết:
Đáp án: B
Phương pháp: bảo toàn khối lượng, dùng CT tính nhanh :
n NO3− ( TRONG MUỐI) = n NO2 + 3.n NO + 8.n NH4NO3 + 8. n N2O + 10. n N2
Hướng dẫn giải:
n NO3− = 3 n NO + n NO2 = 3.0,1 + 0,11. 1= 0,41 (mol)
=> mmuối = 10 + 0,41. 62 = 35,42( gam)
Câu hỏi 24 :
Cho 14 gam hỗn hợp gồm Fe, Mg, Al tác dụng hết với dung dịch HNO3 dư thu được hỗn hợp khí gồm 0,12 mol NO (sản phẩm khử duy nhất). Tổng khối lượng muối tạo ra trong dung dịch là:
- A 21,44 gam
- B 24, 2 gam
- C 43, 76 gam
- D 36,32 gam
Đáp án: D
Lời giải chi tiết:
Đáp án: D
Phương pháp : dùng bảo toàn electron và CT tính nhanh :
n NO3− ( TRONG MUỐI) = n NO2 + 3.n NO + 8.n NH4NO3 + 8. n N2O + 10. n N2
Hướng dẫn giải:
n NO3− ( muối) = 3n NO = 3.0,12= 0,36 (mol) => m muối = 14+ 0,36. 62 = 36, 32 (gam)
Câu hỏi 25 :
Hòa tan hết 2,7 gam Al bằng dung dịch HNO3 dư thu được 2,24 lít khí X (đktc) (sản phẩm khử duy nhất). Khí X là:
- A N2
- B NO
- C N2O
- D NO2
Đáp án: B
Lời giải chi tiết:
Đáp án: B
Phương pháp : dùng bảo toàn electron
Hướng dẫn giải:
n X = 0, 1(mol) ; n e kim loại nhường = (2,7:27) .3 =0,3 (mol)
![]()
Câu hỏi 26 :
Cho 6,4 gam Cu vào 200 gam dung dịch HNO3 (lấy dư) thu được một khí duy nhất và dung dịch X (không có NH4NO3) có khối lượng 197,2 gam. Xác định công thức của khí thoát ra.
- A NO2
- B NO
- C N2O
- D N2 .
Đáp án: A
Phương pháp giải:
Phương pháp:
mdd giảm = mCu + mdd HNO3 - mX = khí
nkhí = Mkhí=
Lời giải chi tiết:
Hướng dẫn giải
mdd giảm = mCu + mdd HNO3 - mX = khí= 6,4+ 200-197,2=9,2
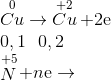
nkhí = 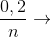 Mkhí=
Mkhí= 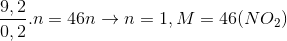
Đáp án A.
Câu hỏi 27 :
Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là:
- A 1,92 gam
- B 3,20 gam
- C 0,64 gam
- D 3,84 gam
Đáp án: A
Phương pháp giải:
Phương pháp:
nFe = 0,12 mol → ne cho= 3.0,12=0,36mol
nHNO3 =4.nNO =0,4=> nNO= 0,1mol => ne nhận = 3.0,1=0,3 mol
ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe (dư) + 2Fe3+ → 3Fe2+
Cu + 2Fe3+ (dư) → Cu2+ + 2Fe2+
→ mCu
Lời giải chi tiết:
Hướng dẫn giải
nFe = 0,12 mol → ne cho= 3.0,12=0,36mol
nHNO3 =4.nNO =0,4=> nNO= 0,1mol => ne nhận = 3.0,1=0,3 mol
ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,1 ← 0,4 → 0,1
Fe (dư) + 2Fe3+ → 3Fe2+
0,02 → 0,04
Cu + 2Fe3+ (dư) → Cu2+ + 2Fe2+
0,03 ← 0,06
→ mCu = 0,03.64 = 1,92 gam
Đáp án A.
Câu hỏi 28 :
Hòa tan hòa toàn 10,44 gam hỗn hợp X gồm Al và Fe trong dung dịch HNO3 loãng dư thu được 6,496 lít khí NO duy nhất bay ra ở điều kiện tiêu chuẩn. Tính % khối lượng của Al trong hỗn hợp X.
- A 51,72%
- B 38,79%
- C 25,86%
- D đáp án khác
Đáp án: A
Phương pháp giải:
Phương pháp:
nFe = x nAl = y
mhh = mFe + mAl
=> 56x + 27y =mhh (1)
ne KL nhường = 3nNO
=> 3x + 3y = ne nhường (2)
(1), (2)=> x,y
%mAl
Lời giải chi tiết:
Hướng dẫn giải
nFe = x nAl = y
mhh = mFe + mAl
=> 56x + 27y =10,44 (1)
ne KL nhường = 3nNO = 3. 0,29=0,87
=> 3x + 3y = 0,87 (2)
(1), (2)=> x=0,09
y=0,2
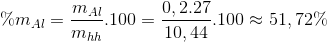
Đáp án A.
Câu hỏi 29 :
Cho Cu dư vào V(l) dung dịch HNO3 4M thu được V1(lit) khí NO. Cho Cu dư vào V (l) dung dịch chứa HNO3 3M và H2SO4 1M thu được V2 (l) khí NO (V1, V2 đo ở cùng điều kiện về t0, p).So sánh V1 và V2 . NO là sản phẩm khử duy nhất của NO3-
- A V1 = V2
- B V1 > V2
- C V1 < V2
- D không xác định.
Đáp án: C
Phương pháp giải:
Phương pháp:
3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO +4H2O
3Cu + 8H+ + 2NO3- -> 3Cu+2 + 2NO + 4H2O
So sánh số mol =>NO3- dư, tính theo H+
=> V1, V2
Lời giải chi tiết:
Hướng dẫn giải
3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO +4H2O
4V V
V1=V
3Cu + 8H+ + 2NO3- -> 3Cu+2 + 2NO + 4H2O
bđ 5V 3V
p/u 5V 1,25V 1,25V
NO3- dư, tính theo H+
=> V2 =1,25V
=> V2 > V1
Đáp án C.
Câu hỏi 30 :
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu , Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là:
- A 205,4 gam và 2,5 mol
- B 199,2 gam và 2,4 mol
- C 205,4 gam và 2,4 mol
- D 199,2 gam và 2,5 mol
Đáp án: C
Phương pháp giải:
Phương pháp:
nY = 0,6 mol → nNO2= 0,3 mol ; nNO= 0,2 mol ; nN2O = 0,1 mol
nNO3-(tao muối) = ne nhận = nNO2 + 3nNO + 8nN2O
=> nNO3-(tạo muối)
→ mZ = mKl+ mNO3-(tao muối)
Lời giải chi tiết:
Hướng dẫn giải
nY = 0,6 mol → nNO2= 0,3 mol ; nNO= 0,2 mol ; nN2O = 0,1 mol
nNO3-(tao muối) = ne nhận = = nNO2 + 3nNO + 8nN2O
=> nNO3-(tạo muối) = 0,3+ 3.0,2+8.0,1= 1,7 mol
→ mZ = mKl+ mNO3-(tao muối) = 100 + 1,7.62 = 205,4 gam (1)
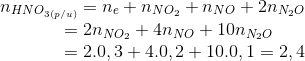
Đáp án C.
30 bài tập vận dụng về axit nitric - muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 2)
40 câu hỏi lý thuyết về axit nitric - muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 1)
40 câu hỏi lý thuyết về axit nitric và muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 2)
20 bài tập vận dụng cao về axit nitric - muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 3)
20 bài tập vận dụng cao về axit nitric - muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 2)
20 bài tập vận dụng cao về axit nitric - muối nitrat hay nhất có đáp án và lời giải chi tiết (phần 1)
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









