20 bài tập về P2O5 tác dụng với dung dịch kiềm có lời giải
Làm đề thiCâu hỏi 1 :
Cho 14,2 gam P2O5 tác dụng với 350ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch A. Dung dịch A gồm các chất tan là:
- A Na3PO4 và NaOH.
- B Na3PO4 và Na2HPO4.
- C Na2HPO4 và NaH2PO4.
- D Na3PO4 và NaH2PO4.
Đáp án: C
Phương pháp giải:
3NaOH + H3PO4 → Na3PO4 + 3H2O => nNaOH : nH3PO4 = 3
2NaOH + H2PO4 → Na2HPO4 + 2H2O => nNaOH : nH3PO4 = 2
NaOH + H3PO4 → NaH2PO4 + H2O => nNaOH : nH3PO4 = 1
Tính nNaOH : nH3PO4 theo đề bài từ đó suy ra các muối được tạo thành.
Lời giải chi tiết:
P2O5 + 3H2O → 2H3PO4
=> nH3PO4 = 2nP2O5 = 0,2 mol
Dựa vào 3 phản ứng :
3NaOH + H3PO4 → Na3PO4 + 3H2O => nNaOH : nH3PO4 = 3
2NaOH + H2PO4 → Na2HPO4 + 2H2O => nNaOH : nH3PO4 = 2
NaOH + H3PO4 → NaH2PO4 + H2O => nNaOH : nH3PO4 = 1
Vì: nNaOH : nH3PO4 = 0,35 : 0,2 = 1,75
=> Phản ứng tạo NaH2PO4 và Na2HPO4
Đáp án C
Câu hỏi 2 :
Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32% thu được muối Na2HPO4. Giá trị của m là:
- A 75
- B 50
- C 100
- D 25
Đáp án: B
Phương pháp giải:
Bảo toàn nguyên tố
Lời giải chi tiết:

Câu hỏi 3 :
Đốt cháy 4,65 gam photpho ngoài không khí rồi hoà tan sản phẩm vào 500 ml dung dịch NaOH 1,2 M. Tổng khối lượng chất tan trong dung dịch sau phản ứng là
- A 24,6 gam
- B 26,2 gam. .
- C 26,4 gam
- D 30,6 gam.
Đáp án: D
Phương pháp giải:
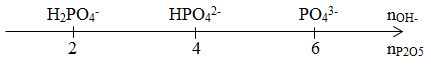
Lời giải chi tiết:
2P -> P2O5
=> nP2O5 = 0,075 mol
nNaOH = 0,6 mol >> nP2O5 => NaOH dư
6NaOH + P2O5 -> 2Na3PO4 + 3H2O
=> Sau phản ứng có : 0,15 mol Na3PO4 và 0,15 mol NaOH
=> mtan = 30,6g
Đáp án D
Câu hỏi 4 :
Cho m gam P2O5 vào 1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M, sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn cẩn thận X thu được 35,4 gam hỗn hợp muối khan. Giá trị của m là
- A 28,4 gam.
- B 7,1 gam.
- C 21,3 gam.
- D 14,2 gam.
Đáp án: D
Phương pháp giải:
Bảo toàn khối lượng
Lời giải chi tiết:
Xét H3PO4 phản ứng với bazo => nH2O = nOH = 0,5 mol
Bảo toàn khối lượng: mH3PO4 + mNaOH + mKOH = mmuối + mH2O
=> mH3PO4 = 19,6 g => nH3PO4 = 0,2 mol => nP2O5 = ½ nH3PO4 = 0,1mol
=> m = 14,2g
Đáp án D
Câu hỏi 5 :
Cho 7,1 gam P2O5 vào 100 ml dung dịch KOH 1,5M thu được dung dịch X. Cô cạn dung dịch X được hỗn hợp gồm các chất là
- A KH2PO4 và H3PO4.
- B KH2PO4 và K2HPO4.
- C KH2PO4 và K3PO4.
- D K3PO4 và K2HPO4.
Đáp án: B
Phương pháp giải:
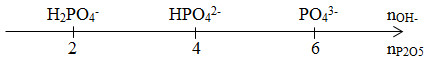
Lời giải chi tiết:
Ta có : nP2O5 = 0,05 mol ; nKOH = 0,15 mol = 3nP2O5
=> phản ứng tạo KH2PO4 và K2HPO4
P2O5 + 2KOH + H2O -> 2KH2PO4
P2O5 + 4KOH -> 2K2HPO4 + H2O
Đáp án B
Câu hỏi 6 :
Hòa tan hết m gam P2O5 vào 400 gam dung dịch KOH 10% dư sau phản ứng hoàn toàn cô cạn dung dịch thu được 3,5m gam chất rắn. Giá trị nào sau đây gần nhất với giá trị m?
- A 14,00
- B 16,00
- C 13,00
- D 15,00
Đáp án: A
Phương pháp giải:
Phương pháp: Bảo toàn khối lượng
Lời giải chi tiết:
Hướng dẫn giải
nKOH = (400.10%)/(100%.56) = 5/7 (mol)
Gọi nP2O5 = x (mol) => nH3PO4 = 2x (mol)
KOH dư nên muối thu được là K3PO4 : 2x (mol)
Gọi nKOH dư là y (mol)
Ta có:
\(\left\{ {\matrix{{{\rm{142x}}\,\,\,\,\,{\rm{ = }}\,\,\,\,{\rm{m}}} \cr {{\rm{212}}{\rm{.2x + }}\,{\rm{56y}}\,\,\,{\rm{ = }}\,\,\,{\rm{3,5m}}} \cr {{\rm{6x + y}}\,\,\,{\rm{ = }}\,\,\,{{\rm{5}} \over {\rm{7}}}} \cr} } \right.{\rm{ = > }}\left\{ {\matrix{{{{{\rm{212}}{\rm{.2x}}\,{\rm{ + 56y}}} \over {{\rm{142x}}}}\,\,{\rm{ = }}\,\,{\rm{3,5}}\,\,\,\,{\rm{(1)}}\,} \cr {{\rm{6x}}\,{\rm{ + }}\,{\rm{y}}\,\,{\rm{ = }}\,\,{{\rm{5}} \over{\rm{7}}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{(2)}}} \cr} } \right.\)
Thế (2) vào (1) => x = 0,09779 => mP2O5 = 142. 0,9779 = 13,88 (gam) ≈ 14(gam)
Đáp án A
Câu hỏi 7 :
Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32% thu được muối Na2HPO4. Giá trị của m là:
- A
75.
- B
50.
- C
100.
- D
25.
Đáp án: B
Lời giải chi tiết:
Do phản ứng là vừa đủ nên :
2nP = 2nNa2HPO4 = nNaOH ( bảo toàn nguyên tố )
=> nNaOH = 2.6,2 : 31 = 0,4 mol
=> m = \(\frac{{0,4.40.100}}{{32}} = 50g\)
Đáp án B
Câu hỏi 8 :
Cho m gam P2O5 vào 1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M, sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn cẩn thận X thu được 35,4 gam hỗn hợp muối khan. Giá trị của m là
- A
28,4 gam.
- B
7,1 gam.
- C
21,3 gam.
- D 14,2 gam.
Đáp án: D
Lời giải chi tiết:
Xét H3PO4 phản ứng với bazo => nH2O = nOH = 0,5 mol
Bảo toàn khối lượng : mH3PO4 + mNaOH + mKOH = mmuối + mH2O
=> nH3PO4 = 19,6g => nP2O5 = ½ nH3PO4 = 0,1mol
=> m = 14,2g
Đáp án D
Câu hỏi 9 :
Khi cho 0,1 mol P2O5 vào 250 ml dd NaOH 1,2M thì thu được dd chứa những chất tan gì ?
- A Na3PO4 và NaOH
- B Na3PO4 và Na2HPO4
- C Na2HPO4 và NaH2PO4
- D NaH2PO4 và H3PO4
Đáp án: C
Phương pháp giải:
Phương pháp:
+T 2 : NaH2PO4
+ 2<T<4 : NaH2PO4 ,Na2HPO4
+ 4<T<6: Na2HPO4 ,Na3PO4
+ T 6: Na3PO4
Lời giải chi tiết:
Hướng dẫn giải:
nNaOH = 0,25.1,2=0,3mol
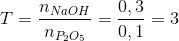
=> 2<T<4 tạo 2 muối NaH2PO4 ,Na2HPO4
=> dung dịch gồm NaH2PO4 ,Na2HPO4
=> chọn C
Đáp án C
Câu hỏi 10 :
Đốt hoàn toàn a gam photpho trong oxi dư, rồi cho sản phẩm tác dụng với dung dịch NaOH dư, thu được 82,0 gam muối. Giá trị của a là
- A 82,0.
- B 31,0.
- C 15,5.
- D 46,5.
Đáp án: C
Phương pháp giải:
Bảo toàn nguyên tố P: nP = nNa3PO4
Lời giải chi tiết:
4P + 5O2 → 2P2O5
P2O5 + 6NaOH dư → 2Na3PO4 + 3H2O
=> nNa3PO4 = 82/164 = 0,5 (mol)
BTNT P => nP = nNa3PO4 = 0,5 (mol) => mP = 0,5.31 = 15,5 (gam)
Đáp án C
Câu hỏi 11 :
Đốt cháy hoàn toàn m gam photpho trong oxi dư, sau phản ứng thu được rắn X. Cho toàn bộ X vào dung dịch KOH, sau phản ứng, cô cạn dung dịch thu được (m + 13,45) gam rắn. Dung dịch sau phản ứng chứa:
- A K3PO4 và KOH.
- B K3PO4 và K2HPO4.
- C K2HPO4 và KH2PO4.
- D KH2PO4 và H3PO4.
Đáp án: C
Lời giải chi tiết:
Đáp án C
Câu hỏi 12 :
Cho 2,13 gam P2O5 vào dung dịch chứa x mol NaOH và 0,02 mol Na3PO4 . Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 6,88 gam hai chất tan. Giá trị của x là
- A 0,057.
- B 0,030.
- C 0,050.
- D 0,139.
Đáp án: B
Lời giải chi tiết:
*Giả sử chỉ tạo muối NaH2PO4 => nNaH2PO4 = nP = 0,015.2 + 0,02 = 0,05 mol
=> m1 = 0,05.120 = 6 (g)
*Giả sử chỉ tạo muối Na2HPO4 => nNa2HPO4 = nP = 0,015.2 + 0,02 = 0,05 mol
=> m2 = 0,05.142 = 7,1 (g)
*Giả sử chỉ tạo muối Na3PO4 => nNa3PO4 = nP = 0,015.2 + 0,02 = 0,05 mol
=> m3 = 0,05.164 = 8,2 (g)
Thấy m1 < m < m2 => Tạo 2 muối NaH2PO4 (x mol) và Na2HPO4 (y mol)
Ta có:
\(\left\{ \begin{gathered}
x + y = {n_P} = 0,05 \hfill \\
142x + 120y = 6,88 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,04 \hfill \\
y = 0,01 \hfill \\
\end{gathered} \right.\)
BT “Na”: nNaOH = nNaH2PO4 + 2nNa2HPO4 – 3nNa3PO4 = 0,03 mol
Đáp án B
Câu hỏi 13 :
Hòa tan m gam P2O5 vào 500 ml dung dịch NaOH 1M, sau phản ứng hoàn toàn thu được dung dịch X chứa 2 chất tan có nồng độ CM bằng nhau. Nếu thêm dung dịch CaCl2 dư vào X thì sau phản ứng trong dung dịch chỉ còn muối Cl-. Giá trị của m là:
- A 7,1 gam.
- B 28,4 gam.
- C 14,2 gam.
- D 21,3 gam.
Đáp án: C
Phương pháp giải:
Nếu thêm dung dịch CaCl2 dư vào X thì sau phản ứng trong dung dịch chỉ còn muối Cl- tức là 2 chất trong X đều có anion tạo kết tủa với Ca2+
→ Dung dịch X chứa HPO42- (x mol) và PO43- (x mol)
H3PO4 + 2OH- → HPO42- + 2H2O
H3PO4 + 3OH- → PO43- + 3H2O
Từ số mol OH- tính được số mol HPO42- và số mol PO43-. Dùng bảo toàn nguyên tố P để tìm số mol P2O5 và tính khối lượng P2O5.
Lời giải chi tiết:
Nếu thêm dung dịch CaCl2 dư vào X thì sau phản ứng trong dung dịch chỉ còn muối Cl- tức là 2 chất trong X đều có anion tạo kết tủa với Ca2+
→ Dung dịch X chứa HPO42- (x mol) và PO43- (x mol)
H3PO4 + 2OH- → HPO42- + 2H2O
2x x mol
H3PO4 + 3OH- → PO43- + 3H2O
3x x mol
Ta có: nOH- = 2x + 3x = 5x = 0,5 mol → x = 0,1 mol → nH3PO4 = x + x = 0,2 mol → nP2O5 = 0,1 mol
→ mP2O5 = 0,1 . 142 = 14,2 gam
Đáp án C
Câu hỏi 14 :
Hòa tan hết 17,94 gam một kim loại kiềm vào một lượng nước dư thu được dung dịch X. Cho dung dịch X tác dụng với 36,92 gam P2O5 thì thu được dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau. Kim loại kiềm là:
- A Na
- B Rb
- C K
- D Li
Đáp án: A
Phương pháp giải:
Gọi kim loại kiềm cần tìm là M.
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
P2O5 + 3H2O → 2H3PO4
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4
TH2: Hai muối là M2HPO4 và M3PO4
Bảo toàn nguyên tố M để tìm được số mol M, từ đó tính được khối lượng mol của M.
Lời giải chi tiết:
nH3PO4 = 2nP2O5 = 2.36,92/142 = 0,52 mol
Gọi kim loại kiềm cần tìm là M.
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
P2O5 + 3H2O → 2H3PO4
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4
Dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau →n MH2PO4 = nM2HPO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = nMH2PO4 + 2n M2HPO4 = 0,78 mol → M = 17,94/0,78 = 23 (Na)
TH2: Hai muối là: M2HPO4 và M3PO4 → n M2HPO4 = n M3PO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = 2nM2HPO4 + 3nM3PO4 = 1,3 mol → M = 17,94/1,3 = 13,8 (loại)
Vậy kim loại kiềm cần tìm là Na.
Đáp án A
Câu hỏi 15 :
Cho 17,04 gam P2O5 vào 200 ml dung dịch NaOH nồng độ aM thu được dung dịch có tổng khối lượng các chất tan bằng 30,12 gam. Giá trị của a là:
- A 0,6.
- B 0,9.
- C 1,2.
- D 1,5.
Đáp án: D
Phương pháp giải:
P2O5 + 3H2O → 2H3PO4 (1)
H3PO4 + NaOH → NaH2PO4 + H2O (2)
H3PO4 + 2NaOH → Na2HPO4 + 2H2O (3)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (4)
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
Ta xét các trường hợp sau:
Trường hợp 1: Khi đó chất tan thu được chứa H3PO4 dư và NaH2PO4
Trường hợp 2: Chất tan thu được chứa 2 muối.
Trường hợp 3: Chất tan thu được chứa Na3PO4và NaOH dư
Từ đó ta tìm được giá trị a.
Lời giải chi tiết:
P2O5 + 3H2O → 2H3PO4 (1)
Ta có: nH3PO4 = 2.nP2O5 = 0,24 mol; nNaOH = 0,2 a (mol)
H3PO4 + NaOH → NaH2PO4 + H2O (2)
H3PO4 + 2NaOH → Na2HPO4 + 2H2O (3)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (4)
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
Ta xét các trường hợp sau:
Trường hợp 1: Nếu (*) ≤ 1 → 0,2a / 0,24 ≤ 1→ a ≤ 1,2.
Khi đó chất tan thu được chứa (0,24 – 0,2a) mol H3PO4 dư và 0,2a mol NaH2PO4
→ mchất tan = (0,24 – 0,2a) . 98 + 0,2a . 120 = 30,12 gam → a = 1,5 (Loại)
Trường hợp 2:
+ Nếu 1 < (*) < 3 → 1 < 0,2a / 0,24 < 3 → 1,2 < a < 3,6
Khi đó nNaOH = nH2O = 0,2a (mol)
Dùng định luật bảo toàn khối lượng ta có: mH3PO4 + mNaOH = mmuối + mH2O
→ 0,24 . 98 + 0,2a . 40 = 30,12 + 0,2a . 18 → a = 1,5 (thỏa mãn)
+ Nếu (*) ≥ 3 → 0,2a / 0,24 ≥ 3 → a ≥ 3,6
→ Khi đó chất tan thu được chứa 0,24 mol Na3PO4và (0,2a – 0,24.3) mol NaOH dư
→ mchất tan = 0,24 . 164 + mNaOH dư > 30,12 gam → Loại
Vậy giá trị của a = 1,5.
Đáp án D
Câu hỏi 16 :
Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
- A 0,214
- B 0,286
- C 0,429
- D 0,143
Đáp án: A
Phương pháp giải:
P2O5 + 3H2O → 2 H3PO4
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nNaOH
Áp dụng định luật bảo toàn khối lượng ta tính được khối lượng H3PO4, từ đó tính được giá trị m và tỉ lệ mol của P2O5 và NaOH.
Lời giải chi tiết:
P2O5 + 3H2O → 2 H3PO4
m/142 2m/142 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nNaOH = 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4 = mmuối + mH2O → 0,7.40 + (2m/142).98 = 2,1033m + 0,7.18 → m = 21,3 gam
→ nP2O5 = 0,15 mol.
Do đó ta có tỉ lệ \(\frac{{{n_{P2O5}}}}{{{n_{NaOH}}}} = \frac{{0,15}}{{0,7}} = 0,214\)
Đáp án A
Câu hỏi 17 :
Tính số mol P2O5 cần thêm vào 0,3 lít dung dịch hỗn hợp KOH 1M và NaOH 1M để sau phản ứng thu được dung dịch chứa hai anion HPO42- và H2PO4- với số mol bằng nhau:
- A 0,1
- B 0,2
- C 0,3
- D 0,4
Đáp án: B
Phương pháp giải:
P2O5+ 3H2O → 2 H3PO4 (1)
OH-+ H3PO4 →H2PO4-+ H2O (2)
2OH-+ H3PO4 → HPO42-+ 2H2O (3)
Từ số mol OH- tìm được số mol H2PO4- và HPO42-
Dùng bảo toàn nguyên tố P để tìm số mol P2O5.
Lời giải chi tiết:
P2O5+ 3H2O → 2 H3PO4 (1)
Tổng số mol OH- có trong dung dịch là 0,3.1 + 0,3.1 = 0,6 mol
Đặt số mol HPO42- là x mol, số mol H2PO4- là x mol
OH- + H3PO4 → H2PO4- + H2O (2)
2OH- + H3PO4 → HPO42- + 2H2O (3)
Theo PT (2), (3) có nOH- = nH2PO4-+ 2nHPO4(2-) = x + 2x = 3x (mol) = 0,6
Suy ra x = 0,2 mol→ nH3PO4 PT (2), (3) = x + x = 0,4 mol
→nP2O5 = ½. nH3PO4 = 0,2 mol
Đáp án B
Câu hỏi 18 :
Cho 4,26 gam P2O5 vào dung dịch chứa x mol KOH và 0,04 mol K3PO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 16,64 gam hai chất tan. Giá trị của x là
- A 0,150.
- B 0,099.
- C 0,060.
- D 0,139.
Đáp án: C
Phương pháp giải:
nP2O5 = 4,26/142 = 0,03 mol
- Nếu chỉ tạo KH2PO4 → mchất tan = m1 = ?
- Nếu chỉ tạo K2HPO4 → mchất tan = m2 = ?
- Nếu chỉ tạo K3PO4 → mchất tan = m2 = ?
So sánh khối lượng chất tan của đề bài với m1, m2, m3:
+ Nếu m < m1 thì tạo KH2PO4 và H3PO4 dư
+ Nếu m = m1 thì chỉ tạo KH2PO4
+ Nếu m1 < m < m2 thì tạo KH2PO4 và K2HPO4
+ Nếu m = m2 thì tạo K2HPO4
+ Nếu m2 < m < m3 thì tạo K2HPO4 và K3PO4
+ Nếu m = m3 thì tạo K3PO4
+ Nếu m > m3 thì tạo K3PO4 và KOH còn dư
Lời giải chi tiết:
nP2O5 = 4,26/142 = 0,03 mol
- Nếu chỉ tạo KH2PO4 thì bảo toàn P ta có nKH2PO4 = 2nP2O5 + nK3PO4 bđ = 0,1 mol
→ mchất tan = m1 = 0,1.136 = 13,6 gam
- Nếu chỉ tạo K2HPO4 thì bảo toàn P ta có nK2HPO4 = 2nP2O5 + nK3PO4 bđ = 0,1 mol
→ mchất tan = m2 = 0,1.174 = 17,4 gam
- Nếu chỉ tạo K3PO4 thì bảo toàn P ta có nK3PO4 = 2nP2O5 + nK3PO4 bđ = 0,1 mol
→ mchất tan = m2 = 0,1.212 = 21,2 gam
Ta thấy: m1 < 16,64g < m2 → chất tan chứa KH2PO4 (a) và K2HPO4 (b)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}a + b = 0,1\left( {BT:P} \right)\\136{\rm{a}} + 174b = 16,64\end{array} \right. \to \left\{ \begin{array}{l}a = 0,02\\b = 0,08\end{array} \right.\)
Bảo toàn K → nKOH bđ + 3nK3PO4 bđ = nKH2PO4 +2nK2HPO4
→ x + 3.0,04 = 0,02 + 2.0,08
→ x = 0,06
Đáp án C
Câu hỏi 19 :
Hòa tan hoàn toàn 6,035 gam P2O5 vào V lít dung dịch X gồm NaOH 1M và KOH 1M. Sau khi kết thúc phản ứng thu được dung dịch Y, cô cạn dung dịch Y thu được 14,33 gam muối. Giá trị của V là:
- A 0,1
- B 0,2
- C 0,3
- D 0,4
Đáp án: A
Phương pháp giải:
P2O5 + 3H2O → 2H3PO4
Vì trong dung dịch Y sau khi cô cạn thu được sau phản ứng chỉ chứa muối nên lượng kiềm và axit phản ứng hết. Do đó nH2O = nOH- = 2V (mol)
Dùng bảo toàn khối lượng ta có mH3PO4 + mKOH + mNaOH = mmuối + mH2O
Từ đó tính được giá trị V.
Lời giải chi tiết:
Ta có: nP2O5 = 0,0425 mol, nH3PO4 = 0,085 mol, nKOH + NaOH = 2V (mol)
P2O5 + 3H2O → 2H3PO4
Vì trong dung dịch Y sau khi cô cạn thu được sau phản ứng chỉ chứa muối nên lượng kiềm và axit phản ứng hết.
Do đó nH2O = nOH- = 2V (mol)
Bảo toàn khối lượng ta có mH3PO4 + mKOH + mNaOH = mmuối + mH2O
→ 0,085 . 98 + 56V + 40V = 14,33 + 2V.18 → V = 0,1 lít
Đáp án A
Câu hỏi 20 :
Hoàn tan 17,75 gam bột màu trắng điphotpho pentaoxit vào 200 gam dung dịch H3PO4 9,8%, sau phản ứng hoàn toàn thu được dung dịch X. Tính nồng độ % của chất tan có trong dung dịch X?
- A 19,25%
- B 19,65%
- C 20,25%
- D 20,55%
Đáp án: C
Phương pháp giải:
P2O5 + 3H2O → 2H3PO4 (1)
Tổng khối lượng chất tan H3PO4 có trong dung dịch X là khối lượng H3PO4 sinh ra ở phản ứng (1) và khối lượng H3PO4 có trong 200 gam dung dịch H3PO4 9,8%.
Khối lượng dung dịch X là mdung dịch X = mP2O5 + mdd H3PO4
Từ đó ta tính được C % của H3PO4 trong dung dịch X là C%H3PO4 = mct.100%/mdd.
Lời giải chi tiết:
P2O5 + 3H2O → 2H3PO4
Ta có: nP2O5 = 17,75 : 142 = 0,125 mol → nH3PO4 = 2.nP2O5 = 0,25 mol
Khối lượng H3PO4 trong 200 gam dung dịch H3PO4 9,8% là: mH3PO4 = 200 . 9,8/100 = 19,6 (g)
Tổng khối lượng chất tan H3PO4 có trong dung dịch X là mH3PO4 = 0,25 . 98 + 19,6 = 44,1 (gam)
Khối lượng dung dịch X là mdung dịch X = mP2O5 + mdd H3PO4 = 17,75 + 200 = 217,75 (gam)
Nồng độ % của H3PO4 trong dung dịch X là C%H3PO4 = 44,1.100%/217,75 = 20,25%
Đáp án C
30 câu hỏi lý thuyết về axit photphoric - Muối photphat hay nhất có đáp án và lời giải chi tiết
20 bài tập vận dụng cao về axit photpphoric và muối photphat hay nhất có đáp án và lời giải chi tiết
40 bài tập về axit phophoric tác dụng với dung dịch kiềm hay nhất có đáp án và lời giải chi tiết
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









