20 bài tập về điều chế NH3 có lời giải
Làm đề thiCâu hỏi 1 :
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hidro để điều chế 17 gam NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
- A 44,8 lít N2 và 134,4 lít H2
- B 22,4 lít N2 và 67,2 lít H2
- C 22,4 lít N2 và 134,4 lít H2
- D 44,8 lít N2 và 67,2 lít H2
Đáp án: A
Lời giải chi tiết:
nNH3 = 17 : 17 = 1 mol
PTHH: N2 + 3H2 \(\rightleftharpoons \) 2NH3
0,5 ← 1,5 ← 1 (mol)
Do hiệu suất phản ứng H = 25% nên lượng cần dùng lớn hơn lượng tính toán được:
nN2 cần dùng = 0,5.(100/25) = 2 mol => V N2 cần dùng = 44,8 lít
nH2 cần dùng = 1,5.(100/25) = 6 mol => V H2 cần dùng = 134,4 lít
Đáp án A
Câu hỏi 2 :
Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua dd H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là :
- A 25% H2, 25% N2, 50% NH3
- B 50% H2, 25% N2, 25% NH3
- C 25% H2, 50% N2, 25% NH3
- D 30%N2, 20%H2, 50% NH3
Đáp án: A
Lời giải chi tiết:
NH3 bị hấp thụ bởi H2SO4
3NH3 + H2SO4 → (NH4)2SO4
Lấy 1 mol hỗn hợp
=> nNH3 = 0.5
nH2=x; nN2 = y
x +y = 0.5
2x + 28y = 8 . 2 -17 . 0.5
=> x=y=0.25
%NH3 = 50%
%N2=%H2 = 25%
Đáp án A
Câu hỏi 3 :
Trong một bình kín dung tích không đổi chứa khí N2 và H2 với tỉ lệ thể tích 1:2. Đốt nóng bình sau một thời gian để xảy ra phản ứng N2 (k) + 3H2 (k)  2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là
2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là
- A 37,5%.
- B 50,5%.
- C 75%.
- D 25%.
Đáp án: A
Phương pháp giải:
Tính toán theo PTHH.
Lời giải chi tiết:
Giả sử số mol N2 là 1 mol, số mol H2 là 2 mol, hiệu suất phản ứng là h.
N2 (k) + 3H2 (k)  2NH3 (k)
2NH3 (k)
Bđ: 1 2 (Ta thấy: 1/1 > 2/3 => Hiệu suất tính theo H2)
Pư: 2h/3 ← 2h → 4h/3
Sau: 1-2h/3 2-2h 4h/3
Số mol khí sau phản ứng: ns = 1-2h/3 + 2 - 2h + 4h/3 = 3 - 4h/3 (mol)
Ta có: \(\frac{{{p_s}}}{{{p_d}}} = \frac{{{n_s}}}{{{n_d}}} \Rightarrow \frac{{3{\rm{ }} - {\rm{ }}\frac{{4h}}{3}}}{{1 + 2}} = \frac{5}{6} \Rightarrow h = 0,375 = 37,5\% \)
Đáp án A
Câu hỏi 4 :
Một hỗn hợp gồm 8 mol N2 và 14 mol H2 được nạp vào một bình kín có dung tích 4 lít và giữ ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng thì áp suất bằng 10/11 áp suất ban đầu. Hiệu suất tổng hợp NH3 là
- A 17,18%.
- B 18,18%.
- C 22,43%.
- D 21,43%.
Đáp án: D
Phương pháp giải:
Tính theo PTHH: N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Lời giải chi tiết:
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 8 14 (Ta thấy: 8/1 > 14/3 nên hiệu suất tính theo H2)
Phản ứng: x 3x 2x
Sau: 8-x 14-3x 2x
Ta có: n đầu = 8 + 14 = 22 mol và n sau = (8-x) + (14-3x) + 2x = 22 - 2x (mol)
Khi hiệu suất không đổi thì: \(\frac{{{n}_{sau}}}{{{n}_{dau}}}=\frac{{{p}_{sau}}}{{{p}_{dau}}}\Rightarrow \frac{22-2\text{x}}{22}=\frac{10}{11}\Rightarrow x=1\)
→ nH2 pư = 3x = 3 mol
→ H = \(\frac{{{n}_{{{H}_{2}}pu}}}{{{n}_{{{H}_{2}}b\text{d}}}}.100%\) = \(\frac{3}{14}.100%\) = 21,43%
Đáp án D
Câu hỏi 5 :
Cho 2 mol N2 và 8 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 8 mol hỗn hợp khí. Hiệu suất của quá trình tổng hợp amoniac trên là
- A 30%
- B 40%
- C 50%
- D 60%
Đáp án: C
Phương pháp giải:
Đặt hiệu suất là h
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 2 8
Phản ứng: 2h → 6h → 4h
CB: 2-2h 8-6h 4h
Số mol khí tại thời điểm cân bằng là 8 mol suy ra phương trình ẩn h.
Lời giải chi tiết:
Đặt hiệu suất là h
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 2 8
Phản ứng: 2h → 6h → 4h
CB: 2-2h 8-6h 4h
Số mol khí tại thời điểm cân bằng là 8 mol nên ta có:
2 - 2h + 8 - 6h + 4h = 8 → h = 0,5 = 50%
Đáp án C
Câu hỏi 6 :
Hỗn hợp X gồm N2 và H2 có dX/H2 = 3,6. Sau khi tiến hành tổng hợp NH3 thu được hỗn hợp Y có dY/H2 = 4. Hiệu suất tổng hợp NH3 là
- A 20%
- B 25%
- C 30%
- D 32%
Đáp án: B
Lời giải chi tiết:
\({{\overline{M}}_{X}}=3,6.2=7,2;\,\,\,\,\,\,\,\,\,\,\,\,{{\overline{M}}_{Y}}=4.2=8\)
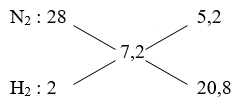
→ \(\frac{{{n}_{{{N}_{2}}}}}{{{n}_{{{H}_{2}}}}}=\frac{5,2}{20,6}=\frac{1}{4}\)
Giả sử có 1 mol N2 và 4 mol H2
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 1 4 (Ta thấy: 1/1 < 4/3 nên hiệu suất tính theo N2)
Phản ứng: x → 3x → 2x
Sau: 1-x 4-3x 2x
→ n sau = 1 - x + 4 - 3x + 2x = 5 - 2x (mol)
Ở nhiệt độ không đổi thì:\(\frac{{{n}_{\text{truoc}}}}{{{n}_{\text{sau}}}}=\frac{{{\overline{M}}_{sau}}}{{{\overline{M}}_{\text{truoc}}}}\to \frac{5}{5-2x}=\frac{8}{7,2}\to x=0,25\)
\(\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{0,25}}{1}.100\% = 25\% \)
Đáp án B
Câu hỏi 7 :
Hỗn hợp A gồm N2, H2 với tỉ lệ 1 : 3, tạo phản ứng giữa N2 và H2 cho ra NH3 với hiệu suất H% thu được hỗn hợp khí B. Tỉ khối của A so với B là 0,6. Giá trị của H% là
- A 50%
- B 60%
- C 70%
- D 80%
Đáp án: D
Lời giải chi tiết:
Giả sử có 1 mol N2 và 3 mol H2
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 1 3 (Ta thấy: 1/1 = 3/3 nên hiệu suất tính theo N2 hay H2 đều được)
Phản ứng: x → 3x → 2x
Sau: 1-x 3-3x 2x
Ta có: nA = 1 + 3 = 4 mol; nB = 1 - x + 3 - 3x + 2x = 4 - 2x (mol)
Ở nhiệt độ không đổi thì: \(\frac{{{p_{\text{A}}}}}{{{p_{\text{B}}}}} = \frac{{{n_B}}}{{{n_{\text{A}}}}} \to \frac{{4 - 2x}}{4} = 0,6 \to x = 0,8\)
→ \(\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{0,8}}{1}.100\% = 80\% \)
Đáp án D
Câu hỏi 8 :
Cho 30 lít N2 phản ứng với 30 lít H2 trong điều kiện thích hợp sẽ tạ ra V thể tích NH3 (đktc) khi hiệu suất phản ứng đạt 30% thì giá trị của V là
- A 12 lít
- B 15 lít
- C 6 lít
- D 15 lít
Đáp án: C
Lời giải chi tiết:
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu (lít): 30 30 (Ta thấy: 30/1 > 30/3 nên hiệu suất tính theo H2)
Do đó: VH2 pư = 30.30% = 9 lít
Theo PTHH: VNH3 thu được = 2/3.VH2 pư = 2/3.9 = 6 lít
Đáp án C
Câu hỏi 9 :
Hỗn hợp A gồm 2 chất khí N2 và H2 có tỉ lệ mol 1 : 4. Nung A với xúc tác ta được hỗn hợp khí B, trong đó sản phẩm NH3 chiếm 20% theo thể tích (biết các khí đo cùng điều kiện). Hiệu suất phản ứng tổng hợp NH3 là
- A 43,76%
- B 20,83%
- C 41,67%
- D 48,62%
Đáp án: C
Lời giải chi tiết:
Giả sử có 1 mol N2 và 4 mol H2
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 1 4 (Ta thấy: 1/1 < 4/3 nên hiệu suất tính theo N2)
Phản ứng: x → 3x → 2x
Sau: 1-x 4-3x 2x
→ ∑nsau = 1 - x + 4 - 3x + 2x = 5 - 2x (mol)
Trong hỗn hợp sau phản ứng, NH3 chiếm 20% theo thể tích nên ta có:
\(\frac{{2{\text{x}}}}{{5 - 2{\text{x}}}}.100\% = 20\% \) → x = 5/12
→ nN2 pư = x = 5/12 mol
→ \(\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{5/12}}{1}.100\% = 41,67\% \)
Đáp án C
Câu hỏi 10 :
Hỗn hợp X gồm N2 và H2 có tỉ khối so với hiđro là 6,2. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. Tỉ khối của Y so với H2 có giá trị là :
- A 14,76.
- B 18,23.
- C 7,38.
- D 13,48.
Đáp án: C
Lời giải chi tiết:
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
\(\,{{{n_{{N_2}}}} \over {{n_{{H_2}}}}} = {2 \over 3}\)
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn \(\left\{ \matrix{{n_{{N_2}}} = 2\,\,mol \hfill \cr {n_{{H_2}}} = 3\,\,mol \hfill \cr} \right.\)
nH2 pư = 3 . 40% = 1,2 mol,
n N2 phản ứng = 0,4 mol
n NH3 sinh ra =0,8 mol.
\({n_Y} = {n_X} - 0,8 = 2 + 3 - 0,8 = 4,2\,\,mol.\)
Bảo toàn khối lượng :
=>\({\overline M _Y} = {{{m_Y}} \over {{n_Y}}} = {{62} \over {4,2}}= 14,76.\)
Vậy tỉ khối của Y với H2 là 7,38
Đáp án C
Câu hỏi 11 :
Cần lấy bao nhiêu lít khí nitơ và hiđro để điều chế được 67,2 lít khí amoniac, biết các thể tích đo cùng điều kiện và hiệu suất phản ứng là 25%.
- A VN2 = 6 (lít) và VH2 = 18 (lít).
- B VN2 = 134,4 (lít) và VH2 = 403,2 (lít)
- C VN2 = 33,6 (lít) và VH2 = 100,8 (lít).
- D VN2 = 8,4 (lít) và VH2 = 25,2 (lít).
Đáp án: B
Phương pháp giải:
Công thức tính hiệu suất của phản ứng
H = (nTT/nLT).100%
Lời giải chi tiết:
PTHH: N2 + 3H2 → 2NH3
PT: 1 3 2 (lít)
Pư: 33,6 ← 100,8 ← 67,2 (lít)
Do H = 25% nên lượng N2 và H2 cần lấy là:
VN2 = 33,6.(100/25) = 134,4 lít
VH2 = 100,8.(100/25) = 403,2 lít
Đáp án B
Câu hỏi 12 :
Trộn 10 lít N2 với 15 lít H2 cho vào bình phản ứng. Sau khi phản ứng đạt cân bằng thấy bình phản ứng có 22 lít hỗn hợp các khí. Các khí đo ở cùng điều kiện nhiệt độ và áp suất. Hiệu suất phản ứng là:
- A
30%
- B
20%
- C
22,5%
- D
25%
Đáp án: A
Lời giải chi tiết:
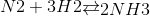
Ban đầu: 10 15 0
Phản ứng x 3x 2x
Cân bằng 10 - x 15 - 3x 2x
Σ V cb = 25 – 2x = 22 => x = 1,5 => H = $\frac{{1,5.3}}{{15}}$.100% = 30%
Đáp án A
Câu hỏi 13 :
Hỗn hợp X gồm N2 và H2, tỉ khối của X so với He bằng 1,8. Nung nóng (bột sắt xúc tác) hỗn hợp X sau một thời gian được hỗn hợp khí Y, tỉ khối của Y so với He bằng 2,25. Hiệu suất phản ứng là ?
- A
50%.
- B
25%.
- C
37,5%.
- D 75%.
Đáp án: A
Lời giải chi tiết:
Có MX = 7,2 => nN2 : nH2 = 1 : 4
Giả sử nN2 = 1 ; nH2 = 4 mol
N2 + 3H2 → 2NH3
a → 3a → 2a mol
=> nhh sau = 5 – 2a
Vì khối lượng khí trong bình không đổi => mX = mY
=> MX : MY = nY : nX
=> 1,8 : 2,25 = (5 – 2a) : 5
=> a = 0,5 mol
=> H% = H%N2 = 50% ( tính theo chất có H% lớn hơn)
Đáp án A
Câu hỏi 14 :
Cho 4 lít N2; 14 lít H2 vào bình phản ứng hỗn hợp thu được sau phản ứng có thể tích 16,4 lít (đktc). Hiệu suất của phản ứng tổng hợp NH3 là:
- A 50%
- B 20%
- C 80%
- D 30%
Đáp án: B
Phương pháp giải:
N2 + 3 H2 -> 2NH3
có 4 14
p/u x 3x 2x
sau 4-x 14-3x 2x
nsau =16,4
=> x
So sánh để xem tính hiệu suất theo N2 hay H2
Lời giải chi tiết:
N2 + 3 H2 -> 2NH3
có 4 14
p/u x 3x 2x
sau 4-x 14-3x 2x
4-x + 14-3x+ 2x=16,4
=> 18-2x=16,4
=> x=0,8
Tính hiệu suất theo N2 vì lượng H2 dư nhiều hơn (N2: 4mol, H2: 14 mol)
=> H=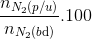 =
= 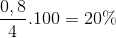
Đáp án B
Câu hỏi 15 :
Cho 4 mol N2 và 16 mol H2 vào bình kín. Tại thời điểm cân bằng thu được x mol hỗn hợp khí. Biết hiệu suất của phản ứng tổng hợp NH3 là 70%. Tính x?
- A 14,1
- B 14,4
- C 14,3
- D 14,2
Đáp án: B
Phương pháp giải:
Phương pháp:
=> H tính theo N2
H= mol
N2 + 3 H2 <-> 2NH3
Thay vào PT tính số mol hỗn hợp sau phản ứng
Lời giải chi tiết:
Hướng dẫn giải
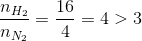
=> H tính theo N2
H= 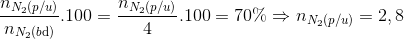 mol
mol
N2 + 3 H2 <-> 2NH3
bđ 4 16
p/u 2,8 8,4 5,6
sau 1,2 7,6 5,6
=> x=14,4 mol
Đáp án B.
Câu hỏi 16 :
Cho 6 mol N2 và 20 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 18 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 trên.
- A 75%
- B 50,67%
- C 66,67%
- D 85%
Đáp án: C
Phương pháp giải:
Phương pháp:
N2 + 3 H2 <-> 2NH3
có 6 20
p/u x 3x 2x
sau 6-x 20-3x 2x
=> nsau =18 => x
=> Tính H theo N2
=> H
Lời giải chi tiết:
Hướng dẫn giải:
N2 + 3 H2 <-> 2NH3
có 6 20
p/u x 3x 2x
sau 6-x 20-3x 2x
6-x + 20-3x+ 2x=18
=> 26-2x=18
=> x=4
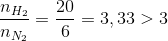 => Tính H theo N2
=> Tính H theo N2
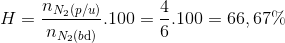
Đáp án C.
Câu hỏi 17 :
Hỗn hợp X gồm: N2 và H2 với tỉ lệ mol là 1 : 4. Nung hỗn hợp X ở điều kiện thích hợp để phản ứng xảy ra. Biết hiệu suất phản ứng là 40%. Phần trăm theo thể tích của amoniac (NH3) trong hỗn hợp thu được sau phản ứng là:
- A 16,04%.
- B 17,04%.
- C 18,04%.
- D 19,04%.
Đáp án: D
Lời giải chi tiết:

Câu hỏi 18 :
X là hỗn hợp khí H2 và N2 có tỉ khối đối với oxi bằng 0,225. Dẫn X vào bình có xúc tác bột sắt, đun nóng thì thu được hỗn hợp khí Y có tỷ khối đối với oxi bằng 0,25. Tính hiệu suất tổng hợp NH3
- A 25%.
- B 30%.
- C 15%.
- D 20%.
Đáp án: A
Phương pháp giải:
- Phương pháp đường chéo để tính tỉ lệ mol các khí
- Viết và tính theo PTHH
Lời giải chi tiết:
MX = 0,225.32 = 7,2
H2: 2 20,8
7,2 => nH2/nN2 = 20,8/5,2 = 4
N2: 28 5,2
Giả sử nH2 = 4 mol và nN2 = 1 mol
BTKL: mX = mY => 4.2 + 1.28 = nY.0,25.32 => nY = 4,5 mol
3H2 + N2 \(\overset {{t^o},xt} \leftrightarrows \) 2NH3
Bđ: 4 1 (mol)
Pư: 3x x 2x (mol)
Sau: 4-3x 1-x 2x (mol)
nY = 4-3x + 1-x + 2x = 4,5 => x = 0,25 mol
Hiệu suất tính theo N2 => H = (0,25/1.100%) = 25%
Đáp án A
Câu hỏi 19 :
Hỗn hợp X gồm N2 và H2 có tỉ khối hơi so với H2 là 3,6. Cho hỗn hợp X vào bình kín với xúc tác thích hợp rồi thực hiện phản ứng tổng hợp NH3 thấy thu được hỗn hợp Y gồm N2, H2 và NH3. Biết tỉ khối hơi của Y so với H2 bằng 4. Hiệu suất phản ứng tổng hợp NH3 trong phản ứng trên là
- A 30%.
- B 15%.
- C 20%.
- D 25%.
Đáp án: D
Phương pháp giải:
Sử dụng quy tắc đường chéo
PTHH: N2 + 3H2 \(\underset{{}}{\overset{{{t^0},p,xt}}{\longleftrightarrow}}\) 2NH3
\(\frac{{ntrc}}{{n\,sau}} = \frac{{Msau}}{{M\,truoc}}\)
Hiệu suất tính theo N2 hoặc H2 với điều kiện là chất nào phản ứng hết nếu H =100%
Lời giải chi tiết:
MX = 3,6.2 = 7,2 (g/mol) ; MY = 4.2 = 8 (g/mol)
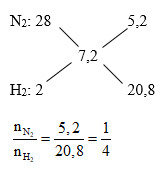
Coi hỗn hợp ban đầu có 5 mol thì nN2 = 1 (mol); nH2 = 4 (mol)
Gọi số mol của N2 pư là x (mol)
PTHH: N2 + 3H2 \(\underset{{}}{\overset{{{t^0},p,xt}}{\longleftrightarrow}}\) 2NH3
PƯ x → 3x 2x => số mol giảm là 2x (mol)
=> số mol sau pư: nsau = ntrước - ngiảm = 5 – 2x (mol)
Ta có:
\(\begin{gathered}
\frac{{ntrc}}{{n\,sau}} = \frac{{Msau}}{{M\,truoc}} \Rightarrow \frac{5}{{5 - 2x}} = \frac{8}{{7,2}} \hfill \\
\Rightarrow 36 = 40 - 16x \hfill \\
\Rightarrow x = 0,25\,(mol) \hfill \\
\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{0,25}}{1}.100\% = 25\% \hfill \\
\end{gathered} \)
Đáp án D
Câu hỏi 20 :
Cho phản ứng: N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/l, N2 là 0,05 mol/l và của H2 là 0,10 mol/l thì hằng số cân bằn của phản ứng là
- A 18.
- B 60.
- C 3600.
- D 1800.
Đáp án: A
Phương pháp giải:
Áp dụng công thức tính hằng số cân bằng: \(Kc = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}} = ?\) với [NH3]; [N2]; [H2] là nồng độ mol/l của các chất đó ở trạng thái cân bằng.
Lời giải chi tiết:
N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k).
Áp dụng công thức tính hằng số cân bằng:
\(Kc = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}} = \frac{{0,{3^2}}}{{0,05.0,1}} = 18\)
Đáp án A
30 bài tập về amoniac và muối amoni hay nhất có đáp án và lời giải chi tiết
40 câu hỏi lý thuyết về amoniac và muối amoni hay nhất có đáp án và lời giải chi tiết (phần 2)
40 câu hỏi lý thuyết về amoniac và muối amoni hay nhất có lời giải chi tiết
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









