20 bài tập về axit sunfuric loãng tác dụng với kim loại và hợp chất có lời giải (phần 1)
Làm đề thiCâu hỏi 1 :
Hoà tan 0,54 g kim loại R có hoá trị n không đổi trong 100 ml dd H2SO4 0,4 M . Để trung hoà lượng H2SO4 dư cần 200 ml dd NaOH 0,1 M. Vậy hoá trị n và kim loại R là :
- A n = 2, Zn
- B n = 2, Mg.
- C n = 1, K.
- D n = 3, Al.
Đáp án: D
Phương pháp giải:
- Viết PTHH, biện luận tìm mối quan hệ giữa MR và hóa trị n, (1 ≤ n ≤ 3)
Lời giải chi tiết:
Đổi số mol: nNaOH = 0,2.0,1 = 0,02 (mol); nH2SO4 bđ = 0,1.0,4 = 0,04 (mol)
Phản ứng trung hòa H2SO4 dư
H2SO4 + 2NaOH → Na2SO4 + 2H2O (1)
(mol) 0,01 ← 0,02
Theo PTHH (1): \({n_{{H_2}S{O_4}}}\, = \frac{1}{2}.{n_{NaOH}} = \frac{1}{2}.0,02 = 0,01\;(mol) \to {n_{{H_2}S{O_4}}}pu = 0,04 - 0,01 = 0,03\,(mol)\)
2R + nH2SO4 → M2(SO4)n + nH2↑
(mol) \(\frac{{0,06}}{n}\)← 0,03
→ \(Ta\,co:{n_R}.{M_R} = {m_R} \Rightarrow \frac{{0,06}}{n}.{M_R} = 0,54 \Rightarrow \) MR = 9n
Chạy giá trị n = 1, 2,3 thì thấy tại n = 3 thì MR = 27 (Al) thỏa mãn
Đáp án D
Câu hỏi 2 :
Cho 11,2 gam Fe kim loại tác dụng hoàn toàn với dung dịch H2SO4 loãng dư, thu được dung dịch X và khí H2. Khối lượng dung dịch H2SO4 tăng hay giảm so với ban đầu bao nhiêu gam?
- A Giảm 10,8g
- B Tăng 10,8g
- C Tăng 10,2 gam
- D Giảm 10,2 gam
Đáp án: B
Phương pháp giải:
- Khối lượng dung dịch thay đổi = khối lượng chất thêm vào – khối lượng chất thoát ra ngoài
- ∆m = mFe - mkhí; viết PTHH, tìm số mol và khối lượng H2.
- Nếu ∆> 0 thì khối lượng dung dịch tăng, ∆ < 0 thì khối lượng dung dịch giảm.
Lời giải chi tiết:
\({n_{Fe}} = \frac{{11,2}}{{56}} = 0,2\,(mol)\)
PTHH: Fe + H2SO4 → FeSO4 + H2↑
(mol) 0,2 → 0,2
Theo PTHH: nH2 = nFe = 0,2 (mol)
→ ∆mdung dịch = \({m_{Fe}} - {m_{{H_2}}} = 11,2 - 0,2.2 = 10,8(gam)\)
Đáp án B
Câu hỏi 3 :
Hòa tan hoàn toàn 5,1 gam hỗn hợp kim loại Mg và Al bằng dung dịch H2SO4 loãng, thấy thoát ra 5,6 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được bao nhiêu gam muối sunfat khan?
- A 38,1 gam.
- B 29,1 gam.
- C 46,2 gam.
- D 36,5 gam.
Đáp án: B
Phương pháp giải:
Cách 1:
- Giải hệ phương trình với hai ẩn là số mol của hai kim loại.
- Viết PTHH, tìm số mol và khối lượng muối theo số mol hai kim loại.
Cách 2: Sử dụng bảo toàn khối lượng:
nSO42-(muối) = nH2 = ? (mol)
mmuối = mKL + mSO42- = ?
Lời giải chi tiết:
\({n_{{H_2}}} = \frac{{5,6}}{{22,4}} = 0,25\,(mol)\)
Đặt nAl = x; nMg = y
→ mhh = 27x + 24y = 5,1 (1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (1)
x → \(\frac{x}{2}\) → \(\frac{3}{2}x\)
Mg + H2SO4 → MgSO4 + H2↑
y → y → y
\({n_{{H_2}}} = \frac{3}{2}x + y = 0,25{\rm{ }}(2)\)
Giải (1) và (2) ta được: x = 0,1; y = 0,1
→ nAl2(SO4)3 = x/2 = 0,05 (mol); nMgSO4 = y = 0,1 (mol)
→ mmuối = mAl2(SO4)3 + mMgSO4 = 0,05.342 + 0,1.120 = 29,1 (gam)
Cách 2: Theo PTHH (1) và (2): ∑ nH2SO4 = ∑ nH2 = 0,25 (mol)
→ nSO4 = nH2SO4 = 0,25 (mol)
BTKL ta có: mmuối = mAl+Mg + mSO4 = 5,1 + 0,25.96 = 29,1(g)
Đáp án B
Câu hỏi 4 :
Hòa tan hết 12 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 6,72 lít khí H2 ở đktc. Phần trăm khối lượng của Fe trong hỗn hợp X là
- A 30%.
- B 70%.
- C 56%.
- D 44%.
Đáp án: B
Phương pháp giải:
- Giải hệ phương trình với hai ẩn là số mol của hai kim loại.
Lời giải chi tiết:
Gọi nFe = x; nMg = y
Có: mhh = mFe + mMg → 56x + 24y = 12 (1)
Fe + H2SO4 → FeSO4 + H2
(mol) x → x → x
Mg + H2SO4 → MgSO4 + H2
(mol) y → y → y
→ \({n_{{H_2}}} = x + y = \frac{{4,48}}{{22,4}} = 0,3{\rm{ (2)}}\)
Giải (1) và (2) ta được: x = y = 0,15
\(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_{hh}}}}.100\% = \frac{{56.0,15}}{{12}}.100\% = 70\% \)
Đáp án B
Câu hỏi 5 :
Hòa tan hoàn toàn 11,2 gam kim loại M trong H2SO4 loãng dư thu được 4,48 lít khí ở đktc. Kim loại M là
- A Zn.
- B Cu.
- C Fe.
- D Al.
Đáp án: C
Phương pháp giải:
- Gọi hóa trị của M là n (1 ≤ n ≤ 3)
- Viết PTHH, biện luận tìm mối quan hệ giữa M và hóa trị n.
Lời giải chi tiết:
\({n_{{H_2}}}_{(dktc)} = \frac{{4,48}}{{22,4}} = 0,2\,(mol)\)
2M + nH2SO4 → M2(SO4)n + nH2↑
\(\frac{{0,4}}{n}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \leftarrow 0,2\,\,\,(mol)\)
Ta có:
\(\begin{array}{l}{n_M}.{M_M} = {m_M}\\ \to \frac{{0,4}}{n}.{M_M} = 11,2\\ \to {M_M} = 28n\end{array}\)
Vì hóa trị của kim loại thường là 1,2,3 nên ta có bảng sau:
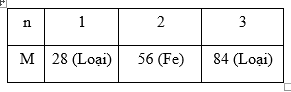
Đáp án C
Câu hỏi 6 :
Hòa tan hoàn toàn 16,2 gam kim loại M trong H2SO4 loãng dư thu được 102,6 gam muối khan. Kim loại M là
- A Zn.
- B Cu.
- C Fe.
- D Al.
Đáp án: D
Phương pháp giải:
- Gọi hóa trị của M là n (1 ≤ n ≤ 3)
- Viết PTHH, biện luận tìm mối quan hệ giữa M và hóa trị n.
Lời giải chi tiết:
Đặt hóa trị của M là n
PTHH: 2M + nH2SO4 → nM2(SO4)n + H2↑
BTKL ta có: mmuối = mM2(SO4)3 = mM + mSO4
→ 16,2 + mSO4 = 102,6
→ mSO4 = 86,4 (g) → nSO4 = 86,4 : 96 = 0,9 (mol)
Ta có: nH2SO4 = nSO4 =0,9 (mol)
Theo PTHH ta có: \({n_M} = \frac{2}{n}.{n_{{H_2}S{O_4}}} = \frac{2}{n}.0,9 = \frac{{1,8}}{n}\,(mol)\)
Ta có:
\(\begin{array}{l}{n_M}.{M_M} = {m_M}\\ \to \frac{{1,8}}{n}\,.{M_M} = 16,2\\ \to {M_M} = 9n\end{array}\)
Vì hóa trị của kim loại thường là 1,2,3 nên chạy đến n = 3 thì MM = 27 (Al) thỏa mãn
Đáp án D
Câu hỏi 7 :
Hòa tan hoàn toàn 23,05 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 1 lít dung dịch axit sunfuric H2SO4 0,5M vừa đủ, sau phản ứng thu được dung dịch Y. Cô cạn dung dịch Y thu được m gam hỗn hợp muối sunfat khan. Giá trị của m là
- A 63,05.
- B 72,05.
- C 112,1.
- D 111,1.
Đáp án: A
Phương pháp giải:
- Nhận xét: naxit = nnước
- Áp dụng BTKL tìm m.
Lời giải chi tiết:
Đặt công thức chung của 3 oxit trên có dạng: M2On
nH2SO4 = 1.0,5 = 0,5 (mol)
M2On + nH2SO4 → M2(SO4)n + nH2O
Theo PTHH ta có: nH2O = nH2SO4 = 0,5 (mol)
BTKL ta có: \({m_{oxit}} + {m_{{H_2}S{O_4}}} = {m_{muoi}} + {m_{{H_2}O}}\)
→ 23,05 + 0,5.98 = mmuối + 0,5.18
→ m = 63,05 (gam)
Đáp án A
Câu hỏi 8 :
Hòa tan hết 29,4 gam hiđroxit của kim loại M có hóa trị không đổi cần dùng vừa đủ 147 gam dung dịch H2SO4 20%. Kim loại M là
- A Al.
- B Zn.
- C Mg.
- D Cu.
Đáp án: D
Phương pháp giải:
- Gọi hóa trị của M là n (1 ≤ n ≤ 3) → Công thức hiđroxit: R(OH)n
- Viết PTHH, biện luận tìm mối quan hệ giữa M và hóa trị n.
Lời giải chi tiết:
\(\begin{array}{l}C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = \frac{{{m_{{H_2}S{O_4}}}}}{{{m_{dd{H_2}S{O_4}}}}}.100\% = 20\% \\ \Rightarrow {m_{{H_2}S{O_4}}} = \frac{{147.20}}{{100}} = 29,4(g) \Rightarrow {n_{{H_2}S{O_4}}} = \frac{{29,4}}{{98}} = 0,3(mol)\end{array}\)
Gọi hóa trị của M là n (1 ≤ n ≤ 3) → Công thức hiđroxit: R(OH)n
2M(OH)n + nH2SO4 → M2(SO4)n + 2nH2O
\(\frac{{0,6}}{n}\,\,\,\,\,\,\,\,\, \leftarrow \,\,\,\,\,0,3\)
Ta có:
\(\begin{array}{l}{n_{M{{(OH)}_n}}}.{M_{M{{(OH)}_n}}} = {m_{M{{(OH)}_n}}}\\ \to \frac{{0,6}}{n}.(M + 17n) = 29,4\\ \to M + 17n = 49n\\ \to M = 32n\end{array}\)
Chạy giá trị n từ 1 đến 3 ta thấy: tại n = 2 thì M = 64 (Cu) thỏa mãn
Đáp án D
Câu hỏi 9 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm MgCO3, FeCO3, K2CO3 trong dung dịch H2SO4 loãng, dư thu được dung dịch Y và 15,68 lít khí bay ra (đktc). Khi cô cạn dung dịch Y thu được 33,3 gam muối khan. Giá trị của m là
- A 33,3.
- B 5,8.
- C 8,1.
- D 25,4.
Đáp án: C
Phương pháp giải:
- Viết PTHH, nhận xét thấy: 1 mol CO3 được thay thế bởi 1 mol SO4 sinh ra 1 mol CO2, khối lượng tăng 36 gam.
- Áp dụng tặng giảm khối lượng tính được khối lượng thay đổi → m
Lời giải chi tiết:
MgCO3 → MgSO4
FeCO3 → FeSO4
K2CO3 → K2SO4
1 mol CO3 được thay thế bởi 1 mol SO4 sinh ra 1 mol CO2
60 gam …………………….96 gam SO4 tăng 96 – 60 =36 gam sinh ra 1 mol CO2
Vậy tăng x = ? gam……………0,7 mol CO2
\( \to x = \frac{{0,7.36}}{1} = 25,2\,(g)\)
BTKL ta có: (mMgCO3 + mFeCO3 + mK2CO3) + mtăng = mmuối
→ m + 25,2 = 33,3
→ m = 8,1 (gam)
Đáp án C
Câu hỏi 10 :
Hòa tan hoàn toàn 10 gam hỗn hợp X gồm ZnCO3, MgCO3, Na2CO3 trong dung dịch H2SO4 loãng, dư thu được dung dịch Y và 4,48 lít khí bay ra (đktc). Khi cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là
- A 24,4.
- B 17,0.
- C 17,2.
- D 10,2.
Đáp án: C
Phương pháp giải:
- Viết PTHH, nhận xét thấy: 1 mol CO3 được thay thế bởi 1 mol SO4 sinh ra 1 mol CO2, khối lượng tăng 36 gam.
- Áp dụng tặng giảm khối lượng tính được khối lượng thay đổi → m
Lời giải chi tiết:
MgCO3 → MgSO4
ZnCO3 → ZnSO4
Na2CO3 → Na2SO4
1 mol CO3 được thay thế bởi 1 mol SO4 sinh ra 1 mol CO2
60 gam …………………………….96 gam tăng 96 – 60 =36 gam sinh ra 1 mol CO2
Vậy tăng x = ? gam……..0,2 mol CO2
\( \to x = \frac{{0,2.36}}{1} = 7,2\,(g)\)
BTKL ta có: (mMgCO3 + mZnCO3 + mNa2CO3) + mtăng = mmuối
→ 10 + 7,2 = mmuối
→ mmuối = 17,2 (g)
Đáp án C
Câu hỏi 11 :
Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc, thể tích khí H2 (đktc) thoát ra là:
- A 2,24 lít
- B 4,48 lít
- C 3,36 lít
- D 6,72 lít
Đáp án: C
Phương pháp giải:
Viết phương trình hóa học xảy ra và tính toán theo phương trình hóa học.
Lời giải chi tiết:
PTHH: 2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
Ta có: nH2 = 1,5.nAl = 1,5.0,1 = 0,15 mol
→ VH2 = 0,15.22,4 = 3,36 lít
Đáp án C
Câu hỏi 12 :
Cho 20 gam hỗn hợp Mg, Fe, Al tác dụng với dung dịch H2SO4 loãng dư thu được 4,48 lít H2 (đktc). Cô cạn dung dịch thu được m (g) chất rắn. Tìm m.
Phương pháp giải:
Dùng định luật bảo toàn khối lượng: m = mkim loại + mH2SO4 - mH2
Lời giải chi tiết:
Ta có: KL + H2SO4 → Muối + H2
Bảo toàn nguyên tố H ⟹ nH2SO4 = nH2 = 0,2 mol
BTKL ⟹ m = mmuối = mkim loại + mH2SO4 - mH2 = 20 + 0,2.98 - 0,2.2 = 39,2 (gam)
Câu hỏi 13 :
Cho 20,2 gam hỗn hợp Zn và Mg vào dd H2SO4 loãng dư thu được 11,2 lít khí (đktc).Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là:
- A 68,2 gam.
- B 70,25 gam.
- C 60,0 gam.
- D 80,5 gam.
Đáp án: A
Phương pháp giải:
Sử dụng bảo toàn khối lượng: mmuối = mKL + mSO42- = ?
Lời giải chi tiết:
Tóm tắt: \(20,2\,g\left\{ \begin{array}{l}Zn\\Mg\end{array} \right. + {H_2}S{O_4} \to m\,g\left\{ \begin{array}{l}ZnS{O_4}\\MgS{O_4}\end{array} \right. + {H_2}\)
\({n_{{H_2}(dktc)}} = \frac{{11,2}}{{22,4}} = 0,5\,(mol)\)
BTNT “H”: nH2SO4 = nH2 = 0,5 (mol) → nSO42- = nH2SO4 = 0,5 (mol)
BTKL: mmuối = mKL + mSO42- = 20,2 + 0,5.96 = 68,2 (g)
Đáp án A
Câu hỏi 14 :
Cho m gam Mg tác dụng hoàn toàn với dung dịch H2SO4 loãng,dư thu được 4,48 lit khí H2 (đktc). Giá trị của m là :
- A 7,2 gam
- B 4,8 gam
- C 16,8 gam
- D 3,6 gam
Đáp án: B
Phương pháp giải:
Đổi số mol H2, viết PTHH xảy ra
Tính mol Mg theo mol H2
Lời giải chi tiết:
\({n_{{H_2}(dktc)}} = \frac{{4,48}}{{22,4}} = 0,2\;(mol)\)
PTHH: Mg + 2HCl → MgCl2 + H2↑
(mol) 0,2 ← 0,2
Theo PTHH: nMg = nH2 = 0,2 (mol)
→ m = mMg = 0,2.24 = 4,8 (g)
Đáp án B
Câu hỏi 15 :
Cho 6,3 gam hỗn hợp gồm Mg và Al tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 6,72 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
- A 199,7 gam.
- B 299,7 gam.
- C 300,3 gam.
- D 300 gam.
Đáp án: B
Phương pháp giải:
Viết PTHH xảy ra, đổi số mol H2
mdd sau = mhh KL + mdd H2SO4 – mH2 = ?
Lời giải chi tiết:
\({n_{{H_2}(dktc)}} = \frac{{6,72}}{{22,4}} = 0,3\,(mol)\)
PTHH: Mg + H2SO4 → MgSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Theo 2PTHH ta thấy: ∑nH2SO4 = ∑nH2 = 0,3 (mol) → mH2SO4 = nH2SO4×MH2SO4 = 0,3×98 = 29,4 (g)
Khối lượng dd H2SO4 10% là: \(m{\,_{dd{H_2}S{O_4}}} = \frac{{{m_{{H_2}S{O_4}}}}}{{C\% }}.100\% = \frac{{29,4}}{{10\% }}.100\% = 294\,(g)\)
Khối lượng dd thu được sau phản ứng là:
mdd sau = mhhKL + mdd H2SO4 – mH2 = 6,3 + 294 – 0,3.2 = 299,7 (g)
Đáp án B
Câu hỏi 16 :
Hòa tan hết 0,1 mol Fe vào dung dịch H2SO4 loãng, dư, thu được bao nhiêu lít (đktc) khí H2?
- A 3,36 lít
- B 2,24 lít
- C 1,12 lít
- D 4,48 lít
Đáp án: B
Phương pháp giải:
Viết phương trình hóa học xảy ra và tính toán theo phương trình hóa học.
Lời giải chi tiết:
Fe + H2SO4 loãng → FeSO4 + H2
Ta có: nH2 = nFe = 0,1 mol
Do đó: VH2 = 0,1.22,4 = 2,24 (lít)
Đáp án B
Câu hỏi 17 :
Hoà tan hoàn toàn 2,81g hỗn hợp gồm Fe2O3, MgO, ZnO trong 500ml dd H2SO4 0,1M (vừa đủ). Sau phản ứng, cô cạn dung dịch thu được muối khan có khối lượng là:
- A 3,81 gam.
- B 5,81 gam.
- C 4,81 gam.
- D 6.81 gam.
Đáp án: D
Phương pháp giải:
Ta có: Oxit bazo + H2SO4 → Muối + H2O
- Bảo toàn nguyên tố H ta có: nH2O =nH2SO4
- Áp dụng định luật bảo toàn khối lượng: mmuối =mOxit + mH2SO4 - mH2O
Lời giải chi tiết:
Ta có: Oxit bazo + H2SO4 → Muối + H2O
Bảo toàn nguyên tố H ta có: nH2O =nH2SO4 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng: moxit + mH2SO4 = mmuối + mH2O
→ mmuối =mOxit + mH2SO4 - mH2O = 2,81 + 0,05.98 - 0,05.18 = 6,81 (gam)
Đáp án D
Câu hỏi 18 :
Đốt cháy hoàn toàn 4,04 gam một hỗn hợp bột kim loại gồm Al, Fe, Cu trong không khí thu được 5,96 gam hỗn hợp 3 oxit. Hòa tan hết hỗn hợp 3 oxit bằng dung dịch H2SO4 1M. Tính thể tích dung dịch H2SO4 cần dùng.
- A 0,5 lít.
- B 0,7 lít.
- C 0,12 lít.
- D 1 lít.
Đáp án: C
Phương pháp giải:
Nhận xét: \({n_{O(oxit)}} = {\rm{ }}{n_{{H_2}O}} = {n_{{H_2}S{O_4}}}\)
- Áp dụng bảo toàn khối lượng cho phản ứng cháy tìm được số mol O trong oxit → tìm số mol O → số mol H2SO4
Lời giải chi tiết:
PTTQ:
KL + O2 → Oxit
- Áp dụng BTKL cho phản ứng cháy:
\(\begin{array}{l}{m_{KL}} + {m_{{O_2}}} = {m_{oxit}} \Rightarrow {m_{{O_2}}} = 5,96 - 4,04 = 1,92(g)\\ \Rightarrow {n_{O(oxit)}} = 2{n_{{O_2}}} = 2.\frac{{1,92}}{{32}} = 0,12(mol) = {n_{{H_2}S{O_4}}}\end{array}\)
Đặt công thức chung của các oxi là M2On
M2On + nH2SO4 → M2(SO4)n + nH2O
Theo PTHH ta thấy: nH2SO4 = nO(oxit) = 0,12 (mol) \( \to {V_{{H_2}S{O_4}}} = \frac{{{n_{{H_2}S{O_4}}}}}{{{V_{{H_2}S{O_4}}}}} = \frac{{0,12}}{1} = 0,12(l)\)
Đáp án C
Câu hỏi 19 :
Cho hỗn hợp A gồm Al, Zn, Mg. Đem oxi hoá hoàn toàn 28,6 gam A bằng oxi dư thu được 44,6 gam hỗn hợp oxit B. Hoà tan hết B trong dung dịch H2SO4 thu được dung dịch D. Cô cạn dung dịch D được hỗn hợp muối khan là
- A 124,6 gam.
- B 49,8 gam.
- C 74,7 gam.
- D 100,8 gam.
Đáp án: A
Phương pháp giải:
Nhận xét: \({n_{O(oxit)}} = {\rm{ }}{n_{{H_2}O}} = {n_{{H_2}S{O_4}}}\)
- Áp dụng bảo toàn khối lượng cho phản ứng cháy tìm được số mol O trong oxit → tìm số mol O → số mol H2SO4
- Áp dụng BTKL cho phản ứng của oxit với H2SO4 tìm được mmuối
Lời giải chi tiết:
PTTQ:
KL + O2 → Oxit
- Áp dụng BTKL cho phản ứng cháy:
\(\begin{array}{l}{m_{KL}} + {m_{{O_2}}} = {m_{oxit}} \Rightarrow {m_{{O_2}}} = 44,6 - 28,6 = 16(g)\\ \Rightarrow {n_{O(oxit)}} = 2{n_{{O_2}}} = 2.\frac{{16}}{{32}} = 1(mol) = {n_{{H_2}S{O_4}}} = {n_{{H_2}O}}\end{array}\)
Đặt công thức chung của các oxi là M2On
M2On + nH2SO4 → M2(SO4)n + nH2O
- Áp dụng BTKL cho phản ứng của oxit với H2SO4
moxit + maxit = mmuối + mnước
→ 44,6 + 1.98 = mmuối + 1.18 → mmuối = 124,6(g)
Đáp án A
Câu hỏi 20 :
Cho 17,6g hỗn hợp gồm Fe và kim loại R vào dung dịch H2SO4 loãng dư. Sau phản ứng thu được 4,48lit khí (đktc). Phần không tan cho vào dung dịch H2SO4 đặc, nóng thì thoát ra 2,24 lít khí (đktc). R là kim loại nào sau đây?
- A Mg.
- B Pb.
- C Ag.
- D Cu.
Đáp án: D
Phương pháp giải:
- Do H2SO4 dư nên phần không tan là R.
- Fe tác dụng với H2SO4 loãng sinh ra H2, từ số mol khí tìm được số mol và khối lượng của Fe → tìm được khối lượng của R.
- Gọi hóa trị của R là n, áp dụng bảo toàn e, tìm mối quan hệ giữa MR và n. Biện luận giá trị của n để tìm M
Lời giải chi tiết:
Fe + H2SO4 → FeSO4 + H2
(mol) 0,2 ← 0,2
→ mR = 17,6 – 56.0,2 = 6,4 (gam)
Gọi hóa trị của R là n, ta có :
R0 → R+n + ne S+6 + 2e → S+4
(mol) x → nx (mol) 0,2 ← 0,1
BT e : nx = 0,2 \( \Rightarrow n.\frac{{6,4}}{{{M_R}}} = 0,2\)→ MR = 34n
Chạy giá trị n = 1,2,3 ta thấy tại n = 2 thì MR = 64 (Cu) thỏa mãn
Đáp án D
20 bài tập vận dụng về axit sunfuric đặc (phần 1) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
20 bài tập vận dụng về axit sunfuric đặc (phần 2) có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
Tổng hợp 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat đầy đủ trắc nghiệm và tự luận có đáp án và lời giải chi tiết (phần 1)
20 bài tập về axit sunfuric loãng tác dụng với kim loại (phần 1) có đáp án và lời giải chi tiết đầy đủ các dạng từ dễ đến khó, cả trắc nghiệm và tự luận
30 câu hỏi lý thuyết về axit sunfuric - muối sunfat có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận.
10 câu hỏi vận dụng cao về axit sunfuric và muối sunfat có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









