 Giải vth khtn 9, soạn vở thực hành khoa học tự nhiên 9 KNTT
Giải vth khtn 9, soạn vở thực hành khoa học tự nhiên 9 KNTT
 Chương 6. Kim loại. Sự khác nhau cơ bản giữa phi kim và..
Chương 6. Kim loại. Sự khác nhau cơ bản giữa phi kim và.. Bài 18. Tính chất chung của kim loại Vở thực hành Khoa học tự nhiên 9
Khi uốn các thanh thủy tinh, gỗ, nhôm (aluminium), thép (thành phần chính là sắt), thanh nào có thể bị uốn cong mà không gãy?
18.1
Khi uốn các thanh thủy tinh, gỗ, nhôm (aluminium), thép (thành phần chính là sắt), thanh nào có thể bị uốn cong mà không gãy?
Phương pháp giải:
Dựa vào tính chất vật lí của các vật liệu
Lời giải chi tiết:
Nhôm (aluminium), thép (thành phần chính là sắt) đều được làm từ kim loại có tính dẻo nên có thể bị uốn cong mà không gãy.
18.2
Khi dùng búa đập vào các vật thể bằng đồng, gỗ, vàng, nhôm, cao su, sứ, vật thể nào bị biến dạng (vỡ vụn, dát mỏng,..)?
Phương pháp giải:
Dựa vào tính chất vật lí của các vật liệu
Lời giải chi tiết:
Khi dùng búa đập vào vật thể bằng sứ, gỗ sẽ bị vỡ vụn do sứ, gỗ giòn
Khi dùng búa đập vào vật thể bằng đồng, vàng, nhôm sẽ bị dát mỏng do kim loại có tính dẻo
Khi dùng búa đập vào vật thể bằng cao su thì vật thể không biến dạng do cao su có tính đàn hồi
18.3
Khi nhúng thìa nhôm vào cốc nước sôi, tay cầm cán thìa sẽ thấy nóng. Hiện tượng này chứng tỏ tính chất gì của nhôm?
Phương pháp giải:
Dựa vào tính chất vật lí của các vật liệu
Lời giải chi tiết:
Hiện tượng trên chứng tỏ nhôm có tính dẫn nhiệt.
18.4
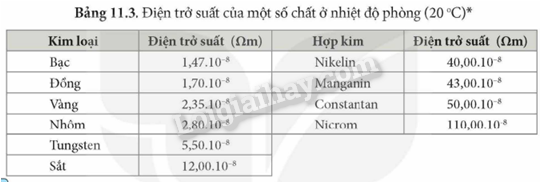
Dựa vào các số liệu trong Bảng 11.3 (trang 57), hãy giải thích vì sao dây dẫn điện thường làm bằng đồng và nhôm mà không làm bằng sắt.
Phương pháp giải:
Dựa vào bảng 11.3 trang 87
Lời giải chi tiết:
Ta thấy điện trở suất của đồng và nhôm lớn hơn nhiều so với sắt nên khả năng dẫn điện của đồng và nhôm tốt hơn nên thường được sử dụng làm dây dẫn điện
18.5
Quan sát bề mặt viên gạch, mảnh nhôm, mảnh đồng, bề mặt nào có vẻ sáng lấp lánh (ánh kim)?
Phương pháp giải:
Dựa vào tính chất vật lí của vật liệu
Lời giải chi tiết:
Bề mặt mảnh nhôm, mảnh đồng có vẻ sáng lấp lánh hơn.
18.6
Quan sát Hình 18.1 (trang 88 , SGK KHTN 9) và cho biết những ứng dụng của các kim loại vàng, đồng, nhôm, sắt dựa trên tính chất vật lí nào?
Phương pháp giải:
Dựa vào hình 18.1 trang 88
Lời giải chi tiết:
a) Kim loại vàng được dùng làm đồ trang sức
b) Đồng được dùng làm lõi dây điện
c) Nhôm được dùng làm xoong, nồi, chảo
d) Thép được dùng trong xây dựng, cầu đường,…
18.7
Viết phương trình hóa học phản ứng giữa kẽm (zinc), đồng với khí oxygen
Phương pháp giải:
Dựa vào tính chất hóa học tác dụng với oxygen của kim loại để tạo thành các oxide
Lời giải chi tiết:
2Zn + O2 \( \to \) 2ZnO
2Cu + O2 \( \to \) 2CuO
18.8
Tại sao đồ vật làm bằng kim loại như sắt, nhôm, kẽm, đồng,… để lâu trong không khí bị mất ánh kim, còn đồ trang sức bằng vàng để lâu trong không khí vẫn sáng, đẹp?
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
Vì kim loại như sắt, nhôm, kẽm, đồng có thể tác dụng với oxygen trong không khí để tạo ra oxide kim loại nên bị mất đi ánh kim, còn đồ trang sức bằng vàng không tác dụng với oxygen trong không khí nên vẫn sáng, đẹp.
18.9
Tiến hành thí nghiệm Nghiên cứu phản ứng của một số kim loại với chlorine (trang 89, SGK KHTN 9) và viết phương trình hóa học của các phản ứng xảy ra.
Phương pháp giải:
Dựa vào tính chất tác dụng với phi kim của các kim loại
Lời giải chi tiết:
Thí nghiệm natri (sodium) tác dụng với chlorine có phản ứng hóa học xảy ra là:
Thí nghiệm sắt tác dụng với khí chlorine có phản ứng hóa học xảy ra là:
18.10
Viết phương trình hóa học của các phản ứng giữa kim loại Mg, Zn với phi kim S
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
18.11
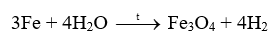
Biết rằng ở nhiệt độ cao, hơi nước tác dụng với sắt tạo thành Fe3O4. Viết phương trình hóa học của phản ứng
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
18.12
Phản ứng của kim loại kẽm với dung dịch hydrochloric acid được dùng để điều chế khí hydrogen trong phòng thí nghiệm. Tính lượng kẽm và thể tích dung dịch hydrochloric acid 1M cần dùng để điều chế 250 ml khí hydrogen (điều kiện chuẩn)
Phương pháp giải:
Dựa vào công thức tính số mol khi biết thể tích khí: n = V : 24,79 lít
Lời giải chi tiết:
n H2 = \(\frac{{{{250.10}^{ - 3}}}}{{24,79}} = 0,01mol\)
Zn + 2HCl \( \to \) ZnCl2 + H2
Theo phản ứng trên ta có:
nZn = n H2 => n Zn = 0,01 mol
2n H2 = n HCl => n HCl = 0,01.2 = 0,02 mol
m Zn = 0,01 . 65 = 0,65g
V HCl = 0,02 : 1 = 0,02 lít
18.13
Viết phương trình hóa học của phản ứng xảy ra khi cho kim loại magnesium vào dung dịch hydrochloric acid
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại tác dụng với dung dịch acid
Lời giải chi tiết:
Mg + 2HCl \( \to \) MgCl2 + H2
18.14
Mô tả một số điểm khác biệt trong tính chất của các kim loại Al, Fe, Au theo gợi ý sau:
- Khác biệt trong tính chất vật lí.
- Khác biệt trong tính chất hóa học khi tác dụng với
a) oxygen; b) Dung dịch hydrochloric acid.
Phương pháp giải:
Dựa vào tính chất vật lí và tính chất hóa học của kim loại
Lời giải chi tiết:
- Sự khác biệt trong tính chất vật lí giữa Al, Fe, Au: Fe có tính nhiễm từ (bị nâm châm hút) trong khi đó Al, Au không có tính chất này.
- Sự khác biệt trong tính chất hóa học giữa Al, Fe, Au khi tác dụng với oxygen và dung dịch HCl: Au không tác dụng với oxygen và dung dịch HCl. Fe, Al tác dụng với cả oxygen và dung dịch HCl
18.15
Nêu các ứng dụng của ba kim loại: sắt, nhôm, vàng mà em biết; chỉ rõ mối liên lệ giữa tính chất và ứng dụng của chúng
Phương pháp giải:
Dựa vào tính chất vật lí và ứng dụng của kim loại
Lời giải chi tiết:
Sắt có tính dẻo nên được sử dụng làm vật liệu xây dựng hoặc sản xuất gang, thép
Nhôm có tính dẫn điện tốt, nhẹ, giá thành rẻ nên được sử dụng làm lõi dây điện, hoặc các vật dụng sử dụng trong gia đình như mâm, xoong
Vàng có tính ánh kim dễ dát mỏng và không tác dụng với oxygen trong không khí nên được sử dụng làm đồ trang sức.
18.16
Trình bày tính chất hóa học của kim loại theo gợi ý sau:
- Nêu tính chất hóa học cơ bản của kim loại
- Viết phương trình hóa học minh họa cho mỗi tính chất
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
a) Kim loại tác dụng với nước ở nhiệt độ thường
Ví dụ: Na + H2O \( \to \)NaOH + ½ H2
b) Kim loại tác dụng với nước ở nhiệt độ cao
Ví dụ:
c) Kim loại tác dụng với dung dịch HCl
Ví dụ: Fe + 2HCl \( \to \) FeCl2 + H2
d) Kim loại tác dụng với muối
Ví dụ: Fe + CuSO4 \( \to \)FeSO4 + Cu
18.17
Các thiết bị điện được đặt tại nơi có độ ẩm cao như nhà bếp, phòng tắm dễ khiến cho động cơ và mạch điện bên trong ẩm ướt, gây ra tình trạng rò rỉ điện. Khi người chạm vào các thiết bị này sẽ bị điện giật. Để tránh bị điện giật, có thể nối các thiết bị điện đó với đất thông qua dây tiếp đất. Những chất nào có thể làm dây tiếp đất trong số các chất sau: nhựa, đồng, cao su, vải, nhôm, giấy, thép. Hãy giải thích sự lựa chọn của em.
Phương pháp giải:
Sử dụng các vật liệu cách điện để làm dây tiếp đất.
Lời giải chi tiết:
Nhựa, cao su, vải, giấy không dẫn điện được sử dụng làm dây tiếp đất.
18.18
Viết phương trình hóa học biểu diễn phản ứng của Al, Fe, Zn, Cu với các phi kim sau: Cl2, O2, S.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
2Al + 3Cl2 \( \to \)2AlCl3
4Al + 3O2 \( \to \)2Al2O3
2Al + 3S \( \to \)Al2S3
2Fe + 3Cl2 \( \to \)2FeCl3
2Fe + 3O2 \( \to \)2Fe2O3
Fe + S \( \to \)FeS
Zn + Cl2 \( \to \)ZnCl2
2Zn + O2\( \to \) 2ZnO
Zn + S\( \to \)ZnS
Cu + Cl2 \( \to \)CuCl2
2Cu + O2\( \to \)2CuO
Cu + S \( \to \)CuS
18.19
Có hai mẫu hợp kim của đồng (hỗn hợp thu được khi làm nguội hỗn hợp lỏng của đồng và một kim loại khác) là đồng – kẽm và đồng – bạc. Hãy trình bày các phân biệt hai mẫu hợp kim trên.
Phương pháp giải:
Dựa vào sự khác biệt tính chất hóa học của kim loại.
Lời giải chi tiết:
Cho 2 mẫu hợp kim vào dung dịch HCl.
Mẫu hợp kim nào có bọt khí thoát ra là đồng – kẽm.
Mẫu hợp kim nào không có bọt khí thoát ra là đồng – bạc.
Vì đồng và bạc không phản ứng với HCl, kẽm phản ứng với HCl tạo muối và khí hydrogen.
Luyện Bài Tập Trắc nghiệm KHTN 9 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 51. Sự phát sinh và phát triển sự sống Vở thực hành Khoa học tự nhiên 9
- Bài 50. Cơ chế tiến hóa Vở thực hành Khoa học tự nhiên 9
- Bài 49. Khái niệm tiến hóa và các hình thức chọn lọc Vở thực hành Khoa học tự nhiên 9
- Bài 48. Ứng dụng công nghệ di truyền vào đời sống Vở thực hành Khoa học tự nhiên 9
- Bài 47. Di truyền học với con người Vở thực hành Khoa học tự nhiên 9
- Bài 51. Sự phát sinh và phát triển sự sống Vở thực hành Khoa học tự nhiên 9
- Bài 50. Cơ chế tiến hóa Vở thực hành Khoa học tự nhiên 9
- Bài 49. Khái niệm tiến hóa và các hình thức chọn lọc Vở thực hành Khoa học tự nhiên 9
- Bài 48. Ứng dụng công nghệ di truyền vào đời sống Vở thực hành Khoa học tự nhiên 9
- Bài 47. Di truyền học với con người Vở thực hành Khoa học tự nhiên 9





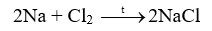
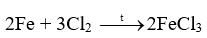
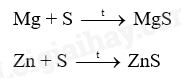
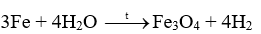








Danh sách bình luận