Đề thi học kì 1 Hóa 11 Chân trời sáng tạo - Đề số 9
Cho cân bằng sau: H2(g) + I2(g)
Đề bài
Cho cân bằng sau:

Thực hiện phản ứng trên trong bình kín có dung tích không đổi, tại nhiệt độ T. Ban đầu lấy số mol H2 gấp đôi số mol I2. Tại thời điểm cân bằng, số mol HI gấp đôi số mol I2. Hằng số cân bằng KC của phản ứng trên là
-
A.
4,00
-
B.
1,33
-
C.
1,67
-
D.
2,67
Từ tinh dầu chanh người ta tác được chất limonene thuộc loại hydrocarbon có hàm lượng nguyên tố H là 11,765%. Biết phổ khối lượng của limonene như hình dưới:
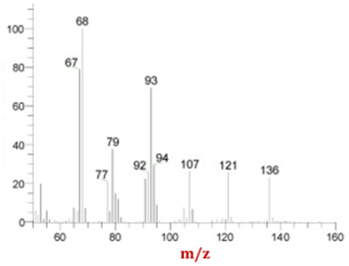
Công thức phân tử của limonene là
-
A.
C10H12
-
B.
C10H16
-
C.
C5H6
-
D.
C5H8
-
A.
CH3CH2OH.
-
B.
CH3COOH.
-
C.
CH3CHO.
-
D.
CH3COOCH3.
Cho các chất: CaC2, CO2, HCOOH, C2H6O, CH3COOH, CH3Cl, NaCl, K2CO3. Số hợp chất hữu cơ trong các chất trên là
-
A.
4.
-
B.
5.
-
C.
3.
-
D.
2.
Nồng độ mol của ion NO3- trong dung dịch Al(NO3)3 0,05 M là
-
A.
0,02 M.
-
B.
0,15 M.
-
C.
0,1 M.
-
D.
0,05 M.
Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH trên là
-
A.
0,1.
-
B.
1,2.
-
C.
0,12.
-
D.
0,012.
pH của dung dịch Ca(OH)2 0,05M là
-
A.
2
-
B.
1
-
C.
13
-
D.
12
Liên kết hoá học trong phân tử NH3 là liên kết
-
A.
cộng hoá trị có cực.
-
B.
ion.
-
C.
cộng hoá trị không cực.
-
D.
kim loại.
Cho các phát biểu sau:
(a) Sulfur là chất rắn, màu trắng, không tan trong nước.
(b) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(c) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(d) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO2.
(e) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2, Ba(OH)2, Ba(NO3)2.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
-
A.
Chu kì 3, nhóm VIA.
-
B.
Chu kì 5, nhóm VIA.
-
C.
Chu kì 3, nhóm IVA.
-
D.
Chu kì 5, nhóm IVA.
Nhóm chức – COOH là của hợp chất nào sau đây?
-
A.
Carboxylic acid.
-
B.
Aldehyde.
-
C.
Alcohol.
-
D.
Ketone.
Chất lỏng cần tách được chuyển sang pha hơi, rồi làm lạnh cho hơi ngưng tụ, thu lấy chất lỏng ở khoảng nhiệt độ thích hợp đây là cách tiến hành của phương pháp nào sau đây?
-
A.
Phương pháp chưng cất.
-
B.
Phương pháp chiết
-
C.
Phương pháp kết tinh.
-
D.
Sắc kí cột.
Hợp chất hữu cơ Z có phần trăm khối lượng các nguyên tố như sau: %C = 61,02; %H = 15,52; còn lại là nitrogen. Tỉ khối hơi của Z so với O2 nhỏ hơn 2. Công thức phân tử của Z là
-
A.
C2H6N2
-
B.
C2H7N.
-
C.
C3H9N.
-
D.
C2H8N2.
Nhóm chất nào dưới đây đều là dẫn xuất của hydrocarbon?
-
A.
CH2Cl2, CH2Br−CH2Br, CHCl3, CH3COOCH3, C6H5CH3.
-
B.
CH2Cl2, CH2=CH−CHO, CH3COOH, CH2=CH2.
-
C.
CHBr3, CH2=CH−COOCH3, C6H5OH, C2H5OH, (CH3)3N.
-
D.
CH3OH, CH2=CH−Cl, C6H5ONa, CH≡C−CH3.
Nhóm chất nào sau đây là đồng đẳng của nhau?
(I) CH3 – CH = CH – CH3 (II) CH2 = CH – (CH2)2 – CH3

-
A.
I, II
-
B.
II, IV
-
C.
I, IV
-
D.
II, III
Cho các phản ứng:
(1) SO2 + Cl2 + H2O → H2SO4 + HCl
(3) SO2 + H2S → S + H2O
(2) SO2 + Mg → S + MgO
(4) SO2 + O2 → SO3
(5) SO2 + NaOH → NaHSO3
(6) SO2 + NaOH → Na2SO3 + H2O
(7) SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
Những phản ứng mà SO2 thể hiện tính khử là
-
A.
(1); (2); (4); (5).
-
B.
(2); (3); (6); (7).
-
C.
(1); (4); (7).
-
D.
(1); (7).
Chất nào sau đây thuộc loại chất điện ly mạnh?
-
A.
CH3COOH.
-
B.
KCl.
-
C.
H2O.
-
D.
Mg(OH)2.
Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
(1) C(s)+H2O(g) ⇄ CO(g) + H2(g) \({\Delta _r}H_{298}^o\)= 130kJ
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3
(2) CO(g)+H2O(g) ⇄ H2(g) + CO2(g) \({\Delta _r}H_{298}^o\) = -42kJ
a) Khi tăng nhiệt độ cân bằng (1) sẽ chuyển dịch theo chiều thuận.
b) Khi giảm nhiệt độ cân bằng (2) sẽ chuyển dịch theo chiều nghịch.
c) Ở phản ứng (2) nếu lượng hơi nước lấy dư nhiều lần so với khí carbon monoxide thì hiệu suất phản ứng sẽ tăng.
d) Khi tăng áp suất, cả hai phản ứng (1), (2) đều chuyển dịch theo chiều nghịch.
a) Hydrogen chiếm 10,72% khối lượng phân tử.
b) Là một hợp chất carboxylic acid.
c) Công thức phân tử là C20H30O.
d) Carbon chiếm 72,10% khối lượng phân tử.
Bột đá vôi có thể được sử dụng để xử lí khí thải chứa sulfur dioxide từ các nhà máy điện đốt than và dầu mỏ. Phương trình hóa học của phản ứng là:
CaCO3(s) + SO2 (g) → CaSO3(g) + CO2(g)
a. Phản ứng trên là phản ứng oxi hóa – khử.
b. Cho giá trị enthalpy chuẩn của các hợp chất trong bảng sau đây. Từ đó xác định được phản ứng trên là phản ứng tỏa nhiệt.
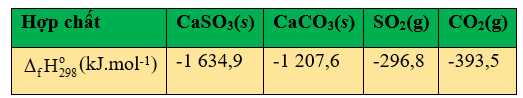
c. Trong phản ứng trên, để phản ứng xảy ra nhanh thì đá vôi phải ở dạng viên lớn.
d. Calcium sulfite (CaSO3) thường được chuyển hóa thành thạch cao có công thức CaSO4.2H2O. Phản ứng ứng chuyển hóa này là một phản ứng oxi hóa - khử.
Khi tiến hành thí nghiệm chuẩn độ acid-base, trong burrette đựng dung dịch NaOH, trong bình tam giác đựng dung dịch HCl (đã biết nồng độ) và thuốc thử phenolphtalein.
a) Khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng bền trong 30 giây thì dừng chuẩn độ.
b) Phải thực hiện chuẩn độ tối thiểu 3 lần
c) Tại điểm tương đương, thể tích NaOH bằng thể tích dung dịch HCl.
d) Khi chuẩn độ cần để chất lỏng chảy từ từ theo thành bình tam giác.
Sulfur dioxide có khả năng tẩy trắng và sát trùng được dùng làm chất chống mốc cho các sản phẩm mây tre đan. Trong một ngày, làng nghề đốt cháy 12 kg lưu huỳnh để tạo thành khí SO2 sấy khô và chống nấm mốc cho đũa dùng một lần. Cứ sấy khô 1kg đũa cần 2300 kJ nhiệt lượng. Biết nhiệt tạo thành chuẩn của là -296,8kJ/ mol; hao hụt nhiệt là 20%. Hỏi một ngày làng nghề sản xuất được bao nhiêu kg đũa?
Đáp án:
Pha loãng 1 lít dung dịch NaOH có pH = 13 bằng bao nhiêu lít nước để được dung dịch mới có pH = 11?
Đáp án:
Từ tinh dầu hồi, người ta tách được anethol – một chất thơm được dùng sản xuất kẹo cao su. Để xác định công thức phân tử của hợp chất này người ta phân tích nguyên tố và đo phổ khối lượng. Kết quả phân tích được cho trong bảng sau:

Số nguyên tử H trong anethol là:
Đáp án:
Cho các chất sau:
(a) CH3CH2OH (e) (CH3)2CHCH2CH2OH
(b) CH3CH2CH2OH (g) (CH3)3COH
(c) (CH3)2CHOH (h) HOCH2CH2OH
(d) (CH3)2CHCH2OH
Có bao nhiêu chất thuộc dãy đồng đẳng của CH3OH (methanol)?
Đáp án:
Lời giải và đáp án
Cho cân bằng sau:

Thực hiện phản ứng trên trong bình kín có dung tích không đổi, tại nhiệt độ T. Ban đầu lấy số mol H2 gấp đôi số mol I2. Tại thời điểm cân bằng, số mol HI gấp đôi số mol I2. Hằng số cân bằng KC của phản ứng trên là
-
A.
4,00
-
B.
1,33
-
C.
1,67
-
D.
2,67
Đáp án : B
Dựa vào công thức tính hằng số cân bằng Kc.
Gọi số mol I2 ban đầu là 1 mol; n H2 = 2 mol
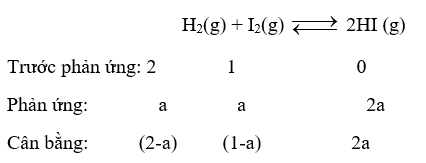
Vì tại cân bằng: n HI = 2.n I2 \( \to \) 2a = 2.(1-a) → a = 0,5 mol
Kc = \(\frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{H_2}{\rm{]}}.{\rm{[}}{I_2}{\rm{]}}}} = \frac{{{{(2.0,5)}^2}}}{{(2 - 0,5).(1 - 0,5)}} = \frac{4}{3}\)
Đáp án B
Từ tinh dầu chanh người ta tác được chất limonene thuộc loại hydrocarbon có hàm lượng nguyên tố H là 11,765%. Biết phổ khối lượng của limonene như hình dưới:

Công thức phân tử của limonene là
-
A.
C10H12
-
B.
C10H16
-
C.
C5H6
-
D.
C5H8
Đáp án : B
Dựa vào phổ khối MS.
Theo phổ MS, ta thấy có tín hiệu peak ion M+ là 136 nên M limonene = 136.
Số nguyên tử H = \(\frac{{136.11,765\% }}{1} = 16\)
Số nguyên tử C = \(\frac{{136.(100 - 11,765)\% }}{{12}} = 10\)
Công thức phân tử limonene C10H16
Đáp án B
-
A.
CH3CH2OH.
-
B.
CH3COOH.
-
C.
CH3CHO.
-
D.
CH3COOCH3.
Đáp án : A
Dựa vào phổ hồng ngoại IR.
Trong phổ IR xuất hiện tín hiệu ở khoảng 3600 – 3200 cm-1 và có hình dạng đỉnh tròn nên đây là tín hiệu đặc trưng của nhóm OH.
Nên X là CH3CH2OH.
Đáp án A
Cho các chất: CaC2, CO2, HCOOH, C2H6O, CH3COOH, CH3Cl, NaCl, K2CO3. Số hợp chất hữu cơ trong các chất trên là
-
A.
4.
-
B.
5.
-
C.
3.
-
D.
2.
Đáp án : A
Dựa vào khái niệm hợp chất hữu cơ.
HCOOH, C2H6O, CH3COOH, CH3Cl thuộc hợp chất hữu cơ.
Đáp án A
Nồng độ mol của ion NO3- trong dung dịch Al(NO3)3 0,05 M là
-
A.
0,02 M.
-
B.
0,15 M.
-
C.
0,1 M.
-
D.
0,05 M.
Đáp án : B
Dựa vào sự phân li của chất điện li.
Al(NO3)3 → Al3+ + 3NO3-
0,05 → 0,15
Đáp án B
Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH trên là
-
A.
0,1.
-
B.
1,2.
-
C.
0,12.
-
D.
0,012.
Đáp án : C
Dựa vào phương pháp chuẩn độ acid – base.
CM NaOH = \(\frac{{{V_{HCl}}.{C_M}_{HCl}}}{{{V_{NaOH}}}} = \frac{{12.0,1}}{{10}} = 0,12M\)
Đáp án C
pH của dung dịch Ca(OH)2 0,05M là
-
A.
2
-
B.
1
-
C.
13
-
D.
12
Đáp án : C
Dựa vào công thức tính pH.
[OH-] = 0,05.2 = 0,1M → pOH = -lg[OH-] = 1
pH = 14 – 1 = 13
Đáp án C
Liên kết hoá học trong phân tử NH3 là liên kết
-
A.
cộng hoá trị có cực.
-
B.
ion.
-
C.
cộng hoá trị không cực.
-
D.
kim loại.
Đáp án : A
Dựa vào cấu tạo phân tử NH3.
Liên kết NH3 là liên kết cộng hóa trị có cực.
Đáp án A
Cho các phát biểu sau:
(a) Sulfur là chất rắn, màu trắng, không tan trong nước.
(b) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(c) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(d) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO2.
(e) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Dựa vào tính chất của sulfur.
(a) sai, sulfur có màu vàng
(b) đúng
(c) đúng
(d) sai, đốt cháy nhiên liệu, khí thải công nghiệp, phương tiện là nguồn phát thải khí SO2.
(e) đúng.
Đáp án C
Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2, Ba(OH)2, Ba(NO3)2.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Dựa vào tính chất hóa học của sulfuric acid.
(a) đúng
(b) sai, cho từ từ acid vào nước, khuấy đều.
(c) đúng
(d) sai, sulfuric acid loãng khôgn có tính oxi hóa mạnh.
(e) đúng
Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
-
A.
Chu kì 3, nhóm VIA.
-
B.
Chu kì 5, nhóm VIA.
-
C.
Chu kì 3, nhóm IVA.
-
D.
Chu kì 5, nhóm IVA.
Đáp án : A
Dựa vào vị trí S trong bảng tuần hoàn.
Cấu hình của S: 1s2 2s22p4 3s23p4
S thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn.
Đáp án A
Nhóm chức – COOH là của hợp chất nào sau đây?
-
A.
Carboxylic acid.
-
B.
Aldehyde.
-
C.
Alcohol.
-
D.
Ketone.
Đáp án : A
Dựa vào các loại nhóm chức trong hợp chất hữu cơ.
Nhóm chức – COOH thuộc hợp chất carboxylic acid.
Đáp án A
Chất lỏng cần tách được chuyển sang pha hơi, rồi làm lạnh cho hơi ngưng tụ, thu lấy chất lỏng ở khoảng nhiệt độ thích hợp đây là cách tiến hành của phương pháp nào sau đây?
-
A.
Phương pháp chưng cất.
-
B.
Phương pháp chiết
-
C.
Phương pháp kết tinh.
-
D.
Sắc kí cột.
Đáp án : A
Dựa vào các phương pháp tách biệt và tinh chế hợp chất hữu cơ.
Tách chất dựa trên sự khác nhau về nhiệt độ chuyển thể là phương pháp chưng cất
Đáp án A
Hợp chất hữu cơ Z có phần trăm khối lượng các nguyên tố như sau: %C = 61,02; %H = 15,52; còn lại là nitrogen. Tỉ khối hơi của Z so với O2 nhỏ hơn 2. Công thức phân tử của Z là
-
A.
C2H6N2
-
B.
C2H7N.
-
C.
C3H9N.
-
D.
C2H8N2.
Đáp án : C
Dựa vào thành phần % các nguyên tố trong hợp chất hữu cơ.
C : H : N = \(\frac{{61,02}}{{12}}:\frac{{15,52}}{1}:\frac{{23,46}}{{14}} = 5:15,52:1,67 = 3:9:1\)
Công thức đơn giản của Z là C3H9N.
Vì tỉ khối hơi của Z so với O2 nhỏ hơn 2 nên MZ < 32.2 = 64.
Vậy công thức đơn giản trùng với công thức phân tử.
Đáp án C
Nhóm chất nào dưới đây đều là dẫn xuất của hydrocarbon?
-
A.
CH2Cl2, CH2Br−CH2Br, CHCl3, CH3COOCH3, C6H5CH3.
-
B.
CH2Cl2, CH2=CH−CHO, CH3COOH, CH2=CH2.
-
C.
CHBr3, CH2=CH−COOCH3, C6H5OH, C2H5OH, (CH3)3N.
-
D.
CH3OH, CH2=CH−Cl, C6H5ONa, CH≡C−CH3.
Đáp án : C
Dựa vào phân loại hợp chất hữu cơ.
CHBr3, CH2=CH−COOCH3, C6H5OH, C2H5OH, (CH3)3N thuộc dẫn xuất của hydrocarbon vì có thêm các nguyên tố khác ngoài C và H.
Đáp án C
Nhóm chất nào sau đây là đồng đẳng của nhau?
(I) CH3 – CH = CH – CH3 (II) CH2 = CH – (CH2)2 – CH3

-
A.
I, II
-
B.
II, IV
-
C.
I, IV
-
D.
II, III
Đáp án : A
Đồng đẳng là các hợp chất trong cùng 1 dãy, hơn kém nhau 1 hay nhiều nhóm – CH2.
CH3 – CH = CH – CH3 và CH2 = CH – (CH2)2 – CH3 là đồng đẳng của nhau.
Đáp án A
Cho các phản ứng:
(1) SO2 + Cl2 + H2O → H2SO4 + HCl
(3) SO2 + H2S → S + H2O
(2) SO2 + Mg → S + MgO
(4) SO2 + O2 → SO3
(5) SO2 + NaOH → NaHSO3
(6) SO2 + NaOH → Na2SO3 + H2O
(7) SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
Những phản ứng mà SO2 thể hiện tính khử là
-
A.
(1); (2); (4); (5).
-
B.
(2); (3); (6); (7).
-
C.
(1); (4); (7).
-
D.
(1); (7).
Đáp án : C
SO2 thể hiện tính khử khi tăng số oxi hóa.
(1), (4), (7) tăng số oxi hóa từ +4 lên +6.
(4), (6) không phải phản ứng oxi hóa khử nên SO2 không thể hiện tính khử
Đáp án C
Chất nào sau đây thuộc loại chất điện ly mạnh?
-
A.
CH3COOH.
-
B.
KCl.
-
C.
H2O.
-
D.
Mg(OH)2.
Đáp án : B
Dựa vào phân loại chất điện li.
Chất điện li mạnh là muối tan KCl.
Đáp án B
Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
(1) C(s)+H2O(g) ⇄ CO(g) + H2(g) \({\Delta _r}H_{298}^o\)= 130kJ
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3
(2) CO(g)+H2O(g) ⇄ H2(g) + CO2(g) \({\Delta _r}H_{298}^o\) = -42kJ
a) Khi tăng nhiệt độ cân bằng (1) sẽ chuyển dịch theo chiều thuận.
b) Khi giảm nhiệt độ cân bằng (2) sẽ chuyển dịch theo chiều nghịch.
c) Ở phản ứng (2) nếu lượng hơi nước lấy dư nhiều lần so với khí carbon monoxide thì hiệu suất phản ứng sẽ tăng.
d) Khi tăng áp suất, cả hai phản ứng (1), (2) đều chuyển dịch theo chiều nghịch.
a) Khi tăng nhiệt độ cân bằng (1) sẽ chuyển dịch theo chiều thuận.
b) Khi giảm nhiệt độ cân bằng (2) sẽ chuyển dịch theo chiều nghịch.
c) Ở phản ứng (2) nếu lượng hơi nước lấy dư nhiều lần so với khí carbon monoxide thì hiệu suất phản ứng sẽ tăng.
d) Khi tăng áp suất, cả hai phản ứng (1), (2) đều chuyển dịch theo chiều nghịch.
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chaterlier.
a. đúng
b. sai, phản ứng (2) là phản ứng tỏa nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận.
c. đúng
d. sai, khi tăng áp suất phản ứng (2) không đổi
a) Hydrogen chiếm 10,72% khối lượng phân tử.
b) Là một hợp chất carboxylic acid.
c) Công thức phân tử là C20H30O.
d) Carbon chiếm 72,10% khối lượng phân tử.
a) Hydrogen chiếm 10,72% khối lượng phân tử.
b) Là một hợp chất carboxylic acid.
c) Công thức phân tử là C20H30O.
d) Carbon chiếm 72,10% khối lượng phân tử.
Dựa vào công thức cấu tạo của retinol.
Công thức phân tử của vitamin A: C20H30O
a. sai, hydrogen chiếm 10,49% khối lượng phân tử.
b. sai, là hợp chất alcohol.
c. đúng
d. sai, carbon chiếm 83,91% khối lượng phân tử.
Bột đá vôi có thể được sử dụng để xử lí khí thải chứa sulfur dioxide từ các nhà máy điện đốt than và dầu mỏ. Phương trình hóa học của phản ứng là:
CaCO3(s) + SO2 (g) → CaSO3(g) + CO2(g)
a. Phản ứng trên là phản ứng oxi hóa – khử.
b. Cho giá trị enthalpy chuẩn của các hợp chất trong bảng sau đây. Từ đó xác định được phản ứng trên là phản ứng tỏa nhiệt.

c. Trong phản ứng trên, để phản ứng xảy ra nhanh thì đá vôi phải ở dạng viên lớn.
d. Calcium sulfite (CaSO3) thường được chuyển hóa thành thạch cao có công thức CaSO4.2H2O. Phản ứng ứng chuyển hóa này là một phản ứng oxi hóa - khử.
a. Phản ứng trên là phản ứng oxi hóa – khử.
b. Cho giá trị enthalpy chuẩn của các hợp chất trong bảng sau đây. Từ đó xác định được phản ứng trên là phản ứng tỏa nhiệt.

c. Trong phản ứng trên, để phản ứng xảy ra nhanh thì đá vôi phải ở dạng viên lớn.
d. Calcium sulfite (CaSO3) thường được chuyển hóa thành thạch cao có công thức CaSO4.2H2O. Phản ứng ứng chuyển hóa này là một phản ứng oxi hóa - khử.
Dựa vào công thức tính enthalpy của phản ứng.
a. đúng, vì có sự thay đổi số oxi hóa của C và S.
b. đúng
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(CaS{O_3}) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) - {\Delta _f}H_{298}^o(S{O_2})\\ = - 1634,9 + ( - 393,5) - ( - 1207,6) - ( - 296,8) = - 524kJ\end{array}\)
c. sai, cần nghiền nhỏ đá vôi để tăng diện tích bề mặt tiếp xúc.
d. đúng
Khi tiến hành thí nghiệm chuẩn độ acid-base, trong burrette đựng dung dịch NaOH, trong bình tam giác đựng dung dịch HCl (đã biết nồng độ) và thuốc thử phenolphtalein.
a) Khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng bền trong 30 giây thì dừng chuẩn độ.
b) Phải thực hiện chuẩn độ tối thiểu 3 lần
c) Tại điểm tương đương, thể tích NaOH bằng thể tích dung dịch HCl.
d) Khi chuẩn độ cần để chất lỏng chảy từ từ theo thành bình tam giác.
a) Khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng bền trong 30 giây thì dừng chuẩn độ.
b) Phải thực hiện chuẩn độ tối thiểu 3 lần
c) Tại điểm tương đương, thể tích NaOH bằng thể tích dung dịch HCl.
d) Khi chuẩn độ cần để chất lỏng chảy từ từ theo thành bình tam giác.
Dựa vào phương pháp chuẩn độ acid – base.
a) đúng
b) đúng
c) sai, thể tích NaOH và HCl phụ thuộc vào nồng độ ban đầu của 2 dung dịch.
d) sai, khi chuẩn độ cần để chất lỏng chảy từ từ xuống bình tam giác, không chảy vào thành vì sẽ làm sai số tăng lên.
Sulfur dioxide có khả năng tẩy trắng và sát trùng được dùng làm chất chống mốc cho các sản phẩm mây tre đan. Trong một ngày, làng nghề đốt cháy 12 kg lưu huỳnh để tạo thành khí SO2 sấy khô và chống nấm mốc cho đũa dùng một lần. Cứ sấy khô 1kg đũa cần 2300 kJ nhiệt lượng. Biết nhiệt tạo thành chuẩn của là -296,8kJ/ mol; hao hụt nhiệt là 20%. Hỏi một ngày làng nghề sản xuất được bao nhiêu kg đũa?
Đáp án:
Đáp án:
Dựa vào các dữ liệu đề bài cung cấp.
nS = 12/32 = 0,375 (kmol)
⟹ Nhiệt tạo thành khi đốt cháy 0,375 (kmol) = 0,375.103.296,8.0,8 = 89040 (kJ)
⟹ Một ngày làng nghề sản xuất được số kg đũa = 89040/2300 = 38,7 (kg)
Pha loãng 1 lít dung dịch NaOH có pH = 13 bằng bao nhiêu lít nước để được dung dịch mới có pH = 11?
Đáp án:
Đáp án:
Dựa vào cách pha loãng dung dịch.
Vì pH = 13 → [H+] = 10-13.
Vì pH = 11 → [ H+] = 10-11.
Để thu được dung dịch có pH = 11 thì 1.10-11 = V1.10-13 → V1 = 100 lít
Vậy thể tích nước thêm vào là: 100 – 1 = 99 lít
Từ tinh dầu hồi, người ta tách được anethol – một chất thơm được dùng sản xuất kẹo cao su. Để xác định công thức phân tử của hợp chất này người ta phân tích nguyên tố và đo phổ khối lượng. Kết quả phân tích được cho trong bảng sau:

Số nguyên tử H trong anethol là:
Đáp án:
Đáp án:
Số nguyên tử H trong anethol là:
Số nguyên tử C: \(\frac{{148.81,08}}{{12}} = 10\)
Số nguyên tử H: \(\frac{{148.8,1\% }}{1} = 12\)
Số nguyên tử O: \(\frac{{148.10,82\% }}{{16}} = 1\)
Số nguyên tử H trong anethol là 12
Cho các chất sau:
(a) CH3CH2OH (e) (CH3)2CHCH2CH2OH
(b) CH3CH2CH2OH (g) (CH3)3COH
(c) (CH3)2CHOH (h) HOCH2CH2OH
(d) (CH3)2CHCH2OH
Có bao nhiêu chất thuộc dãy đồng đẳng của CH3OH (methanol)?
Đáp án:
Đáp án:
Dựa vào khái niệm đồng đẳng.
(a) CH3CH2OH (e) (CH3)2CHCH2CH2OH
(b) CH3CH2CH2OH (g) (CH3)3COH
(c) (CH3)2CHOH
(d) (CH3)2CHCH2OH
Có 6 chất là đồng đẳng của CH3OH (methanol)
Chất nào sau đây không có cùng công thức đơn giản nhất là C2H2?
Mưa acid có thể bắt nguồn từ núi lửa, cháy rừng
Chất nào dưới đây không là chất điện li?
Cho các nhận định sau:
Tính chất nào sau đây không phải tính chất vật lí của sulfur?
Nếu ta dẫn khí SO2 từ từ đến dư vào dung dịch brom sẽ có phản ứng hóa học xảy ra kèm hiện tượng gì sau đây?
Cấu hình electron của nguyên tử S (Z=16) là:
Nguyên tố Sulfur có các số oxi hóa sau :
Dùng dung môi lỏng hòa tan chất hữu cơ để tách chúng ra khỏi hỗn hợp rắn là phương pháp:
Phản ứng thuận nghịch là phản ứng
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận