30 câu hỏi lý thuyết về nito có lời giải
Làm đề thiCâu hỏi 1 :
Nhận định nào sau đây không chính xác về nitơ (N2):
- A Nitơ là chất khí không màu.
- B Nitơ khá trơ ở điều kiện thường.
- C Nitơ tan tốt trong nước.
- D Nitơ chiếm nhiều nhất trong không khí.
Đáp án: C
Phương pháp giải:
Dựa vào tính chất của nito.
Lời giải chi tiết:
C sai vì nito là chất khí tan rất ít trong nước
Đáp án C
Câu hỏi 2 :
Khí nitơ có thể được tạo thành phản ứng hóa học nào sau đây?
- A Cho Cu phản ứng với HNO3 loãng
- B Nhiệt phân NH4NO3
- C Nhiệt phân AgNO3
- D Nhiệt phân NH4NO2
Đáp án: D
Lời giải chi tiết:
A. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
B. NH4NO3 → N2O + 2H2O
C. AgNO3 → Ag + NO2 + 1/2O2
D. NH4NO2 → N2 + 2H2O (t0)
Đáp án D
Câu hỏi 3 :
Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính Oxi hóa khi tham gia phản ứng ?
- A NH3, N2O5, N2, NO2
- B N2, NO, N2O, N2O5
- C NH3, NO, HNO3, N2O5
- D NO2, N2, NO, N2O3
Đáp án: D
Lời giải chi tiết:
Đáp án D
Câu hỏi 4 :
Tìm các tính chất không thuộc về khí nitơ?
a) Hóa lỏng ở nhiệt độ rất thấp −1960C)
b) Có khả năng đông nhanh
c) Tan nhiều trong nước
d) Nặng hơn Oxi
e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
- A a, c, d
- B a,b
- C c, d, e
- D b, c, e
Đáp án: C
Lời giải chi tiết:
Đáp án C
Câu hỏi 5 :
Khi có sấm sét, nitơ phản ứng với oxi trong không khí thu được sản phẩm là
- A NO.
- B N2O.
- C NO2.
- D N2O5.
Đáp án: A
Phương pháp giải:
Tính chất hóa học của N2.
Lời giải chi tiết:
PTHH: N2 + O2 \(\overset{tia lua dien}{\rightarrow}\) 2NO
Đáp án A
Câu hỏi 6 :
Trong công nghiệp, nitơ được sản xuất bằng phương pháp:
- A nhiệt phân muối amoni nitrat.
- B kim loại tác dụng với axit nitric.
- C chưng cất phân đoạn không khí lỏng.
- D phi kim tác dụng với axit nitric.
Đáp án: C
Phương pháp giải:
Dựa vào phương pháp điều chế khí nitơ.
Lời giải chi tiết:
Trong công nghiệp, sản xuất nitơ với số lượng lớn nên người ta dùng phương pháp chưng cất phân đoạn không khí lỏng.
Đáp án C
Câu hỏi 7 :
Phương trình để điều chế N2 trong phòng thí nghiệm là:
- A \(N{H_4}N{O_2}\xrightarrow{{{t^o}}}{N_2} \uparrow + {H_2}O\)
- B \(4N{H_3} + 4{O_2}\xrightarrow{{{t^o}}}2{N_2} + 6{H_2}O\)
- C \(5Mg + 12HN{O_3}\xrightarrow{{{t^o}}}5Mg{\left( {N{O_3}} \right)_2} + {N_2} \uparrow + 6{H_2}O\)
- D \(Khong\,khi\,long\xrightarrow{{chung\,cat\,phan\,doan}}{N_2} \uparrow + {O_2} \uparrow \)
Đáp án: A
Phương pháp giải:
Lý thuyết về nitơ.
Lời giải chi tiết:
Phương trình để điều chế N2 trong phòng thí nghiệm là:
\(N{H_4}N{O_2}\xrightarrow{{{t^o}}}{N_2} \uparrow + {H_2}O\)
Đáp án A
Câu hỏi 8 :
N2 tác dụng được với các chất nào trong số các chất sau (ở điều kiện thích hợp): H2; O2; Cl2; Mg; Li; CuO?
- A H2; O2; Mg.
- B H2; O2; Li.
- C H2; O2; Mg; CuO.
- D H2; O2; Mg; Li.
Đáp án: D
Phương pháp giải:
Dựa vào tính chất hóa học của nitơ.
Lời giải chi tiết:
N2 tác dụng được với các chất H2; O2; Mg; Li.
Các PTHH:
\({N_2} + 3{H_2}\overset {t,p,xt} \leftrightarrows 2N{H_3}\)
\({N_2}{\text{ }} + {\text{ }}{O_2}{\text{ }}\xrightarrow{{{{3000}^0}C}}{\text{ }}2NO\)
\({N_2}{\text{ }} + {\text{ }}3Mg{\text{ }}\xrightarrow{{{t^0}}}{\text{ }}M{g_3}{N_2}\)
\({N_2} + 6Li \to 2L{i_3}N\)
Đáp án D
Câu hỏi 9 :
Cho cân bằng hóa học:
\({N_2}\left( k \right) + 3{H_2}\left( k \right)\overset {{t^o},xt,p} \leftrightarrows 2N{H_3}\left( k \right);\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = - 92kJ\)
(a) Thêm vào khí N2
(b) Hóa lỏng amoniac để tách amoniac ra khỏi hỗn hợp phản ứng.
(c) Tăng áp suất của hệ phản ứng
(d) Giảm thể tích của hệ phản ứng
Các cách thực hiện giúp cân bằng chuyển dịch theo chiều thuận là
- A (a), (b).
- B (b), (c).
- C (a), (b), (d).
- D (a), (b), (c).
Đáp án: D
Phương pháp giải:
Lý thuyết về chuyển dịch cân bằng.
Lời giải chi tiết:
(a) Thêm N2 → cân bằng sẽ chuyển dịch theo chiều giảm lượng N2 → chiều thuận
(b) Tách NH3 ra khỏi hỗn hợp → cân bằng chuyển dịch theo chiều tăng lượng NH3 → chiều thuận
(c) Tăng áp suất → cân bằng chuyển dịch theo chiều giảm áp suất của hệ (tức giảm số mol khí) → chiều thuận
(d) Giảm thể tích của hệ → cân bằng chuyển dịch theo chiều tăng thể tích của hệ (tức tăng số mol khí) → chiều nghịch
Đáp án D
Câu hỏi 10 :
Cho phản ứng hóa học: NO2 + NaOH → NaNO2 + NaNO3 + H2O. Trong phản ứng trên, NO2 đóng vai trò là:
- A chất oxi hóa.
- B chất khử.
- C môi trường.
- D vừa là chất oxi hóa và chất khử.
Đáp án: D
Phương pháp giải:
Xét sự thay đổi số oxi hóa của N+4 (NO2):
+ Nhường e => chất khử
+ Nhận e => chất oxh
Lời giải chi tiết:
Ta thấy:
N+4 + 1e → N+3 (NaNO2)
N+4 - 1e → N+5 (NaNO3)
=> NO2 vừa nhường vừa nhận e nên vừa là chất oxi hóa vừa là chất khử
Đáp án D
Câu hỏi 11 :
Ứng dụng nào sau đây không phải của nitơ ?
- A
Làm môi trường trơ trong một số ngành công nghiệp.
- B
Bảo quản máu và các mẫu vật sinh học.
- C
Sản xuất axit nitric.
- D
Sản xuất phân lân.
Đáp án: D
Lời giải chi tiết:
Đáp án D
Câu hỏi 12 :
Trong không khí chứa nhiều nhất chất khí nào sau đây?
- A CO2.
- B NH3.
- C N2.
- D O2.
Đáp án: C
Lời giải chi tiết:
Không khí chiếm khoảng 78% N2 , 21% O2 và 1% còn lại là các khí khác
Đáp án C
Câu hỏi 13 :
Liên kết trong phân tử N2 là liên kết
- A liên kết cộng hóa trị có cực.
- B liên kết cộng hóa trị không cực.
- C liên kết ion.
- D cả A, B đều đúng.
Đáp án: B
Phương pháp giải:
HS cần nắm được tính chất vật lí của N2.
- Trạng thái: khí
- Màu: không màu
- Mùi vị: không vị
- Tan trong nước: ít
- Không độc nhưng không duy trì sự sống.
Lời giải chi tiết:
Hướng dẫn giải
N ≡ N
Liên kết trong phân tử N2 là liên kết cộng hóa trị không cực (do 2 nguyên tử nitơ có độ âm điện như nhau).
Đáp án B.
Câu hỏi 14 :
Nhận định nào sau đây đúng:
1. N2 là chất khí, không màu , không mùi, không vị.
2. N2 dễ tan trong nước tạo dung dịch axit.
3. N2 có tính độc.
4. N2 không duy trì sự sống.
- A 1,4
- B 1,2,3
- C 1,2,3,4
- D 1,3
Đáp án: A
Phương pháp giải:
Phương pháp: HS cần nắm được tính chất vật lí của N2.
- Trạng thái: khí
- Màu: không màu
- Mùi vị: không vị
- Tan trong nước: ít
- Không độc nhưng không duy trì sự sống.
Lời giải chi tiết:
Hướng dẫn giải
1. N2 là chất khí, không màu , không mùi không vị => đúng
2. N2 dễ tan trong nước tạo dung dịch axit=> Sai. Nitơ tan rất ít trong nước
3. N2 có tính độc => sai. Nitơ không độc
4. N2 không duy trì sự sống => đúng
Đáp án A.
Câu hỏi 15 :
Tại sao khí N2 lại trơ ở điều kiện thường?
- A Do liên kết ba trong phân tử khá trơ về mặt hóa học.
- B Do có cấu trúc tứ diện đều bền vững.
- C Do liên kết cộng hóa trị không phân cực.
- D Do tồn tại ở dạng phân tử.
Đáp án: A
Phương pháp giải:
Phương pháp:
Những chất có liên kết ba trong phân tử đều tương đối bền do năng lượng liên kết lớn.
Lời giải chi tiết:
Hướng dẫn giải
N ≡ N
Vì có liên kết ba với năng lượng liên kết lớn (E= 946kJ/mol) nên phân tử nitơ rất bền. Ở điều kiện thường, nitơ khá trơ về mặt hóa học.
Đáp án A.
Câu hỏi 16 :
Phản ứng nào sau đây thể hiện tính khử của N2?
- A 3Mg + N2->Mg3N2
- B N2 + O2 -> 2NO
- C 6Li + N2 -> 2Li3N
- D N2 + 3H2 -> 2NH3
Đáp án: B
Phương pháp giải:
Phương pháp:
- Xác định số oxi hóa của N trong các phản ứng, phản ứng nào số oxi hóa của N tăng => thể hiện tính khử.
Lời giải chi tiết:
Hướng dẫn giải:
A. 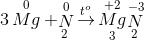 => tính oxi hóa
=> tính oxi hóa
B. 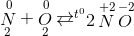 => tính khử
=> tính khử
C. 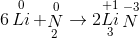 => tính oxi hóa
=> tính oxi hóa
D. 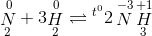 => tính oxi hóa
=> tính oxi hóa
Đáp án B.
Câu hỏi 17 :
Vị trí của nitơ (N) trong bảng hệ thống tuần hoàn là:
- A ô 14, chu kỳ 2, nhóm VA.
- B ô 14, chu kỳ 3, nhóm IIIA.
- C ô 7, chu kỳ 2, nhóm VA.
- D ô 7, chu kỳ 3, nhóm IIIA.
Đáp án: C
Lời giải chi tiết:
Đáp án C
Câu hỏi 18 :
Chất nào sau đây được điều chế trong công nghiệp bằng phương pháp chưng cất phân đoạn không khí lỏng?
- A oxi và nitơ.
- B clo và oxi
- C oxi và cacbonic.
- D oxi và ozon.
Đáp án: A
Lời giải chi tiết:
Không khí hóa lỏng sau đó nâng dần nhiệt độ ở -1960C ta thu được khí nito, ở -1830C ta thu được khí oxi
Đáp án A
Câu hỏi 19 :
Kim loại nào sau đây tác dụng với khí nitơ ở ngay nhiệt độ thường?
- A Na.
- B K.
- C Li.
- D Al.
Đáp án: C
Phương pháp giải:
Ghi nhớ tính chất hóa học của Nitơ
Lời giải chi tiết:
Nitơ tác dụng với kim loại Li ở nhiệt độ thường, còn tất cả các kim loại còn lại cần có nhiệt độ
6Li + 3N2 → 2Li3N
Đáp án C
Câu hỏi 20 :
Để điều chế một lượng nhỏ nitơ trong phòng thí nghiệm ta cần đun nóng hỗn hợp dung dịch bão hòa các muối:
- A NH4Cl và NH4NO2.
- B NaNO2 và NH4NO3.
- C NaNO2 và NH4Cl.
- D NH4Cl và NaNO3.
Đáp án: C
Phương pháp giải:
Dựa vào phương pháp điều chế N2 trong phòng thí nghiệm.
Lời giải chi tiết:
Trong phòng thí nghiệm, người ta điều chế N2 bằng cách đun nóng dung dịch NaNO2 và NH4Cl:
NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O
Đáp án C
Câu hỏi 21 :
Hợp chất nào sau đây N có số oxi hóa +5?
- A NaNO2.
- B HNO3.
- C NO2.
- D NO.
Đáp án: B
Phương pháp giải:
Xác định số oxh của N trong từng hợp chất, hợp chất nào có số oxh +5 thì chọn
Lời giải chi tiết:
\(\eqalign{
& A.\,Na\mathop N\limits^{ + 3} {O_2} \cr
& B.\,H\mathop N\limits^{ + 5} {O_3} \cr
& C.\,\,\mathop N\limits^{ + 4} {O_2} \cr
& D.\,\mathop N\limits^{ + 2} O \cr} \)
Đáp án B
Câu hỏi 22 :
Hiện tượng mưa axit chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là:
- A CO2 và O2.
- B NH3 và HCl.
- C SO2 và NO2.
- D H2S và N2.
Đáp án: C
Phương pháp giải:
dựa vào kiến thức hiểu biết thực tế với môi trường.
Lời giải chi tiết:
SO2 và NO2 là hai khí chính gây ra hiện tượng mưa axit do
SO2 + H2O \(\underset{{}}{\overset{{}}{\longleftrightarrow}}\) H2SO3
NO2 + O2 + H2O → HNO3
Các khí này tạo ra các axit, có tính oxi hóa gây ra nhiều hư hại tổn thất cho cuộc sống
Đáp án C
Câu hỏi 23 :
Cho X là oxit của nito, là chất khí ở điều kiện thường, có màu nâu đỏ. X là
- A N2O.
- B NO.
- C N2O5.
- D NO2.
Đáp án: D
Phương pháp giải:
Dựa vào màu sắc của oxit để đoán ra được oxit đó
Lời giải chi tiết:
NO2 là chất khí có màu nâu đỏ ở điều kiện thường
Đáp án D
Câu hỏi 24 :
Nhận xét nào về N2 là sai?
- A Ở điều kiện thường, N2 là chất khí
- B Phân tử N2 có chứa liên kết ba
- C Khí N2 tan rất tốt trong nước
- D Khí N2 không duy trì sự cháy và sự hô hấp
Đáp án: C
Lời giải chi tiết:
- A, B, D đúng
- C sai vì N2 tan rất ít trong nước
Đáp án C
Câu hỏi 25 :
Cho các phản ứng sau:
(1) N2 + O2 \(\overset{3000^{o}}{\rightarrow}\) 2NO
(2) N2 + 3H2 \(\rightleftharpoons \) 2NH3
Trong hai phản ứng trên thì nitơ
- A chỉ thể hiện tính khử.
- B thể hiện tính khử và tính oxi hóa.
- C chỉ thể hiện tính oxi hóa.
- D không thể hiện tính khử và tính oxi hóa.
Đáp án: B
Phương pháp giải:
Chất khử là chất nhường electron nên số oxi hóa tăng
Chất oxi hóa là chất nhận electron nên số oxi hóa giảm
Lời giải chi tiết:
(1) nitơ thể hiện tính khử vì số oxi hóa của N tăng N0 → N+2
(2) nitơ thể hiện tính oxi hóa vì số oxi hóa của N giảm N0 → N-3
Đáp án B
Câu hỏi 26 :
Phát biểu nào sau đây đúng ?
- A Khi tác dụng với kim loại hoạt động, N2 thể hiện tính khử.
- B Nitơ không duy trì sự hô hấp vì nitơ là 1 chất độc.
- C Vì phân tử nitơ có liên kết ba bền nên ở nhiệt độ thường khá trơ về mặt hóa học.
- D Sấm chớp trong các trận mưa dông có thể tạo ra khí N2O do N2 tác dụng với khí O2.
Đáp án: C
Phương pháp giải:
Lý thuyết về nito.
Lời giải chi tiết:
A sai vì N2 thể hiện tính oxi hóa N0 → N-3
B sai vì nitơ không phải khí độc
C đúng
D sai vì sản phẩm tạo ra là NO
Đáp án C
Câu hỏi 27 :
Chọn câu trả lời đúng. Trong các phản ứng oxi hóa - khử, nitơ
- A chỉ thể hiện tính khử.
- B không thể hiện tính khử và tính oxi hóa.
- C chỉ thể hiện tính oxi hóa.
- D thể hiện tính khử hoặc tính oxi hóa.
Đáp án: D
Phương pháp giải:
Dựa vào số oxi hóa của nguyên tử N trong phân tử N2 để đánh giá tính chất oxi hóa - khử của N2 trong các phản ứng hóa học.
+ Nếu số oxi hóa có thể tăng → Thể hiện tính khử
+ Nếu số oxi hóa có thể giảm → Thể hiện tính oxi hóa
Lời giải chi tiết:
Nguyên tử N trong phân tử N2 có số oxi hóa 0 là số oxi hóa trung gian nên vừa có thể tăng lên +1, +3, +5, +7 và giảm xuống -3.
Do đó trong các phản ứng hóa học thì N2 thể hiện tính khử hoặc tính oxi hóa.
Đáp án D
Câu hỏi 28 :
Trong những nhận xét dưới đây, nhận xét nào đúng?
- A Số oxi hóa của nitơ trong các hợp chất và ion NO, NH4+, NO3- lần lượt là +2, -3, +5.
- B Nitơ thể hiện tính khử khi tác dụng với khí H2 ở nhiệt độ, áp suất, xúc tác thích hợp.
- C Ở điều kiện thường, đơn chất N2 hoạt động hóa học hơn photpho.
- D Khí nitơ duy trì sự hô hấp và sự cháy.
Đáp án: A
Phương pháp giải:
Lý thuyết tổng hợp về nitơ và các hợp chất của nitơ.
Lời giải chi tiết:
- Số oxi hóa của nitơ trong các hợp chất và ion NO, NH4+, NO3- lần lượt là +2, -3, +5.
→ Đúng
- Nitơ thể hiện tính khử khi tác dụng với khí H2 ở nhiệt độ, áp suất, xúc tác thích hợp.
→ Sai, N2 phản ứng với H2 tạo NH3 có số oxi hóa giảm từ 0 xuống -3 nên N2 thể hiện tính oxi hóa.
- Ở điều kiện thường, đơn chất N2 hoạt động hóa học hơn photpho.
→ Sai, đơn chất N2 có liên kết ba rất bền nên khá trơ về mặt hóa học.
- Khí nitơ duy trì sự hô hấp và sự cháy.
→ Sai, khí duy trì sự hô hấp và sự cháy là O2.
Đáp án A
Câu hỏi 29 :
Cặp công thức của Litinitrua và nhôm nitrua là:
- A Li3N và AlN.
- B Li2N3 và Al2N3.
- C Li3N2 và Al3N2.
- D LiN3 và Al3N.
Đáp án: A
Phương pháp giải:
Trong hợp chất với kim loại, N thể hiện số oxi hóa -3
Lời giải chi tiết:
Công thức của litinitrua là Li3N
Công thức của nhôm nitrua là AlN
Đáp án A
Câu hỏi 30 :
Khí X được sinh ra dưới tác dụng của sấm sét (hoặc tia lửa điện). Khí X là khí không màu ở điều kiện thường, dễ dàng hóa nâu trong không khí tạo thành khí Y. Công thức hóa học của khí Y là
- A NO.
- B NO2.
- C SO2.
- D SO3.
Đáp án: B
Lời giải chi tiết:
Đáp án B
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 30 bài tập vận dụng về cracking ankan có lời giải
- 30 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải
- 20 câu hỏi lý thuyết về mở đầu hợp chất hữu cơ có lời giải (phần 2)
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 bài tập vận dụng về cracking ankan có lời giải
- 15 câu hỏi lý thuyết về phản ứng hữu cơ có lời giải
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 2)
- 30 câu hỏi ôn tập về công thức phân tử hợp chất hữu cơ có lời giải (phần 1)
- 10 bài tập vận dụng cao về công thức phân tử hợp chất hữu cơ có lời giải









