30 câu hỏi lý thuyết về hidro sunfua, lưu huỳnh dioxit và lưu huỳnh trioxit có lời giải
Làm đề thiCâu hỏi 1 :
Cho dung dịch Pb(NO3)2 vào dung dịch muối nào sau đây để xuất hiện kết tủa đen?
- A K2S
- B CaCl2
- C KI
- D AlBr3
Đáp án: A
Lời giải chi tiết:
A
K2S + Pb(NO3)2 → PbS ( kết tủa màu đen ) + 2 KNO3
Câu hỏi 2 :
Hóa chất dùng để phân biệt CO2 và SO2 là
- A nước brom
- B giấy quỳ tím
- C phenolphtalein
- D dung dịch nước vôi
Đáp án: A
Lời giải chi tiết:
A
SO2 làm mất màu nước brom còn CO2 thì không
SO2 + Br2 + 2 H2O → 2 HBr + H2SO4
Câu hỏi 3 :
Công thức phân tử của kali sunfua là
- A KHS.
- B K2SO3.
- C K2SO4.
- D K2S.
Đáp án: D
Lời giải chi tiết:
Công thức phân tử của kali sunfua là K2S
Đáp án D
Câu hỏi 4 :
Trong các oxit sau oxit nào không có tính khử:
- A CO
- B SO2
- C FeO
- D SO3
Đáp án: D
Phương pháp giải:
Dựa vào số oxi hóa của các nguyên tố để dự đoán chất không có tính khử.
Lời giải chi tiết:
Trong SO3, nguyên tố S có số oxi hóa là +6 là số oxi hóa cao nhất của S, không thể tăng lên được nên SO3 không có tính khử.
Đáp án D
Câu hỏi 5 :
Nhận xét nào sau đây là sai về tính chất của SO2:
- A SO2 làm mất màu cánh hoa hồng.
- B SO2 làm dung dịch phenolphtalein chuyển sang màu hồng.
- C SO2 làm quỳ tím tẩm ướt chuyển sang màu đỏ.
- D SO2 làm mất màu dung dịch nước brom.
Đáp án: B
Phương pháp giải:
Dựa vào tính chất hóa học của SO2: là oxit axit, vừa có tính oxi hóa vừa có tính khử.
Lời giải chi tiết:
Nhận xét B sai vì:
\(S{O_2} + {\rm{ }}{H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \;{H_2}S{O_3}\)
Dung dịch thu được có tính axit nên không làm phenolphtalein chuyển màu.
Đáp án B
Câu hỏi 6 :
Hidro sunfua có tính khử mạnh là do trong hợp chất H2S lưu huỳnh có số oxi hoá:
- A Cao nhất
- B Thấp nhất
- C Trung gian
- D Lý do khác
Đáp án: B
Lời giải chi tiết:
Hidro sunfua có tính khử mạnh là do trong hợp chất H2S lưu huỳnh có số oxi hoá:Thấp nhất (-2).
Đáp án B
Câu hỏi 7 :
Lưu huỳnh đioxit có thể tham gia vào các phản ứng hóa học sau:
SO2 + Br2 + H2O → 2HBr + H2SO4 (1);
SO2 + 2H2S → 3S + 2H2O (2)
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên:
- A Phản ứng (2): SO2 vừa là chất oxi hóa vừa là chất khử
- B Phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa
- C Phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử
- D Phản ứng (1): Br2 là chất oxi hóa, phản ứng (2): H2S là chất khử
Đáp án: A
Phương pháp giải:
Dựa vào khái niệm chất oxi hóa và chất khử:
- Chất khử là chất nhường e (số oxi hóa tăng)
- Chất oxi hóa là chất nhận e (số oxi hóa giảm)
Lời giải chi tiết:
Ở phản ứng (2): SO2+ 2H2S → 3S + 2H2O (2)
SO2 là chất oxi hóa, còn H2S là chất khử. Vậy phát biểu A không đúng.
Đáp án A
Câu hỏi 8 :
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
- A Có phản ứng oxi hóa - khử xảy ra
- B axit sunfuhiđric mạnh hơn axit sunfuric
- C axit sunfuric mạnh hơn axit sunfuhiđric
- D có kết tủa CuS tạo thành, không tan trong axit mạnh
Đáp án: D
Lời giải chi tiết:
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ: có kết tủa CuS tạo thành, không tan trong axit mạnh.
Đáp án D
Câu hỏi 9 :
Khi cho SO2 sục qua dung dịch X từ từ đến dư thấy xuất hiện kết tủa màu trắng sau đó kết tủa tan. X là dung dịch nào trong các dung dịch sau:
- A Dung dịch NaHCO3
- B Dung dịch NaOH
- C Dung dịch Ba(OH)2
- D Dung dịch H2S
Đáp án: C
Phương pháp giải:
Dựa vào tính chất hóa học của SO2 để xác định dung dịch X phù hợp.
Lời giải chi tiết:
Dung dịch X là dung dịch Ba(OH)2 vì:
- Ban đầu xuất hiện kết tủa:
SO2 + Ba(OH)2 → BaSO3 ↓ + H2O
- Sau đó kết tủa bị hòa tan:
SO2 + BaSO3 + H2O → Ba(HSO3)2
Đáp án C
Câu hỏi 10 :
Khi đốt cháy khí hidrosunfua trong điều kiện dư oxi thì sản phẩm cháy thu được gồm các chất nào sau đây ?
- A H2S và SO2
- B H2O và S
- C H2O và SO2
- D H2O và SO
Đáp án: C
Phương pháp giải:
Dựa vào tính chất hóa học của hiđrosunfua để lựa chọn sản phẩm đúng.
Lời giải chi tiết:
- Nếu đốt cháy H2S trong O2 dư:
\({2}{{H}_{2}}{S + 3}{{O}_{{2du}}}\xrightarrow{{{{t}^{0}}}}{2S}{{O}_{2}}{ + 2}{{H}_{2}}{O}\)
- Nếu đốt H2S trong O2 thiếu:
\({2}{{H}_{2}}{S + }{{O}_{{2}\,{thieu}}}\xrightarrow{{{{t}^{0}}}}{2S + 2}{{H}_{2}}{O}\)
Đáp án C
Câu hỏi 11 :
Ag để trong không khí bị biến thành màu đen do không khí bị nhiễm bẩn chất nào dưới đây?
- A SO2 và SO3.
- B HCl hoặc Cl2.
- C H2 hoặc hơi nước.
- D O3 hoặc H2S.
Đáp án: D
Lời giải chi tiết:
Khi không khí bị nhiễm O3 hoặc H2S thì Ag bị hóa đen do các phản ứng sau:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
2Ag + O3 → Ag2O + O2
Đáp án D
Câu hỏi 12 :
Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dung dịch NaOH 3M. Muối tạo thành sau phản ứng là
- A Na2SO3.
- B NaHSO3.
- C Na2SO4.
- D Na2SO3 và NaHSO3.
Đáp án: A
Phương pháp giải:
Lập tỉ lệ: nNaOH/nSO2 = (*)
+ Nếu (*) ≤ 1 thì tạo muối NaHSO3
+ Nếu 1 < (*) < 2 thì tạo 2 muối NaHSO3 và Na2SO3
+ Nếu (*) ≥ 2 thì tạo muối Na2SO3
Lời giải chi tiết:
Ta có: nNaOH : nSO2 = 0,3 : 0,1 = 3 > 2 => Tạo muối Na2SO3
Đáp án A
Câu hỏi 13 :
Dung dịch H2S để lâu trong không khí có hiện tượng:
- A Vẩn đục màu đen.
- B Vẩn đục màu vàng.
- C Cháy.
- D Không có hiện tượng.
Đáp án: B
Lời giải chi tiết:
Dung dịch H2S để lâu trong không khí có hiện tượng vẩn đục vàng do phản ứng hóa học sau:
2H2S + O2 → 2S ↓ vàng + 2H2O
Đáp án B
Câu hỏi 14 :
Thuốc thử có thể phân biệt hai chất khí riêng biệt SO2 và H2S là:
- A Dung dịch H2SO4 loãng
- B Dung dịch Br2
- C Dung dịch NaOH
- D Dung dịch Ba(OH)2
Đáp án: D
Phương pháp giải:
Nhận biết các chất vô cơ
Lời giải chi tiết:
- Sử dụng dung dịch Ba(OH)2 vì:
Ba(OH)2 + SO2 → BaSO3↓ + H2O
Ba(OH)2 + H2S → BaS(tan) + 2H2O
Đáp án D
Câu hỏi 15 :
Hiện tượng xảy ra khi dẫn từ từ đến dư SO2 vào dung dịch brom là:
- A Xuất hiện kết tủa màu vàng.
- B Dung dịch brom bị mất màu
- C Dung dịch brom có màu xanh
- D Không hiện tượng.
Đáp án: B
Phương pháp giải:
Tính chất hóa học của hợp chất lưu huỳnh
Lời giải chi tiết:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
=> Nước brom bị mất màu
Đáp án B
Câu hỏi 16 :
Đồ dùng bằng bạc để lâu ngày trong không khí bị sạm đen do phản ứng:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
Trong phản ứng trên chất đóng vai trò là chất khử?
- A H2S.
- B Ag.
- C O2.
- D Ag và H2S.
Đáp án: B
Phương pháp giải:
Xác định sự thay đổi số oxi hóa của 1 số nguyên tố
Chất nào có số oxi hóa tăng sau phản ứng thì chất đó đóng vai trò là chất khử.
Lời giải chi tiết:
\(4\mathop {Ag}\limits^0 {\rm{ }} + {\rm{ }}2{H_2}\mathop S\limits^{ - 2} {\rm{ }} + {\rm{ }}\mathop {{O_2}}\limits^0 \to {\rm{ }}2\mathop {A{g_2}S}\limits^{ + 1{\rm{ }} - 2} {\rm{ }} + {\rm{ }}2{H_2}O\)
Ag có số oxi hóa tăng sau phản ứng → Ag là chất khử
Đáp án B
Câu hỏi 17 :
Cho phản ứng: SO2 + 2H2S → 3S + 2H2O. Câu nào diễn tả đúng tính chất của các chất ?
- A SO2 bị oxi hóa và H2S bị khử.
- B SO2 bị khử và H2S bị oxi hóa.
- C SO2 khử H2S và không có chất nào bị oxi hóa.
- D SO2 bị khử, lưu huỳnh bị oxi hóa.
Đáp án: B
Phương pháp giải:
Xác định sự thay đổi số oxi hóa của nguyên tố trong phản ứng, từ đó xác định được chất khử và chất oxi hóa
quá trình làm giảm số oxi hóa của 1 chất là quá trình khử
quá trình làm tăng số oxi hóa của 1 chất là quá trình oxi hóa.
Lời giải chi tiết:
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}2{H_2}\mathop S\limits^{ - 2} \to 3\mathop S\limits^0 {\rm{ }} + {\rm{ }}2{H_2}O\)
- SO2 là chất oxi hóa (bị khử) và H2S là chất khử (bị oxi hóa)
Đáp án B
Câu hỏi 18 :
Phản ứng hóa học chứng tỏ SO2 là chất oxi hóa:
- A 2H2S + SO2 ® 3S + 2H2O
- B SO2 + CaO ® CaSO3
- C SO2 + Cl2 + 2H2O ® 2HCl + H2SO4
- D SO2 + NaOH ® NaHSO3.
Đáp án: A
Phương pháp giải:
- SO2 là chất oxi hóa tức là số oxi hóa của S trong SO2 giảm.
Lời giải chi tiết:
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}2{H_2}\mathop S\limits^{ - 2} \to 3\mathop S\limits^0 {\rm{ }} + {\rm{ }}2{H_2}O\)\(\to 2HCl{\rm{ }} + {\rm{ }}{H_2}\mathop S\limits^{ + 6} {O_4}\)
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}CaO \to Ca\mathop S\limits^{ + 4} {O_3}\)
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}NaOH \to NaH\mathop S\limits^{ + 4} {O_3}\)
Đáp án A
Câu hỏi 19 :
Cho các phản ứng sau: 2SO2 + O2 → 2SO3 (I) SO2 + 2H2S → 3S + 2H2O (II) SO2 + Br2 + 2H2O → H2SO4 + 2HBr (III) SO2 + NaOH → NaHSO3 (IV)
Các phản ứng mà SO2 có tính khử là:
- A (I) và (III).
- B (I) và (II).
- C (I) , (II) và (III).
- D (III) và (IV).
Đáp án: A
Phương pháp giải:
SO2 thể hiện tính khử tức là số oxi hóa của S tăng lên +6 trong hợp chất
Lời giải chi tiết:
\(2\mathop S\limits^{ + 4} {O_2} + {\rm{ }}{O_2} \to 2\mathop S\limits^{ + 6} {O_3}\)
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}2{H_2}\mathop S\limits^{ - 2} \to 3\mathop S\limits^0 {\rm{ }} + {\rm{ }}2{H_2}O\)
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}B{r_2} + {\rm{ }}2{H_2}O \to {H_2}\mathop S\limits^{ + 6} {O_4} + {\rm{ }}2HBr\)
\(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}NaOH \to NaH\mathop S\limits^{ + 4} {O_3}\)
Đáp án A
Câu hỏi 20 :
Dẫn khí SO2 vào lượng dư dung dịch Ca(OH)2, muối gì được tạo thành?
- A CaSO4.
- B CaSO3.
- C Ca(HSO3)2.
- D Ca(HSO4)2.
Đáp án: B
Phương pháp giải:
Dung dịch kiềm dư thì muối tạo thành là muối trung hòa.
Lời giải chi tiết:
SO2 +Ca(OH)2 dư → CaSO3 + H2O
Đáp án B
Câu hỏi 21 :
SO2 vừa có tính oxi hoá, vừa có tính khử vì trong phân tử SO2
- A S có mức oxi hoá trung gian.
- B S có mức oxi hoá thấp nhất.
- C S còn có một đôi electron tự do.
- D S có mức oxi hoá cao nhất.
Đáp án: A
Phương pháp giải:
Xác định số oxi hóa của S có trong SO2 từ đó so sánh với số oxi hóa có thể có của S để kết luận
Lời giải chi tiết:
Các số oxi hóa có thể có của S là: -2; 0; +4; +4
Số oxi hóa của S trong SO2 là +4 → số oxi hóa ở mức trung gian nên vừa có tính khử, vừa có tính oxi hóa
Đáp án A
Câu hỏi 22 :
Phương trình phản ứng thể hiện tính oxi hóa của SO2 là
- A SO2 + H2O → H2SO3
- B SO2 + Cl2 + H2O → H2SO4 + 2HCl
- C SO2 + 2H2S → 3S + 2H2O
- D SO2 + KOH → KHSO3
Đáp án: C
Phương pháp giải:
số oxi hóa của S trong SO2 là +4
Phản ứng SO2 thể hiện tính oxi hóa khi số oxi hóa của S giảm sau phản ứng.
Lời giải chi tiết:
A. \(\mathop S\limits^{ + 4} {O_2} + {H_2}O \to {H_2}\mathop S\limits^{ + 4} {O_3}\)
B. \(\begin{array}{l}\mathop S\limits^{ + 4} {O_2} + \mathop {C{l_2}}\limits^0 + {H_2}O \to {H_2}\mathop S\limits^{ + 4} {O_4} + 2H\mathop {Cl}\limits^{ - 1} \\CK\,\,\,\,\,\,\,\,OXH\end{array}\)
C. \(\begin{array}{l}\mathop S\limits^{ + 4} {O_2} + {H_2}\mathop S\limits^{ - 2} \to 3\mathop S\limits^0 + 2{H_2}O\\OXH\,\,\,\,CK\end{array}\)
D. \(\mathop S\limits^{ + 4} {O_2} + KOH \to {K_2}\mathop S\limits^{ + 4} {O_3} + {H_2}O\)
Đáp án C
Câu hỏi 23 :
Dẫn khí H2S vào dung dịch muối Pb(NO3)2, hiện tượng quan sát được là
- A dung dịch có màu vàng.
- B có kết tủa màu vàng.
- C có kết tủa màu đen.
- D có kết tủa màu trắng.
Đáp án: C
Phương pháp giải:
Dựa vào phương trình hóa học để nêu hiện tượng xảy ra.
Lời giải chi tiết:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Vậy hiện tượng quan sát được là có kết tủa màu đen (PbS) xuất hiện.
Đáp án C
Câu hỏi 24 :
Khí sunfurơ là một khí không màu, mùi hắc, dễ tan trong nước và là một trong số chất chính gây ra mưa axit. Công thức hóa học của khí sunfurơ là
- A SO3.
- B S.
- C H2S.
- D SO2
Đáp án: D
Phương pháp giải:
Từ tên gọi suy ra công thức hóa học
Lời giải chi tiết:
Công thức hóa học khí khí sunfurơ là SO2
Đáp án D
Câu hỏi 25 :
Trong phòng thí nghiệm, khi tiến hành thí nghiệm cho mảnh đồng vào ống nghiệm của H2SO4 đặc, đun nóng thấy sinh ra chất khí SO2 có mùi hắc, độc. Biện pháp nào sau đây xử lí thoát ra chống ô nhiễm môi trường?
- A Dùng bông tẩm dung dịch H2SO4 đặt lên miệng ống nghiệm.
- B Dùng bông tẩm cồn (ancol etylic) đặt lên miệng ống nghiệm
- C Dùng bông tẩm dung dịch NaOH đặt lên miệng ống nghiệm
- D Dùng bông tẩm nước đặt lên miệng ống nghiệm
Đáp án: C
Phương pháp giải:
Chọn chất có khả năng phản ứng với SO2 tạo ra sản phẩm không độc và không gây ô nhiễm môi trường.
Lời giải chi tiết:
Dùng bông tẩm dung dịch NaOH đặt lên miệng ống nghiệm vì NaOH có pư với SO2 theo PTHH
2NaOH + SO2 → Na2SO3 + H2O
PTHH trên sinh ra Na2SO3 không độc nên không gây hại cho môi trường.
Đáp án C
Câu hỏi 26 :
Cho biết phản ứng nào xảy ra trong bình cầu?
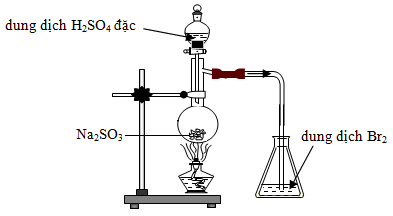
- A SO2 + Br2 + 2H2O → 2HBr + H2SO4
- B Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
- C 2SO2 + O2 → 2SO3
- D Na2SO3 + Br2 + H2O → Na2SO4 + 2HBr
Đáp án: B
Phương pháp giải:
Dựa vào tính chất hóa học của các chất.
Lời giải chi tiết:
Phản ứng xảy ra trong bình cầu là: Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O.
Đáp án B
Câu hỏi 27 :
Khi sục SO2 vào dung dịch H2S thì
- A Dung dịch bị vẩn đục màu vàng.
- B Tạo thành chất rắn màu đỏ.
- C Không có hiện tượng gì.
- D Dung dịch chuyển thành màu nâu đen.
Đáp án: A
Phương pháp giải:
Viết phương trình hóa học và dựa vào tính chất vật lí của các chất để nêu hiện tượng xảy ra.
Lời giải chi tiết:
Khi sục SO2 vào dung dịch H2S thì xảy ra phản ứng: SO2 + 2H2S → 3S↓ + 2H2O
Vậy hiện tượng là dung dịch bị vẩn đục màu vàng (S).
Đáp án A
Câu hỏi 28 :
Trong phòng thí nghiệm, khí hiđrosunfua được điều chế bằng phản ứng nào sau đây?
- A FeS + HNO3 loãng.
- B FeS + HNO3 đặc.
- C FeS + HCl.
- D FeS + H2SO4 đặc.
Đáp án: C
Phương pháp giải:
Nguyên tắc điều chế H2S trong phòng thí nghiệm:
Cho muối sunfua (trừ PbS, CuS, Ag2S,...) + dung dịch axit mạnh như HCl, H2SO4 loãng.
Lời giải chi tiết:
Trong phòng thí nghiệm, khí hiđrosunfua được điều chế bằng phản ứng:
FeS + 2HCl → FeCl2 + H2S ↑
Đáp án C
Câu hỏi 29 :
Ở điều kiện thường hiđro sunfua là chất khí, mùi trứng thối và rất độc. Công thức của hiđro sunfua là
- A SO2.
- B SO3.
- C H2S.
- D H2SO3.
Đáp án: C
Lời giải chi tiết:
Công thức của hidro sunfua là H2S.
Đáp án C
Câu hỏi 30 :
Trong phòng thí nghiệm, điều chế một lượng lớn SO2 (để thực hành thí nghiệm) ta dùng phản ứng có phương trình hóa học là
- A 2H2S + 3O2 → 2SO2 + 2H2O.
- B 4FeS2 + 11O2 → 2Fe2O3 + 8SO2.
- C Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
- D Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O.
Đáp án: D
Phương pháp giải:
Nguyên tắc điều chế khí SO2 trong phòng thí nghiệm là cho muối sunfit tác dụng với dung dịch HCl hoặc H2SO4 loãng.
Lời giải chi tiết:
Nguyên tắc điều chế khí SO2 trong phòng thí nghiệm là cho muối sunfit tác dụng với dung dịch HCl hoặc H2SO4 loãng.
Vậy trong phòng thí nghiệm, điều chế một lượng lớn SO2 (để thực hành thí nghiệm) ta có thể dùng phản ứng có phương trình hóa học là: Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Đáp án D
10 bài tập về phản ứng H2S, SO2, SO3 phản ứng với dung dịch kiềm có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
30 bài tập luyện tập về về H2S, SO2, SO3 có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









