30 câu hỏi lý thuyết về cân bằng hóa học có lời giải (phần 2)
Làm đề thiCâu hỏi 1 :
Cho phản ứng hóa học:
N2 + 3H2 \(\overset {Fe,p} \leftrightarrows \) 2NH3 ; ΔH < 0.
Trong phản ứng tổng hợp amoniac, yếu tố nào sau đây không làm thay đổi trạng thái cân bằng hóa học?
- A Nồng độ của N2 và H2.
- B Áp suất chung của hệ.
- C Chất xúc tác Fe.
- D Nhiệt độ của hệ.
Đáp án: C
Phương pháp giải:
Chất xúc tác không làm ảnh hưởng tới chuyển dịch cân bằng hóa học.
Lời giải chi tiết:
Chất xúc tác chỉ làm cho cân bằng nhanh chóng được thiết lập, không chuyển dịch cân bằng.
Đáp án C
Câu hỏi 2 :
Cho cân bằng hóa học sau:
2SO2 (k) +O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k); ∆H < 0
Cho các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
- A (1), (2), (4), (5)
- B (2), (3), (5)
- C (2), (3), (4), (6)
- D (1), (2), (4).
Đáp án: B
Lời giải chi tiết:
Dựa vào phản ứng: 2SO2 (k) +O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k); ∆H < 0
- Đây là một phản ứng tỏa nhiệt (∆H < 0).
- Có sự chênh lệch số mol trước và sau phản ứng.
Vì vậy, các yếu tố làm cân bằng dịch chuyển theo chiều thuận là:
+ Hạ nhiệt độ (3).
+ Tăng áp suất (2).
+ Giảm nồng độ SO3 (5).
Đáp án B
Câu hỏi 3 :
Để cân bằng 2SO2 (k) + O2 \(\overset {} \leftrightarrows \) 2SO3 (k); ΔH < 0 chuyển dịch theo chiều thuận, cách làm nào sau đây không đúng?
- A Tăng nồng độ của SO2.
- B Giảm nồng độ của SO3.
- C Tăng nhiệt độ của phản ứng.
- D Tăng áp suất chung của phản ứng.
Đáp án: C
Phương pháp giải:
Dựa vào nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Lời giải chi tiết:
Từ phản ứng: 2SO2 (k) + O2 \(\overset {} \leftrightarrows \) 2SO3 (k); ΔH < 0
- Đây là phản ứng toả nhiệt (DH < 0)
- Có sự chênh lệch số mol khí trước và sau phản ứng, do đó áp suất ảnh hưởng đến sự chuyển dịch cân bằng.
Xét các biện pháp:
A tăng nồng độ SO2 => CB chuyển dịch theo chiều giảm nồng độ SO2 (chiều thuận)
B giảm nồng độ SO3 => CB chuyển dịch theo chiều làm tăng nồng độ SO3 (chiều thuận)
C tăng nhiệt độ của phản ứng => CB chuyển dịch theo chiều thu nhiệt (chiều nghịch)
D tăng áp suất chung của hệ => CB chuyển dịch theo chiều làm giảm số mol phân tử khí (chiều thuận)
Đáp án C
Câu hỏi 4 :
Cho cân bằng sau trong bình kín:
2NO2(k) \(\overset {} \leftrightarrows \) N2O4(k)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
- A ∆H > 0, phản ứng tỏa nhiệt
- B ∆H < 0, phản ứng tỏa nhiệt
- C ∆H > 0, phản ứng thu nhiệt
- D ∆H < 0, phản ứng thu nhiệt.
Đáp án: B
Phương pháp giải:
Ghi nhớ câu “tăng – thu; giảm – tỏa” tức là khi tăng nhiệt độ cân bằng chuyển dịch theo chiều thu nhiệt; khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tỏa nhiệt.
Lời giải chi tiết:
Ta có: 2NO2(k) \(\overset {} \leftrightarrows \) N2O4(k)
Khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần, chứng tỏ phản ứng xảy ra theo chiều thuận, vì vậy phản ứng trên là phản ứng tỏa nhiệt (∆H < 0).
Đáp án B
Câu hỏi 5 :
Cho các cân bằng sau trong các bình riêng biệt:
(1) H2 (k, không màu) + I2 (k, tím) \( \rightleftarrows \) 2HI (k, không màu)
(2) 2NO2 (k, nâu đỏ) \( \rightleftarrows \) N2O4 (k, không màu)
Nếu làm giảm thể tích bình chứa của cả 2 hệ trên, so với ban đầu thì màu của
- A hệ (1) hệ (2) đều đậm lên.
- B hệ (1) không thay đổi; hệ (2) nhạt đi.
- C hệ (1) và hệ (2) đều nhạt đi.
- D hệ (1) đậm lên; hệ (2) nhạt đi.
Đáp án: B
Phương pháp giải:
Làm giảm thể tích tức là làm tăng áp suất => CB chuyển dịch về phía làm giảm số mol phân tử khí
Lời giải chi tiết:
Làm giảm thể tích tức là làm tăng áp suất => CB chuyển dịch về phía làm giảm số mol phân tử khí
(1) do số mol phân tử khí ở 2 bên là như nhau nên thay đổi áp suất không ảnh hưởng đến chuyển dịch CB
(2) cân bằng chuyển dịch theo chiều thuận => màu nhạt đi
Đáp án B
Câu hỏi 6 :
Trong bình kín có hệ cân bằng hóa học sau:
\(C{O_2}(k)\, + \,{H_2}\,(k) \rightleftarrows \,CO(k)\, + {H_2}O(k);\,\,\Delta H > 0\)
Xét các tác động sau đến hệ cân bằng:
(a) Tăng nhiệt độ;
(b) Thêm một lượng hơi nước;
(c) Giảm áp suất chung của hệ;
(d) Dùng chất xúc tác;
(e) Thêm một lượng CO2;
Trong những tác động trên, các tác động làm cân bằng chuyển dịch theo chiều thuận là
- A (a), (c) và (e)
- B (a) và (e)
- C (d) và (e)
- D (b), (c) và (d)
Đáp án: B
Phương pháp giải:
Dựa vào nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
+ Tăng nhiệt làm CB chuyển dịch theo chiều thu nhiệt và ngược lại.
+ Tăng nồng độ làm CB chuyển dịch theo chiều làm giảm số mol chất đó và ngược lại.
+ Tăng áp suất làm CB chuyển dịch theo chiều làm giàm số mol phân tử khí và ngược lại.
Lời giải chi tiết:
(a) Tăng nhiệt độ => CB chuyển dịch theo chiều thu nhiệt => chiều thuận
(b) Thêm một lượng hơi nước => CB chuyển dịch theo chiều làm giảm lượng H2O => chiều nghịch
(c) Giảm áp suất chung => không chuyển dịch do số mol khí ở 2 bên bằng nhau
(d) Dùng chất xúc tác => không chuyển dịch
(e) Thêm CO2 => CB chuyển dịch theo chiều làm giảm lượng CO2 => chiều thuận
Đáp án B
Câu hỏi 7 :
Cho các cân bằng hóa học sau:
(a) H2(k) + I2(k) \( \rightleftarrows \) 2HI (k).
(b) 2NO2(k) \( \rightleftarrows \) N2O4(k).
(c) 3H2(k) + N2(k) \( \rightleftarrows \) 2NH3(k).
(d) 2SO2(k) + O2(k) \( \rightleftarrows \) 2SO3(k).
Ở nhiệt độ không đổi, khi thay đổi áp suất chung của mỗi hệ cân bằng, cân bằng hóa học nào ở trên không bị chuyển dịch?
- A (d).
- B (c).
- C (a).
- D (b).
Đáp án: C
Phương pháp giải:
Sự thay đổi áp suất chỉ ảnh hưởng đến những CB có tổng hệ số mol khí ở 2 vế khác nhau.
Lời giải chi tiết:
Khi thay đổi áp suất chung của hệ. Chỉ có nhưng cân bằng mà tổng hệ số các chất khí bằng nhau ở 2 vế mới không bị ảnh hưởng.
Đáp án C
Câu hỏi 8 :
Cho các cân bằng sau:
(1) 2SO2(k) + O2(k) \(\overset {xt,{t^0}} \leftrightarrows \) 2SO3(k)
(2) N2(k) + 3H2 \(\overset {xt,{t^0}} \leftrightarrows \) 2NH3(k)
(3) CO2(k) + H2(k) \(\overset {xt,{t^0}} \leftrightarrows \) CO (k) + H2O (k)
(4) 2HI (k) \(\overset {xt,{t^0}} \leftrightarrows \) H2(k) + I2 (k)
(5) CH3COOH (l) + C2H5OH (l) \(\overset {xt,{t^0}} \leftrightarrows \) CH3COOC2H5 (l) + H2O (l)
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là
- A (3), (4) và (5).
- B (3) và (4).
- C (1) và (2).
- D (2), (4) và (5).
Đáp án: A
Phương pháp giải:
Các cân bằng có số mol 2 vế bằng nhau sẽ không chịu ảnh hưởng từ thay đổi áp suất
Lời giải chi tiết:
Các cân bằng có số mol 2 vế bằng nhau sẽ không chịu ảnh hưởng từ thay đổi áp suất
Vậy các phản ứng không chuyển dịch khi thay đổi áp suất là: (3), (4) và (5)
Đáp án A
Câu hỏi 9 :
Cho các cân bằng hoá học:
N2 (k) + 3H2 (k) \(\overset {} \leftrightarrows \) 2NH3 (k) (1)
H2 (k) + I2 (k) \(\overset {} \leftrightarrows \) 2HI (k) (2)
2SO2 (k) + O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k) (3)
2NO2 (k) \(\overset {} \leftrightarrows \) N2O4 (k) (4)
Khi thay đổi áp suất những cân bằng hóa học bị chuyển dịch là:
- A (1), (2), (3).
- B (2), (3), (4).
- C (1), (2), (4).
- D (1), (3), (4).
Đáp án: D
Phương pháp giải:
Áp suất chỉ ảnh hưởng đến những cân bằng có sự chênh lệch số mol khí ở 2 vế của phương trình.
Lời giải chi tiết:
Những cân bằng bị chuyển dịch khi thay đổi áp suất là: (1), (3), (4).
Đáp án D
Câu hỏi 10 :
Cho các cân bằng sau :
(1) 2SO2(k) + O2(k) \( \rightleftarrows \) 2SO3(k)
(2) N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k)
(3) CO2(k) + H2(k) \( \rightleftarrows \) CO(k) + H2O(k)
(4) 2HI (k) \( \rightleftarrows \) H2 (k) + I2 (k)
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là
- A (1) và (2).
- B (1) và (3).
- C (3) và (4).
- D (2) và (4).
Đáp án: C
Phương pháp giải:
Áp suất chỉ ảnh hưởng đến những cân bằng có sự chênh lệch số mol khí ở 2 vế của phương trình.
Lời giải chi tiết:
Những cân bằng không bị chuyển dịch khi thay đổi áp suất là: (3) và (4)
Đáp án C
Câu hỏi 11 :
Cho cân bằng (trong bình kín) sau: \(CO(k) + {H_2}O(k) \rightleftarrows C{O_2}(k) + {H_2}(k)\) ; ΔH < 0
Trong các yếu tố : (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là :
- A (1), (4), (5)
- B (1), (2), (4)
- C (1), (2), (3)
- D (2), (3), (4)
Đáp án: C
Phương pháp giải:
Những yếu tố ảnh hưởng đến cân bằng hóa học:
- Nồng độ
- Nhiệt độ
- Áp suất (nếu có sự chênh lệch số mol khí 2 vế của cân bằng)
Lời giải chi tiết:
Như vậy các yếu tố ảnh hưởng đến cân bằng trên là:
(1) tăng nhiệt độ (yếu tố nhiệt độ) => có ảnh hưởng
(2) thêm một lượng hơi nước (yếu tố nồng độ) => có ảnh hưởng
(3) thêm một lượng H2 (yếu tố nồng độ) => có ảnh hưởng
Chú ý:
(4) tăng áp suất chung của hệ => không ảnh hưởng vì không có sự chênh lệch về số mol khí 2 vế của CB
(5) dùng chất xúc tác => không ảnh hưởng
Đáp án C
Câu hỏi 12 :
(A–2010) Cho cân bằng 2SO2 (k) + O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là :
- A Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
- B Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
- C Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
- D Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án: B
Lời giải chi tiết:
Ta thấy khối lượng khí 2 vế không thay đổi.
Khi tăng nhiệt thì M giảm => n tăng => CB chuyển dịch theo chiều ngịch => Chiều nghịch là chiều thu nhiệt
Như vậy: Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án B
Câu hỏi 13 :
(B-2010) Cho các cân bằng sau
(I) 2HI (k) \(\overset {} \leftrightarrows \) H2 (k) + I2 (k) ;
(II) CaCO3 (r) \(\overset {} \leftrightarrows \) CaO (r) + CO2 (k) ;
(III) FeO (r) + CO (k) \(\overset {} \leftrightarrows \) Fe (r) + CO2 (k) ;
(IV) 2SO2 (k) + O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k)
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
- A 4
- B 3
- C 2
- D 1
Đáp án: D
Phương pháp giải:
Giảm áp suất CB chuyển dịch theo chiều làm tăng số mol phân tử khí và ngược lại.
Lời giải chi tiết:
Giảm áp suất CB chuyển dịch theo chiều làm tăng số mol phân tử khí:
Xét các cân bằng:
(I) không ảnh hưởng vì số mol phân tử khí 2 vế bằng nhau
(II) CB chuyển dịch theo chiều thuận
(III) không ảnh hưởng vì số mol phân tử khí 2 vế bằng nhau
(IV) CB chuyển dịch theo chiều nghịch
Đáp án D
Câu hỏi 14 :
(B-2012) Cho phản ứng: N2(k) + 3H2(k) \(\overset {} \leftrightarrows \) 2NH3 (k); ∆H = –92 kJ. Hai biện pháp đều làm cân bằng chuyển dịch theo chiều thuận là
- A giảm nhiệt độ và giảm áp suất.
- B tăng nhiệt độ và tăng áp suất.
- C giảm nhiệt độ và tăng áp suất.
- D tăng nhiệt độ và giảm áp suất.
Đáp án: C
Phương pháp giải:
Giảm nhiệt độ CB chuyển dịch theo chiều tỏa nhiệt và ngược lại
Giảm áp suất CB chuyển dịch theo chiều tăng số mol phân tử khí và ngược lại
Lời giải chi tiết:
Từ CB: N2(k) + 3H2(k) \(\overset {} \leftrightarrows \) 2NH3 (k); ∆H = –92 kJ
Chiều thuận là chiều tỏa nhiệt
Do vậy muốn CB chuyển dịch theo chiều thuận là:
- Giảm nhiệt độ
- Tăng áp suất
Đáp án C
Câu hỏi 15 :
(A-2013) Cho các cân bằng hóa học sau:
(a) H2 (k) + I2 (k) \(\overset {} \leftrightarrows \) 2HI (k).
(b) 2NO2 (k) \(\overset {} \leftrightarrows \) N2O4 (k).
(c) 3H2 (k) + N2 (k) \(\overset {} \leftrightarrows \) 2NH3 (k).
(d) 2SO2 (k) + O2 (k) \(\overset {} \leftrightarrows \) 2SO3 (k).
Ở nhiệt độ không đổi, khi thay đổi áp suất chung của mỗi hệ cân bằng, cân bằng hóa học nào ở trên không bị chuyển dịch?
- A (b).
- B (a).
- C (c).
- D (d).
Đáp án: B
Phương pháp giải:
Áp suất chỉ ảnh hưởng đến những cân bằng có sự chênh lệch số mol khí ở 2 vế của phương trình.
Lời giải chi tiết:
Cân bằng không bị chuyển dịch khi thay đổi áp suất là: (a)
Đáp án B
Câu hỏi 16 :
Cho cân bằng (trong bình kín) sau:
CO (k) + H2O (k) ⇄ CO2 (k) + H2 (k) ΔH < 0
Trong các yếu tố:(1) tăng nhiệt độ;(2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là:
- A
(2), (3), (4).
- B
(1), (2), (3).
- C (1), (2), (4).
- D (1), (4), (5).
Đáp án: B
Phương pháp giải:
Những yếu tố ảnh hưởng đến chuyển dịch cân bằng:
- Nhiệt độ
- Áp suất (đối với các cân bằng có sự chênh lệch về số mol chất khí ở 2 vế)
- Nồng độ
Chú ý: Chất xúc tác không làm chuyển dịch cân bằng
Lời giải chi tiết:
(1) tăng nhiệt độ => phản ứng sẽ theo chiều làm giảm nhiệt độ đi => chuyển dịch theo chiều nghịch
(2) thêm một lượng hơi nước => phản ứng theo chiều làm giảm nước đi => chuyển dịch theo chiều thuận
(3) thêm một lượng H2; => phản ứng theo chiều làm giảm H2 đi => chuyển dịch theo chiều nghịch
(4) tăng áp suất chung của hệ . Vì tổng hệ số cân bằng của chất khí ở 2 bên là bằng nhau nên cân bằng không chuyển dịch
(5) dùng chất xúc tác. Chỉ làm tăng tốc độ của phản ứng chứ không làm chuyển dịch cân bằng
Đáp án B
Câu hỏi 17 :
Cho các cân bằng hóa học sau:
\({{\text{N}}_{\text{2}}}{\text{(k) + 3}}{{\text{H}}_{\text{2}}}{\text{(k)}}\overset {{t^o},xt,p} \leftrightarrows {\text{2N}}{{\text{H}}_{\text{3}}}{\text{(k)}}\) (1)
\({{\text{H}}_{\text{2}}}{\text{(k) + }}{{\text{I}}_{\text{2}}}{\text{(k)}} \rightleftarrows {\text{2HI(k)}}\) (2)
\(2S{O_2}\left( k \right){\text{ }} + {\text{ }}{O_2}\overset {xt} \leftrightarrows \left( k \right)\;2S{O_3}\left( k \right)\) (3)
\({\text{2N}}{{\text{O}}_{\text{2}}}{\text{(k)}} \rightleftarrows {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}{\text{(k)}}\) (4)
Khi thay đổi áp suất những cân bằng hóa học bị chuyển dịch là:
- A (1), (2), (3).
- B (2), (3), (4).
- C (1), (3), (4).
- D (1), (2), (4).
Đáp án: C
Phương pháp giải:
Yếu tố thay đổi áp suất làm chuyển dịch cân bằng chỉ xảy ra đối với những phản ứng có hệ số cân bằng của chất khí ở 2 bên là khác nhau
Lời giải chi tiết:
Yếu tố thay đổi áp suất làm chuyển dịch cân bằng chỉ xảy ra đối với những phản ứng có hệ số cân bằng của chất khí ở 2 bên là khác nhau
\({{\text{N}}_{\text{2}}}{\text{(k) + 3}}{{\text{H}}_{\text{2}}}{\text{(k)}}\overset {{t^o},xt,p} \leftrightarrows {\text{2N}}{{\text{H}}_{\text{3}}}{\text{(k)}}\) (bên tham gia là 4 bên tạo thành là 2 => khác nhau nên sẽ bị chuyển dịch)
\({{\text{H}}_{\text{2}}}{\text{(k) + }}{{\text{I}}_{\text{2}}}{\text{(k)}} \rightleftarrows {\text{2HI(k)}}\) (bên tham gia bằng bên tạo thành đều là 2 => không bị chuyển dịch)
\(2S{O_2}\left( k \right){\text{ }} + {\text{ }}{O_2}\overset {xt} \leftrightarrows \left( k \right)\;2S{O_3}\left( k \right)\) (bên tham gia là 3 bên tạo thành là 2 => khác nhau nên bị chuyển dịch)
\({\text{2N}}{{\text{O}}_{\text{2}}}{\text{(k)}} \rightleftarrows {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}{\text{(k)}}\) (bên tham gia là 2 bên tạo thành là 1 => khác nhau nên bị chuyển dịch)
Đáp án C
Câu hỏi 18 :
Cho hệ phản ứng sau ở trạng thái cân bằng:
2 SO2 + O2 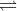 2 SO3 (k) ∆H < 0
2 SO3 (k) ∆H < 0
Nồng độ của SO3 sẽ tăng lên khi:
- A
Giảm nồng độ của SO2
- B
Tăng nồng độ của O2
- C Tăng nhiệt độ lên rất cao
- D Giảm nhiệt độ xuống rất thấp
Đáp án: B
Phương pháp giải:
Dựa vào nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Lời giải chi tiết:
Tăng nồng độ của O2 => phản ứng theo chiều làm giảm nồng độ của O2 xuống => chiều thuận (sinh ra SO3)
Đáp án B
Câu hỏi 19 :
Cho các phản ứng sau:
1. H2(k) + I2(r) ⇆ 2 HI(k) , ΔH > 0
2. 2NO(k) + O2(k) ⇆ 2 NO2 (k) , ΔH < 0
3. CO(k) + Cl2(k) ⇆ COCl2(k) , ΔH < 0
4. CaCO3(r) ⇆ CaO(r) + CO2(k) , ΔH > 0
Khi tăng nhiệt độ các cân bằng nào trên đây đều chuyển dịch theo chiều thuận?
D
- A 2,4
- B 1,3,4
- C 1,2
- D 1, 4
Đáp án: D
Phương pháp giải:
Để biện luận về sự chuyển dịch cân bằng, ta áp dụng nguyên lý Lơ-sa-tơ-li-ê:
Khi bất kỳ hệ thống nào ở trạng thái cân bằng trong một thời gian dài bị thay đổi nồng độ, nhiệt độ, thể tích, hoặc áp suất, thì hệ thống sẽ tự điều chỉnh phần nào để chống lại những hiệu ứng của sự thay đổi và một trạng thái cân bằng mới được thiết lập.
Lời giải chi tiết:
Đề bài yêu cầu tăng nhiệt độ môi trường => cân bằng sẽ dịch chuyển theo hướng phản ứng thu nhiệt (ΔH > 0)
Vậy các phản ứng thu nhiệt xảy ra theo chiều thuận là 1 và 4
Đáp án D
Câu hỏi 20 :
Cho các cân bằng hóa học:
N2 (k) + 3H2 \(\rightleftarrows \) 2NH3 (k) (1) H2 (k) + I2 (k) \(\rightleftarrows \) 2HI (k) (2)
2SO2 (k) + O2 (k) \(\rightleftarrows \) 2SO3 (k) (3) 2NO2 (k) \(\rightleftarrows \) N2O4 (k) (4)
Khi thay đổi áp suất những cân bằng hóa học bị chuyển dịch là:
- A (1), (2), (3).
- B (2), (3), (4).
- C (1), (2), (4).
- D (1), (3), (4).
Đáp án: D
Phương pháp giải:
Yếu tố áp suất ảnh hưởng tới những cân bằng có sự tham gia của chất khí và có tổng số mol ở 2 vế khác nhau.
Lời giải chi tiết:
Yếu tố áp suất ảnh hưởng tới những cân bằng có sự tham gia của chất khí và có tổng số mol ở 2 vế khác nhau.
Áp suất ảnh hưởng tới những cân bằng: (1) (3) (4)
Đáp án D
Câu hỏi 21 :
Xét các hệ cân bằng sau đây trong một bình kín:
(1) 2NaHCO3 (r) ⇆ Na2CO3 (r) + H2O (k) + CO2 (k)
(2) CO2 (k) + CaO (r) ⇆ CaCO3 (r)
(3) C (r) + CO2 (k) ⇆ 2CO (k)
(4) CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k)
Khi thêm CO2 vào hệ thì có bao nhiêu cân bằng chuyển dịch theo chiều thuận?
- A 1
- B 3
- C 2
- D 4
Đáp án: C
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Khi thêm CO2 vào các hệ cân bằng thì các cân bằng chuyển dịch theo chiều giảm nồng độ CO2.
(1) 2NaHCO3 (r) ⇆ Na2CO3 (r) + H2O (k) + CO2 (k)
⇒ Cân bằng chuyển dịch theo chiều nghịch
(2) CO2 (k) + CaO (r) ⇆ CaCO3 (r)
⇒ Cân bằng chuyển dịch theo chiều thuận
(3) C (r) + CO2 (k) ⇆ 2CO (k)
⇒ Cân bằng chuyển dịch theo chiều thuận
(4) CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k)
⇒ Cân bằng chuyển dịch theo chiều nghịch
Vậy có 2 cân bằng chuyển dịch theo chiều thuận là (2) và (3).
Chọn C.
Câu hỏi 22 :
Cho các cân bằng hóa học sau:
N2 (k) + 3H2 (k) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 (k) (1)
H2 (k) + I2 (k) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2HI (k) (2)
2SO2 (k) + O2 (k) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2SO3 (k) (3)
2NO2 (k) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)N2O4 (k) (4)
Khi thay đổi áp suất những cân bằng hóa học bị chuyển dịch là:
- A (1), (2), (3).
- B (1), (2), (4).
- C (1), (3), (4).
- D (2), (3), (4).
Đáp án: C
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Ở những cân bằng hóa học có tổng số mol khí các chất phản ứng khác tổng số mol khí các chất sản phẩm nên cân bằng chuyển dịch khi thay đổi áp suất.
→ Các cân bằng thỏa mãn là (1), (3), (4)
Chọn C.
Câu hỏi 23 :
Xét các hệ cân bằng sau đây trong một bình kín:
(1) 2NaHCO3 (r) ⇄ Na2CO3 (r) + H2O (k) + CO2 (k)
(2) CO2 (k) + CaO (r) ⇄ CaCO3 (r)
(3) C (r) + CO2 (k) ⇄ 2CO (k)
(4) CO (k) + H2O (k) ⇄ CO2 (k) + H2 (k)
Khi thêm CO2 vào hệ thì có bao nhiêu cân bằng chuyển dịch theo chiều nghịch?
- A 1
- B 3
- C 2
- D 4
Đáp án: C
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Khi thêm CO2 vào các hệ cân bằng thì các cân bằng chuyển dịch theo chiều giảm nồng độ CO2.
(1) 2NaHCO3 (r) ⇆ Na2CO3 (r) + H2O (k) + CO2 (k)
⇒ Cân bằng chuyển dịch theo chiều nghịch
(2) CO2 (k) + CaO (r) ⇆ CaCO3 (r)
⇒ Cân bằng chuyển dịch theo chiều thuận
(3) C (r) + CO2 (k) ⇆ 2CO (k)
⇒ Cân bằng chuyển dịch theo chiều thuận
(4) CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k)
⇒ Cân bằng chuyển dịch theo chiều nghịch
Vậy có 2 cân bằng chuyển dịch theo chiều nghịch là (1) và (4).
Chọn C.
Câu hỏi 24 :
Xét các cân bằng hóa học sau:
I. \(F{{\rm{e}}_3}{O_{4\,\,(r)}} + 4C{O_{(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3F{{\rm{e}}_{(r)}} + 4C{O_2}_{\,(k)}\)
II.\(Ba{O_{(r)}} + C{O_{2\,\,(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} BaC{{\rm{O}}_{3\,\,(r)}}\)
III.\({H_{2\,\,(k)}} + B{r_{2\,\,(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HB{r_{(k)}}\)
IV.\(2NaHC{O_3}(r) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{a_2}C{O_3}(r) + C{O_2}(k) + {H_2}O(k)\)
Khi tăng áp suất, các cân bằng hóa học không bị dịch chuyển là:
- A I, III.
- B I, IV
- C II, IV
- D II, III.
Đáp án: A
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Nếu phản ứng có số mol khí ở hai vế của phương trình hóa học bằng nhau hoặc phản ứng không có chất khí, thì áp suất không ảnh hưởng đến cân bằng.
→ Phản ứng I và III có số mol khí ở hai vế của phương trình hóa học không đổi nên áp suất không ảnh hưởng đến hai cân bằng này.
Chọn A.
Câu hỏi 25 :
Cho cân bằng (trong bình kín): CO(k) + H2O(k) \(\overset {{t^0}} \leftrightarrows \) CO2(k) + H2(k) ∆H < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm chất xúc tác; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) thêm một lượng CO
Dãy gồm các yếu tố đều làm chuyển dịch cân bằng của hệ là:
- A (1), (3), (4).
- B (1), (4), (5).
- C (2), (3), (4).
- D (1), (3), (5).
Đáp án: D
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
(1) tăng nhiệt độ → cân bằng chuyển dịch theo chiều giảm nhiệt độ → chuyển dịch theo chiều nghịch (vì chiều thuận ∆H < 0 là phản ứng tỏa nhiệt)
(2) thêm chất xúc tác: chất xúc tác có vai trò làm tăng tốc độ của phản ứng thuận và nghịch như nhau nên khi thêm sẽ không ảnh hưởng đến cân bằng của hệ.
(3) thêm một lượng H2 → cân bằng chuyển dịch theo chiều giảm lượng H2 → chuyển dịch theo chiều nghịch
(4) tăng áp suất chung của hệ: ta thấy phương trình trên có tổng số mol khí bên sản phẩm và chất tham gia phản ứng bằng nhau, do vậy áp suất không ảnh hưởng đến cân bằng của hệ.
(5) thêm một lượng CO → cân bằng chuyển dịch theo chiều giảm lượng CO → chuyển dịch theo chiều thuận.
→ (1), (3), (5) làm chuyển dịch cân bằng.
Chọn D.
Câu hỏi 26 :
Cho các phát biểu sau:
1. Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
2. Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
3. Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
4. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
5. Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là:
- A 2,3.
- B 3,4.
- C 3,5.
- D 4,5
Đáp án: C
Lời giải chi tiết:
Dựa vào khái niệm và đặc điểm của phản ứng thuận nghịch, cân bằng hóa học.
Hướng dẫn giải:
1. đúng
2. đúng
3. sai, cân bằng hóa học là phản ứng hóa học được cân bằng khi tốc độ phản ứng thuận = tốc độ phản ứng nghịch.
4. đúng
5. sai, phản ứng vẫn xảy ra nhưng tốc độ phản ứng thuận = tốc độ phản ứng nghịch
Vậy ý 3,5 sai
Đáp án C
Câu hỏi 27 :
Cho hai hệ cân bằng sau trong hai bình kín:
C(r) + CO2 (k) \( \rightleftarrows \) 2CO (k) ∆H = 172 kJ;
CO(k) + H2O (k) \( \rightleftarrows \) CO2 (k) + H2 (k) ∆H = -41 kJ;
Có bao nhiêu điều kiện trong các điều kiện sau đây làm các cân bằng trên chuyển dịch ngược chiều nhau(giữ nguyên các điều kiện khác)?
(1) Tăng nhiệt độ. (2) Thêm khí CO2. (3) Thêm khí H2 vào.
(4) Tăng áp suất. (5) Dùng chất xúc tác. (6) Thêm khí CO vào.
- A 5.
- B 2.
- C 4.
- D 3.
Đáp án: D
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Do vậy muốn 2 cân bằng chuyển dịch theo chiều ngược nhau thì các điều kiện thay đổi cũng phải ở các vế ngược nhau.
Lời giải chi tiết:
C(r) + CO2 (k) \( \rightleftarrows \) 2CO (k) ∆H = 172 kJ;
CO(k) + H2O (k) \( \rightleftarrows \) CO2 (k) + H2 (k) ∆H = -41 kJ;
- Hai phương trình có ∆H khác nhau và ngược dấu → nhiệt độ sẽ làm 2 cân bằng chuyển dịch ngược chiều nhau
- CO2 ở 2 phương trình nằm 2 vế khác nhau → thay đổi CO2 sẽ làm 2 cân bằng chuyển dịch ngược chiều
- CO ở 2 phương trình nằm 2 vế khác nhau → thay đổi CO sẽ làm 2 cân bằng chuyển dịch ngược chiều.
Vậy (1); (2); (6) là các điều kiện thỏa mãn→ có 3 điều kiện thỏa mãn
Chọn D.
Câu hỏi 28 :
Cho phản ứng hóa học sau ở trạng thái cân bằng: H2 (k) + I2 (k) \(\overset {} \leftrightarrows \) 2HI (k)
Cân bằng này có nhiệt phản ứng theo chiều thuận âm, ∆H < 0 (phản ứng tỏa nhiệt).
Trường hợp nào sau đây không làm chuyển dịch cân bằng của phản ứng?
- A Tăng nồng độ khí H2 lên gấp đôi.
- B Tăng áp suất của hệ.
- C Tăng nhiệt độ của hệ.
- D Tăng nồng độ khí HI lên gấp đôi.
Đáp án: B
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Những cân bằng có tổng số mol khí hai vế bằng nhau hoặc không có chất khí thì áp suất không ảnh hưởng đến cân bằng.
Lời giải chi tiết:
A. Tăng nồng độ H2 lên gấp đôi cân bằng chuyển dịch theo chiều giảm nồng độ H2 → cân bằng chuyển dịch theo chiều thuận.
B. Cân bằng có tổng số mol khí hai vế bằng nhau nên áp suất không ảnh hưởng đến chuyển dịch cân bằng.
C. Tăng nhiệt độ cân bằng chuyển dịch theo chiều giảm nhiệt độ → cân bằng chuyển dịch theo chiều nghịch.
D. Tăng nồng độ khí HI lên gấp đôi cân bằng chuyển dịch theo chiều giảm nồng độ HI → cân bằng chuyển dịch theo chiều nghịch.
Chọn B.
Câu hỏi 29 :
Cho cân bằng sau: 2SO2 (k) + O2 (k) \( \rightleftarrows \) 2SO3 (k); ∆H = -192,5kJ
Để tăng hiệu suất của quá trình sản xuất SO3, người ta cần:
- A giảm nhiệt độ của hệ phản ứng, dùng xúc tác.
- B giữ phản ứng ở nhiệt độ thường, giảm áp suất.
- C tăng nhiệt độ của hệ phản ứng, dùng xúc tác.
- D giảm nhiệt độ và tăng áp suất của hệ phản ứng.
Đáp án: D
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Do vậy để tăng hiệu suất của quá trình sản xuất SO3 thì cân bằng phải chuyển dịch theo chiều tạo ra SO3 nhiều hơn, tức là theo chiều thuận.
Lời giải chi tiết:
Để tăng hiệu suất của quá trình sản xuất SO3 thì cân bằng phải chuyển dịch theo chiều tạo ra SO3 nhiều hơn, tức là theo chiều thuận.
∆H < 0 nên phản ứng thuận là phản ứng tỏa nhiệt. → muốn cân bằng chuyển dịch theo chiều thuận thì phải giảm nhiệt độ.
Trước phản ứng số mol khí nhiều hơn số mol khí sau phản ứng. Do đó để cân bằng chuyển dịch theo chiều thuận thì phải tăng áp suất.
Vậy đáp án đúng là đáp án D.
Chọn D.
Câu hỏi 30 :
Sự nhị hợp khí màu nâu NO2 tạo khí N2O4 tạo khí N2O không màu là một phản ứng tỏa nhiệt và cân bằng.
2NO2 \( \rightleftarrows \) N2O4. Cho khí NO2 vào một ống nghiệm đậy nắp kín ở 300C. Đợi một thời gian để khi trong ống đạt cân bằng. Sau đó, đem ngâm ống nghiệm này trong chậu nước đá 00C, thì sẽ có hiện tượng gì kể từ lúc đem ngâm nước đá?
- A Màu nâu trong ống không đổi.
- B Màu nâu trong ống nhạt dần.
- C Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều thu nhiệt, nên màu nâu trong ống không đổi.
- D Cả A và C đúng.
Đáp án: B
Phương pháp giải:
Chiều thuận là phản ứng tỏa nhiệt (∆H <0)
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Chiều thuận là phản ứng tỏa nhiệt, do vậy khi giảm nhiệt độ từ 300C xuống ngâm trong chậu nước đá 00C cân bằng sẽ chuyển dịch chống lại chiều giảm nhiệt độ → cân bằng chuyển dịch theo chiều tăng nhiệt độ là chiều thuận.
→ từ khí NO2 chuyển dịch thành N2O do vậy màu nâu trong ống nhạt dần.
Chọn B.
30 câu hỏi lý thuyết về cân bằng hóa học có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
20 câu hỏi bài tập về cân bằng hóa học có đáp án và lời giải chi tiết từ cơ bản tới nâng cao, từ bài dễ tới bài khó đầy đủ các dạng đầy đủ từ trắc nghiệm tới tự luận
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









