25 bài toán luyện tập xác định số khối, điện tích hạt nhân có lời giải
Làm đề thiCâu hỏi 1 :
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. số khối của X là:
- A 11
- B 12
- C 23
- D 34
Đáp án: C
Phương pháp giải:
Tổng hạt: p + n + e = 2p + n => (1)
Số hạt mang điện nhiều hơn số hạt không mang điện: (p + e) – n = 2p – n (2)
Giải (1) và (2) thu được p và n
Tính số khối: A = p + n
Lời giải chi tiết:
Tổng số hạt của X = 34 => n + p + e = 34
p = e => 2p + n = 34 (1)
số hạt mang điện nhiều hơn số hạt không mang điện 10 hạt => 2p – n = 10 (2)
Giải hệ (1) và (2) => p = 11 và n = 12
Số khối = p + n = 11 + 12 = 23
Đáp án C
Câu hỏi 2 :
Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 40 hạt. Trong hạt nhân của Y, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Y có số khối là:
- A 24
- B 27
- C 28
- D 32
Đáp án: B
Phương pháp giải:
- Tổng số hạt cơ bản: 2p + n
- Trong hạt nhân số hạt mang điện nhiều hơn số hạt không mang điện: p - n
Lời giải chi tiết:
Y có: p + n + e = 2p + n = 40 ; Trong hạt nhân Y : n – p = 1
=> p = 13, n = 14
=> A = p + n = 13 + 14 = 27
Đáp án B
Câu hỏi 3 :
Nguyên tố Y có khả năng tạo thành ion Y2+. Trong cation Y2+, tổng số hạt cơ bản là 34 hạt, trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Số hiệu nguyên tử của Y là:
- A 11.
- B 12.
- C 19.
- D 20.
Đáp án: B
Phương pháp giải:
- Tổng số hạt cơ bản của Y2+: 2p + n – 2 = 34
- Số hạt mang điện nhiều hơn số hạt không mang điện: (2p – 2) – n = 10
Lời giải chi tiết:
Y2+ có : số hạt mang điện là [p + (e – 2)]
=> [p + (e – 2)] – n = 10
=> 2p – n = 12
Y2+ có 34 hạt cơ bản => Y có 34 + 2 = 36 hạt cơ bản
=> p + e + n = 2p + n = 36
=> p = 12 ( p là số hiệu nguyên tử của Y)
=>B
Câu hỏi 4 :
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt, số khối của X là 23. Số notron của X là:
- A 11.
- B 12.
- C 13.
- D 23.
Đáp án: B
Phương pháp giải:
- Tổng số hạt: 2p + n
- Số khối: p + n
Lời giải chi tiết:
X có : p + n + e = 2p + n = 34 ; ZX = p + n = 23
=> n = 12
=>B
Câu hỏi 5 :
Một nguyên tử X có tổng số hạt là 62 và có số khối A <43. Số nơtron của nguyên tử X là
- A 26
- B 24
- C 22
- D 20
Đáp án: C
Phương pháp giải:
Phương pháp p ≤ n ≤ 1,52p
Nên ta tìm được khoảng giá trị của p và chọn p nguyên
Lời giải chi tiết:
Lời giải
Tổng số hạt p, n,e trong X là 2p + n =62
Vì với một chất bất kì đều có p ≤ n ≤ 1,52p nên17,6 ≤p ≤20,67
Với p=18 thì n = 26 nên A =44 loại
Với p=19 thì n=24 nên A =43 loaij
Với p=20 thì n=22 nên A =42 thỏa mãn
Đáp án C
Câu hỏi 6 :
Một nguyên tố X có 13 electron và 14 nơtron. Nguyên tố X có kí hiệu nguyên tử là:
- A
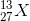
- B
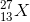
- C
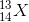
- D
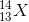
Đáp án: B
Lời giải chi tiết:
Nguyên tố X có kí hiệu nguyên tử 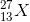
Đáp án B
Câu hỏi 7 :
Một nguyên tử X có tổng số hạt là 58 và có số khối A < 40. Số proton của nguyên tử X là:
- A 18
- B 20
- C 19
- D 20
Đáp án: C
Phương pháp giải:
Phương pháp p ≤ n ≤ 1,52p Nên ta tìm được khoảng giá trị của p và chọn p nguyên
Lời giải chi tiết:
Lời giải
Tổng số hạt p, n,e trong X là 2p + n =58
Vì với một chất bất kì đều có p ≤ n ≤ 1,52p nên16,47 ≤p ≤19,33
Với p=17 thì n = 24 nên A =41 loại
Với p=18 thì n=22 nên A =40 loại
Với p=19 thì n=20 nên A =39 thỏa mãn
Đáp án C
Câu hỏi 8 :
Tổng số hạt cơ bản trong một nguyên tử là 82 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của nguyên tử đó là:
- A 57
- B 56
- C 55
- D 65
Đáp án: B
Phương pháp giải:
Phương pháp :
Z = số E và A = số P + số N = Số E + số N
P = E ( hạt mang điện dương bằng hạt mang điện âm )
N : hạt ko mang điện
Lời giải chi tiết:
Hướng dẫn Giải :
Ta có hệ : 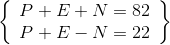 => P + E = 52 : N = 30
=> P + E = 52 : N = 30
Mà P = E => P = E = 52 : 2 = 26
=>A = 26 + 30 = 56
Đáp án B
Câu hỏi 9 :
Tổng số các haṭ trong nguyên tử của nguyên tố R là 114. Số haṭ mang điên nhiều hơn số haṭ không mang điên là 26 hạt. Số khối của R là
- A 144
- B 79
- C 44
- D 35
Đáp án: B
Phương pháp giải:
Gọi số p = số e = Z; số n = N
- Tổng số hạt: p + e + n = 2Z + N
- Số hạt mang điện: p + e = 2Z
- Số hạt không mang điện: N
Dựa vào dữ kiện đề bài lập hệ phương trình ẩn Z, N. Giải tìm Z, N
=> Số khối A = Z + N
Lời giải chi tiết:
Gọi số p = số e = Z; số n = N
- Tổng số hạt: p + e + n = 2Z + N
- Số hạt mang điện: p + e = 2Z
- Số hạt không mang điện: N
Theo đề bài ta có:
\(\left\{ \begin{array}{l}
2Z + N = 114\\
2Z - N = 26
\end{array} \right. \to \left\{ \begin{array}{l}
Z = 35\\
N = 44
\end{array} \right.\)
=> Số khối A = Z + N = 35 + 44 = 79
Đáp án B
Câu hỏi 10 :
Cho nguyên tử nguyên tố R có 82 hạt . Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Số khối của nguyên tử R là?
- A 52
- B 18
- C 56
- D 54
Đáp án: C
Phương pháp giải:
Đặt số p = số e = Z; số n = N
- Tổng hạt: 2Z + N
- Số hạt mang điện nhiều hơn số hạt không mang điện: 2Z – N
Dựa vào dữ kiện đề bài lập hệ phương trình giải tìm Z và N
Số khối: A = Z + N
Lời giải chi tiết:
Đặt số p = số e = Z; số n = N
- Tổng hạt: 2Z + N = 82 (1)
- Số hạt mang điện nhiều hơn số hạt không mang điện: 2Z – N = 22 (2)
Giải (1) và (2) => Z = 26 và N = 30
=>Số khối A = Z + N = 26 + 30 = 56
Đáp án C
Câu hỏi 11 :
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là :
- A 27
- B 23
- C 28
- D 26
Đáp án: A
Phương pháp giải:
Gọi số p = số e = Z; số n = N
- Tổng số hạt = số p + số e + số n = 2Z + N
- Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện (n): 2Z – N
Lời giải chi tiết:
Gọi số p = số e = Z; số n = N
- Tổng số hạt = số p + số e + số n = 2Z + N = 40 (1)
- Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện (n): 2Z – N = 12 (2)
Giải (1) và (2) thu được Z = 13 và N = 14
Số khối A = Z + N = 13 + 14 = 27
Đáp án A
Câu hỏi 12 :
Nguyên tử kali có 19 proton, 19 electron và 20 notron. Số khối của nguyên tử kali là
- A 20.
- B 19.
- C 38.
- D 39.
Đáp án: D
Phương pháp giải:
Trong một nguyên tử trung hòa về điện:
Số p = Số e = Z; Số n = N
Số khối: A = Z + N
Lời giải chi tiết:
Nguyên tử kali có 19 proton, 19 electron và 20 notron
Số p = Số e = Z = 19; Số n = N = 20
Số khối: A = Z + N = 19 + 20 = 39
Đáp án D
Câu hỏi 13 :
Nguyên tử R có 38 hạt mang điện và 20 hạt không mang điện, kí hiệu nào sau đây đúng?
- A \({}_{38}^{80}{\rm{R}}\)
- B \({}_{19}^{39}R\)
- C \({}_{{\rm{19}}}^{{\rm{20}}}{\rm{R}}\)
- D \({}_{20}^{40}{\rm{R}}\)
Đáp án: B
Phương pháp giải:
Kí hiệu hóa học của nguyên tố là với A là số khối, Z là số hiệu nguyên tử.
Từ đó ta viết được kí hiệu hóa học của nguyên tố R.
Lời giải chi tiết:
Nguyên tử R có 38 hạt mang điện và 20 hạt không mang điện nên số proton= Z= 38 : 2= 19 và số notron = 20.
Số khối A= Z + N= 19 + 20= 39.
Vậy kí hiệu đúng là R.
Đáp án B
Câu hỏi 14 :
Tổng số hạt cơ bản trong M2+ là 90, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. M là
- A Cu.
- B Cr.
- C Zn.
- D Fe.
Đáp án: A
Phương pháp giải:
Lập hệ phương trình: P + N + E – 2 (số electron bị mất để hình thành M2+) = 90
và (P + E) – N = 22. Giải được P, N, E
Lời giải chi tiết:
Ta có hệ phương trình
\(\left\{ \begin{array}{l}
{\rm{P + N + E - 2 = 90}}\\
{\rm{(P + E - 2) - N = 22}}
\end{array} \right. \to \left\{ \begin{array}{l}
{\rm{2P + N = 92}}\\
{\rm{2P - N = 24}}
\end{array} \right. \to \left\{ \begin{array}{l}
{\rm{P = 29}}\\
{\rm{N = 34}}
\end{array} \right.\)
→ Z = P = 29
Đáp án A
Câu hỏi 15 :
Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 95, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Nhận định nào dưới đây về X là không đúng ?
- A X có 30 electron ở lớp vỏ
- B Số hạt mang điện của X là 65
- C X có 35 hạt không mang điện
- D Số khối của X là 65
Đáp án: B
Phương pháp giải:
Dựa vào đặc điểm các hạt p, n và e trong nguyên tử để lập hệ phương trình tìm số p, số n và số e trong nguyên tử X.
Từ đó tìm nhận định không đúng.
Lời giải chi tiết:
Gọi số hạt p (bằng số hạt e) trong nguyên tử nguyên tố X bằng Z.
Gọi số hạt n trong nguyên tử nguyên tố X bằng N.
Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 95 nên 2Z + N= 95
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt nên 2Z – N= 25
Giải hệ trên ta có Z= 30 và N = 35
Vậy X có 30 electron ở lớp vỏ. Suy ra phát biểu A đúng.
X có 35 hạt notron. Suy ra phát biểu C đúng.
Ta có A= Z + N= 65 nên phát biểu D đúng.
X có 30 + 30= 60 hạt mang điện nên phát biểu B không đúng.
Đáp án B
Câu hỏi 16 :
Tổng số hạt proton, notron, electron trong nguyên tử của một nguyên tố là 13. Số khối của nguyên tử là:
- A 8.
- B 10.
- C 11.
- D 9.
Đáp án: D
Phương pháp giải:
Dựa vào tổng số hạt proton, notron, electron trong nguyên tử và điều kiện Z ≤ N ≤ 1,5Z để biện luận tìm Z và N. Từ đó tính được số khối.
Lời giải chi tiết:
Gọi số proton (electron), số notron của nguyên tử lần lượt là Z và N.
Tổng số hạt proton, notron, electron trong nguyên tử của một nguyên tố là 13 nên 2Z + N = 13
→ N = 13 – 2Z (1)
Trong nguyên tử ta có Z ≤ N ≤ 1,5Z (2)
Thay (1) vào (2) ta có: Z ≤ 13 – 2Z ≤ 1,5Z → 3,71 ≤ Z ≤ 4,33
Vì Z là số nguyên nên Z = 4. Thay vào (1) được N= 5.
Vậy số khối của nguyên tử bằng A = Z + N = 9
Đáp án D
Câu hỏi 17 :
Nguyên tử của nguyên tố X có tổng số hạt là 40, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là:
- A 27.
- B 26.
- C 28.
- D 23.
Đáp án: A
Phương pháp giải:
Gọi số proton (electron), số notron của nguyên tử lần lượt là Z và N.
Nguyên tử của nguyên tố X có tổng số hạt là 40 → 2Z + N= 40
Vì tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt nên 2Z – N = 12
Giải hệ trên tìm được Z và N. Từ đó tính được số khối A = Z + N.
Lời giải chi tiết:
Gọi số proton (electron), số notron của nguyên tử lần lượt là Z và N.
Nguyên tử của nguyên tố X có tổng số hạt là 40 → 2Z + N= 40
Vì tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt nên 2Z – N = 12
Giải hệ trên ta được Z = 13 và N = 14
Số khối của nguyên tố là A = Z + N = 13 + 14 = 27.
Đáp án A
Câu hỏi 18 :
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34. Số hạt không mang điện nhiều hơn số hạt mang điện âm là 1. Tìm Z, A của X. Viết kí hiệu nguyên tử nguyên tố X.
Phương pháp giải:
- Giả sử X có: số p = số electron = Z và số n = N.
Từ đề bài lập phương trình liên quan N và Z. Từ đó tìm được Z, A của X
- Kí hiệu nguyên tố X có dạng ZAX.
Lời giải chi tiết:
Giả sử X có: số p = số electron = Z và số n = N.
+ Tổng số hạt cơ bản là 34 => 2Z + N = 34 (1)
+ Số hạt không mang điện nhiều hơn số hạt mang điện âm là 1 => N - Z = 1 (2)
Giải hệ (1) và (2) thu được: Z = 11; N =12.
=> Số khối: A = Z + N = 11 + 12 = 23.
Kí hiệu nguyên tử nguyên tố X là \({}_{11}^{23}X\)
Câu hỏi 19 :
Tổng số hạt mang điện trong nguyên tử X là 112. Số proton trong X là
- A 112.
- B 56.
- C 48.
- D 55.
Đáp án: B
Phương pháp giải:
Nguyên tử trung hòa về điện nên số proton = số electron
Lời giải chi tiết:
Số hạt mang điện là proton và electron
Nguyên tử trung hòa về điện nên số proton = số electron = 112/2 = 56 (hạt)
Đáp án B
Câu hỏi 20 :
Nguyên tử X có tổng số hạt proton, nơtron và electron là 116, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 24. Số khối của hạt nhân nguyên tử X là
- A 35
- B 46
- C 81
- D 79
Đáp án: C
Phương pháp giải:
Gọi số hạt proton (số hạt electron) trong nguyên tử X là Z, số hạt notron trong nguyên tử X là N.
+ Tổng hạt của X: p + e + n = 2Z + N
+ Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện (n): p + e - n = 2Z - N
Lập hệ phương trình giải tìm được Z, N → A = Z + N
Lời giải chi tiết:
Gọi số hạt proton (số hạt electron) trong nguyên tử X là Z, số hạt notron trong nguyên tử X là N.
+ Tổng hạt của X: p + e + n = 2Z + N = 116 (1)
+ Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện (n): p + e - n = 2Z - N = 24 (2)
Giải hệ ta được Z = 35 và N = 46.
→ Số khối của hạt nhân nguyên tử X là: A = Z + N = 81.
Đáp án C
Câu hỏi 21 :
Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Số hiệu nguyên tử của X là
- A 17
- B 18
- C 34
- D 52
Đáp án: A
Phương pháp giải:
Giả sử X có số p = số e = Z và số n = N
- Tổng hạt p, n, e là 2Z + N
- Số khối A = Z + N
Từ đề bài ta lập hệ phương trình và tìm được Z, N.
Lời giải chi tiết:
Giả sử X có số p = số e = Z và số n = N
- Tổng hạt p, n, e là 2Z + N = 52
- Số khối A = Z + N = 35
Giải hệ ta được Z = 17 và N = 18
Vậy số hiệu nguyên tử của X là Z = 17.
Đáp án A
Câu hỏi 22 :
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
- A 27.
- B 26.
- C 28.
- D 23
Đáp án: A
Phương pháp giải:
Giả sử X có số p = số e = Z và số n = N
+ Tổng hạt p, e, n là 2Z + N
+ Tổng số hạt mang điện (p, e) nhiều hơn tổng số hạt không mang điện (n) là 2Z - N
Từ đề bài lập hệ phương trình giải tìm được Z, N.
→ Số khối A = Z + N
Lời giải chi tiết:
Giả sử X có số p = số e = Z và số n = N
+ Tổng hạt p, e, n là 2Z + N = 40
+ Tổng số hạt mang điện (p, e) nhiều hơn tổng số hạt không mang điện (n) là 2Z - N = 12
Giải hệ trên ta tìm được Z = 13 và N = 14
Vậy số khối của X là A = Z + N = 27.
Đáp án A
Câu hỏi 23 :
Nhận định nào sau đây đúng khi nói về nguyên tử \(_{26}^{56}F{\rm{e}}\) ?
- A Hạt nhân có 30 proton và 26 nơtron.
- B Số khối là 26.
- C Số đơn vị điện tích hạt nhân là 26+.
- D Là nguyên tố họ d.
Đáp án: D
Phương pháp giải:
Kí hiệu nguyên tử \(_z^AX\)
+ X: kí hiệu của nguyên tố
+ z : số hiệu nguyên tử (bằng số proton, bằng số electron) → số đơn vị điện tích hạt nhân
+ A: số khối (A = z + N)
Lời giải chi tiết:
Nguyên tử \(_{26}^{56}F{\rm{e}}\) có:
+ 26 hạt proton, 26 hạt electron và 30 hạt nơtron
+ Số khối A = 56
+ Số đơn vị điện tích hạt nhân: 26
+ Cấu hình electron của Fe: 1s22s22p63s23p63d64s2 → Fe là nguyên tố d, thuộc phân nhóm phụ.
Đáp án D
Câu hỏi 24 :
Hai nguyên tử X và Y tạo thành phân tử XY có chứa 28 proton. Biết rằng:
+ X và Y đều có số hạt proton bằng số notron.
+ số khối của X lớn hơn số khối của Y là 24 đơn vị.
Số hiệu nguyên tử của X và Y lần lượt là:
- A 20 và 8
- B 24 và 4
- C 18 và 10
- D 17 và 9
Đáp án: A
Phương pháp giải:
- Phân tử XY có 28 proton (1)
- Số khối của X lớn hơn số khối của Y là 24 (2)
- Từ (1) và (2) tìm ra số hiệu nguyên tử của X và Y
Lời giải chi tiết:
Phân tử XY có 28 proton → pX+ pY = 28 (1)
Số khối của X lớn hơn số khối của Y 24 đơn vị → nX + pX – (nY + pY) = 24
Mà X và Y đều có số hạt nơtron bằng số proton → nX = pX; nY = pY
→ 2pX –2pY = 24 (2)
Từ (1) và (2) → pX = 20; pY = 8
Đáp án A
Câu hỏi 25 :
Nguyên tử X có tổng số hạt proton, nơtron, electron là 34 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. Số hiệu nguyên tử và số khối của X lần lượt là:
- A 11 và 12
- B 12 và 34
- C 11 và 23
- D 13 và 27
Đáp án: C
Phương pháp giải:
- Nguyên tử X có tổng số hạt là 34 (2)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 10 (2)
- Từ (1) và (2) tìm được p và n
- Tính số khối A = p + n
Lời giải chi tiết:
Nguyên tử X có số hạt p, n, e là 34 → p + n + e = 34 → 2p + n = 34 (1)
Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 → 2p – n = 10 (2)
Từ (1) và (2) → p = 11, n = 12
Số khối A = p + n = 11 + 12 = 23
Đáp án C
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









